-
2007年白细胞介素(IL)-35被确立为一个免疫抑制性细胞因子,此后很快成为自身免疫疾病研究热点[1-2]。IL-35由调节性T细胞(Tregs)、调节性B细胞(Bregs)、CD4+ Tregs分泌[1, 3],在许多体内外疾病模型,如急性胰腺炎[4]、胶原诱导性关节炎(CIA)[5]、牙周炎[6]、过敏性鼻炎、哮喘[7]以及冠心病中,均能抑制T细胞的扩增和免疫功能,且可以促进小鼠和人类Tregs发挥抑制作用[8-9]。而近些年研究表明卡介苗(BCG)可以作为免疫调节剂[10]和佐剂[11],针对自身免疫性疾病,如多发性硬化症、胰岛素依赖型糖尿病[12]、哮喘[13]等发挥免疫调节作用,许多实验[14-15]证实BCG可以加强Treg免疫反应,抑制一些炎性介质的产生[16]。既往已有研究[17]在小鼠眼睛玻璃体腔接种重组pcDNA3.1-IL-35质粒,以观察其角膜表达的移植物排斥相关细胞因子,以及在新生小鼠体内接种IL-12重组BCG干预实验性哮喘模型等[18],均表明重组质粒及重组BCG在体内发挥免疫作用的可实施性。本研究利用基因工程技术构建IL-35重组BCG,其分泌IL-35又保留了BCG的免疫调节作用,协同增强其免疫源性,为进一步探讨IL-35及BCG的生物学功能和开发新用途奠定了基础。
-
T4 DNA Ligase(TAKARA),DNA-Marker DL2000(TAKARA),DNA-Marker DL10000(TAKARA),FastDigest NotI(Thermo Fisher Scientific),FastDigest NotI(Thermo Fisher Scientific),Lipofectamine2000 Transfection Reagent(Invitrogen),HighPure Maxi Plasmid Kit[天根生化科技(北京)有限公司)],ProteinFind Anti-His Mouse Monoclonal Antibody(北京全式金生物技术有限公司),GAPDH Antibody(Proteintech Group) ProteinFind Goat Anti-Rabbit IgG(H+L),HRP Conjugate(北京全式金生物技术有限公司)Marker Ⅲ[天根生化科技(北京)有限公司],2×Fasttaq PCR MasterMix(南京金贝斯生物科技有限公司),Zeocin(Invitrogen),罗氏培养基(上海楚翘生物科技有限公司),抗酸染色液(上海跃腾生物)。
-
表达pBudCE4.1/GLS/IL12/OriM质粒由重庆医科大学杨春博士提供,大肠埃希菌Trans5αChemically Competent Cell来源于北京全式金生物技术有限公司,CHO 293T细胞来源于南京德亨文生物技术有限公司。
-
IL-35是由p35亚单位和EBI3亚单位组成的异二聚体。其基因序列通过化学合成的方法予以合成,从N端到C端的序列为6xHis Tag+EBI3 subunit+G rich linker+p35 subunit(pUC57-IL35,上海杰瑞生物技术有限公司),基因序列见图 1。然后将化学合成的IL-35基因插入到载体pZM03(pBudCE4.1/GLS/OriM)的NotI/ KpnI位点(见图 1)。
-
进行pBudCE4.1/GLS/IL12/OriM质粒酶切,配制反应液:FastDigest Green Buffer 5 μL,NotI 1uL、KpnI 1 μL,pZM03(pBudCE4.1/GLS/IL12/OriM) 1 μL,加灭菌用水至50 μL,轻轻混匀后瞬时离心,37℃保温5 min。
pBudCE4.1/GLS/IL12/OriM质粒酶切产物回收,柱平衡步骤:吸附柱CA2放入收集管中,向CA2中加入500 μL平衡液BL,12000 r/min离心1 min,弃废液,吸附柱放回收集管中。DNA样品经1%琼脂糖凝胶电泳后,溴化乙锭染色,紫外灯下从凝胶上将目的条带DNA切出放入干净的1.5mL Eppendorf管中称取重量。向胶块中加入3倍体积PN溶胶液,50 ℃水浴10 min,期间不断上下翻转离心管,确保胶块完全溶解。将融化的胶溶液转移到新吸附柱CA2中,室温放置2 min,12000 r/min离心30~60 s,弃废液,将吸附柱放回收集管中。向吸附柱CA2中加入600 μL漂洗液PW,12 000 r/min离心30~60 s后,倒掉废液。将吸附柱CA2放回收集管中,12000 r/min离心2 min,尽量去净漂洗液晾干。将吸附柱CA2放入干净的离心管中,向吸附膜中央位置悬空滴加适量洗脱65~70 ℃缓冲液EB,室温放置2 min。12 000 r/min离心2 min收集DNA溶液。回收DNA可立即使用或保存于-20 ℃备用。
IL-35 DNA片段的酶切,配制反应液FastDigest Green Buffer 5 μL,NotI 1 μL,KpnI 1 μL,pUC57-IL35 1 μg,加灭菌用水至50 μL,轻轻混匀后瞬时离心,37 ℃保温5 min。
IL-35酶切产物回收,按照TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0试剂盒说明书回收IL-35酶切产物。步骤同pBudCE4.1/GLS/IL12/OriM质粒酶切产物回收步骤。
酶切载体pBudCE4.1/GLS /OriM和IL-35酶切产物连接,反应液配制:T4 DNA Ligase Buffer 2 μL,酶切载体pBudCE4.1/GLS /OriM 50 ng,IL-35酶切产物50 ng,T4 DNA Ligase 1 μg,加灭菌用水至20 μL,16 ℃反应16 h。
重组质粒的PCR鉴定,在50 μL的PCR反应体系中,取模板为0.2 μL的质粒DNA,进行正常程序的PCR反应,同时设负对照,电泳检测是否扩增出特异条带。正向引物EF-1α Fwd:CAAGCCTCAGACAGTGGTTC,反向引物BGH CTAGAAGGCACAGTCGAGG。PCR扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸92 s,共循环35次,最后72 ℃继续延伸7 min。
-
连接产物转化大肠埃希菌感受态细胞(Trans5α Chemically Competent Cell),操作如下:(1)取感受态细胞100 μL,置于冰上融化,加入10 μL pBudCE4.1/GLS / IL35/OriM连接产物,轻轻混匀,冰浴30 min。(2)于42 ℃水浴中热激90 s,之后迅速将离心管移到冰浴中2 min。(3)向每个离心管中加入500 μL无菌的LB液体培养基(不含抗生素),混匀后置于37 ℃,200 r/min培养1 h,使细菌复苏。(4)3000 r/min离心5 min,留150~200 μL菌液,将菌液均匀涂布于含25 μg/μL Zeocin平板,将平板倒置于37 ℃培养箱中过夜。
pBudCE4.1/GLS/IL35/OriM质粒大提,挑取37 ℃培养过夜的转化大肠埃希菌感受态细胞单克隆细胞,接种于3 mL含有25 μg/mL Zeocin的LB液体培养基中,摇床中37 ℃,220 r/min培养至对数生长期。取菌液1 mL,接种至100 mL含有25 μg/mL Zeocin的LB液体培养基中,摇床中37 ℃,220 r/min培养过夜。室温10 000 r/min离心3 min收集细菌。向留有菌体沉淀的离心管中加入10 mL溶液P1(已加入RNase A),悬浮细菌细胞沉淀。向离心管中加入10 mL溶液P2,上下翻转6~8次,室温放置5 min。向离心管中加入10 mL溶液P4,上下翻转6~8次,至溶液出现白色分散絮状沉淀。然后室温放置10 min左右。10 000 r/min离心5~10 min,使白色沉淀离至管底,将全部溶液倒入过滤器中,滤液收集在干净的50 mL管中。向滤液中加入0.35倍滤液体积的异丙醇和1/2倍异丙醇体积的5 mol/L NaCl,上下颠倒充分混匀。4 ℃ 10 000 r/min离心30 min,轻轻倒掉上清液。向管中加入6 mL 70%乙醇充分漂洗沉淀,4 ℃ 10 000 r/min离心10 min,轻轻倒掉上清液,将其倒置在吸水纸上。将离心管敞口室温放置10~20 min,使乙醇充分挥发后加入1 mL洗脱缓冲液TE,充分溶解沉淀。Nanodrop2000测定质粒浓度,贮存于-20 ℃备用。
pBudCE4.1/GLS/IL35/OriM质粒转染CHO 293T细胞,转染前一天,胰酶消化细胞并计数,CHO 293T细胞铺板,使其在转染日密度为90%。转染:将4 μg pBudCE4.1/GLS/IL35/OriM溶于250 μL Opti-mem无血清培养基中。将10 μL Lipofectamine2000溶于250μL Opti-mem无血清培养基中,混匀室温放5 min。将A、B两管混合,放置20 min。转染期间,用PBS洗2次,将6孔板培养基换成Opti-mem,每孔1.5 mL。将C管mix加入6孔板对应孔中,6 h后换成有血清培养基。转染48 h后分别收集实验孔及对照孔的细胞对目标基因产物进行检测。Western blotting检测CHO 293T细胞中表达产物的IL-35。
-
接种一环BCG菌种,划线接种于罗氏培养基中,37 ℃培养箱培养28 d后挑取单菌落接种于3 mL苏通液体培养基中,摇床37 ℃,220 r/min培养14 d,用移液器无菌吸取1 mL菌液接种于100 mL苏通液体培养基,培养至对数生长期。将对数生长期的BCG菌株以预冷的100 mL甘油在4 ℃低温洗涤3次,取90 μL感受态细菌加入10 μL纯化的pBudCE4.1/GLS/IL35/OriM质粒,轻轻混匀,冰浴10 min,转入预冷的1 mm电转杯中,2500 V、4 ms电击一次,迅速加入0.8 mL苏通培养基,37 ℃孵育24 h。将上述菌液涂布到罗氏培养基上,37 ℃孵育28 d后挑取阳性菌落增菌后抽提质粒,以质粒抽提物1 μL为模板,PCR扩增IL-35。将鉴定正确的重组菌命名为“重组pBudCE4.1/GLS/IL35/OriM-BCG”。进行PCR鉴定,及抗酸染色,染色后自然干燥,油镜下观察。
-
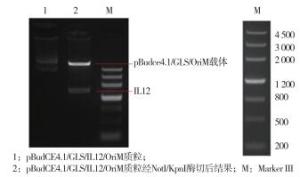
选取质粒,将其用NotI/KpnI双酶切,酶切产物经琼脂糖凝胶电泳显示,质粒已完全打开,将回收的酶切产物经琼脂糖凝胶电泳显示,出现一条pBudCE4.1/GLS/OriM质粒和一条约为1 633 bp的IL-12条带(见图 2),与理论值较符合。
-
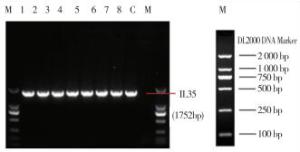
PCR产物经1.2%Agarose胶电泳鉴定,PCR产物电泳鉴定阳性的克隆送苏州金威智生物科技有限公司测序,结果可见1条长度为1 752 bp的IL-35条带(见图 3),在分子水平说明pBudCE4.1/GLS/IL35/OriM重组质粒构建成功。
-
pBudCE4.1/GLS/IL35/OriM重组质粒转染CHO 293T细胞后,细胞裂解液Western blotting检测到了IL-35蛋白的阳性表达,拍照结果可看到不同于GADPH对照,在CHO 293T细胞转染pBudCE4.1/GLS/IL35/OriM质粒后,出现IL-35较强阳性表达(见图 4),表明IL-35及酶切质粒构建成功。
-
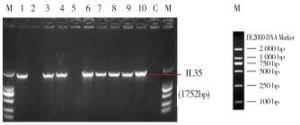
PCR产物经1.2%Agarose胶电泳鉴定,结果可见1条长度为1 752 bp的IL-35条带(见图 5),在分子水平说明pBudCE4.1/GLS/IL35/OriM-BCG重组质粒构建成功。
-
接种一环重组pBudCE4.1/GLS/IL35/OriM-BCG菌种划线接种于罗氏培养基,37 ℃培养箱培养28 d后挑取单菌落,油镜下可见大量聚集的红色的抗酸杆菌(见图 6),进一步证明重组菌构建成功,且状态良好。
-
已有实验证明,在与相应抗体结合后,作为IL-12家族中的一员,IL-35可以通过诱导Tregs[19-20]和Bregs[21]的分化、抑制T细胞扩增[22]和辅助性T细胞17(Th17)的分化[23]、以及调节Tregs和Th17[24]等,来发挥免疫抑制功能。最近又有研究[25]表明,IL-35可以抑制促血管生成素-2来减轻类风湿关节炎的炎症,但IL-35的确切作用免疫调节仍不清楚,还有待进一步研究。HU等[26]通过构建pcDNA3.1-IL-35 (pIL-35)重组质粒,并导入脂多糖诱导的急性肾损伤C57BL/6雄鼠模型中,结果发现与空白对照组小鼠相比,接种pIL-35的小鼠血尿素氮和血清肌酐明显降低,进而表明其肾功能较对照组有明显改善。ZHANG等[27]研究发现在右旋葡聚糖硫酸钠(DSS)诱导的溃疡性结肠炎BALB/c雄性小鼠模型中,在服用3% DSS溶液5 d后,分别接种大肠埃希菌IL-35重组菌(E.coli/IL-35)、大肠埃希菌(E.coli0)或PBS,发现重组E.coli/IL-35有效减轻小鼠DSS诱导的结肠炎,包括质量减轻和结肠缩短。以上实验结果均表明IL-35重组质粒在小鼠体内注射均能发挥免疫抑制作用,从而促进机体恢复健康。BCG是牛结核分枝杆菌的突变株,用于接种新生儿来预防结核病,在其安全性被确定后,BCG在全世界范围内推广应用,是目前官方承认的预防结核病最安全有效的疫苗[28],BCG作为一种细胞内寄生菌,接种到机体后,既可以刺激机体产生体液免疫,也能刺激机体产生细胞免疫,是一类有广泛前景的新疫苗。新生儿期接种BCG,不仅可以预防结核病,并且通过降低IL-4分泌、提高IFN-γ/ IL-4水平和抑制IL-17A的表达,从而有助于减轻哮喘模型小鼠肺部的炎症反应[29]。随着分子生物学技术水平的提高和基因工程技术的进步,BCG不仅是是一种活疫苗,还易于接受外源基因的导入,可以通过改变启动子纠正表达不均衡的外源基因,进而使得外源蛋白得以稳定表达,因此BCG也是一种非常理想的疫苗活载体[30]。重组BCG是将外源基因导入BCG内,并利用BCG的活疫苗的特性,制成微生物制剂后可产生针对不同抗原免疫应答的疫苗。国内外已有多个研究[31-32]将细菌、病毒、原虫、寄生虫以及细胞因子在内的多种蛋白基因融合到BCG中,预防多种疾病。
本研究从分子、蛋白等水平证实成功构建IL-35重组BCG表达载体,并在CHO 293T细胞中实现了表达,为深入研究IL-35以及重组BCG在自身免疫性疾病、肿瘤、炎症等领域中的功能和开发新用途奠定坚实的基础。
IL-35重组卡介苗的构建及鉴定
Construction and identification of the IL-35-BCG recombinant vaccine
-
摘要:
目的构建分泌性表达白细胞介素(IL)-35真核载体pZM03(pBudCE4.1/GLS/IL35/OriM)-重组卡介苗(BCG)。 方法在化学合成的IL-35基因片段中插入pBudCE4.1/GLS/OriM,将合成后序列插入到IL-12真核共表达载体pBudCE4.1/GLS/IL12/OriM的质粒酶切回收产物pBudCE4.1/GLS/OriM中,构建表达IL-35的穿梭/共表达质粒重组质粒pZM03(pBudCE4.1/GLS/IL35/OriM),再以重组质粒电转化到BCG,构建表达IL-35和BCG的重组pBudCE4.1/GLS/IL35/OriM-BCG。 结果重组质粒pZM03(pBudCE4.1/GLS/IL35/OriM)经PCR扩增、测序鉴定,以及在CHO 293T细胞中表达产物的Western blotting检测,从转录和翻译水平对目标基因产物进行检测验证,pBudCE4.1/GLS/IL35/OriM-BCG在细胞水平经抗酸染色验证,证实基因IL-35正确插入载体pBudCE4.1/GLS/OriM中,且pBudCE4.1/GLS/IL35/OriM-BCG构建成功。 结论重组质粒pBudCE4.1/GLS/IL35/OriM-BCG可正确表达IL-35,为进一步研究IL-35功能及其应用价值奠定了良好的基础。 Abstract:ObjectiveTo construct the recombinant eukaryotic expression vector pZM03 (pBudCE4.1/GLS/IL35/OriM) containing secretory protein of interleukin 35 (IL-35)-bacillus calmette guerin (BCG)recombinant vaccine. MethodsThe chemically synthesized IL-35 gene fragment was cloned into the pBudCE4.1/GLS/OriM, the pBudCE4.1/GLS/IL35/OriM was obtained from the pBudCE4.1/GLS/IL12/OriM, and both of above was used to construct the co-expression vector pZM03 (pBudCE4.1/GLS/IL35/OriM).The recombinant plasmid pZM03 was electrotransformated into the BCG to construct the recombinant co-expression of IL-35 and BCG plasmid pBudCE4.1/GLS/IL35/OriM-BCG. ResultsThe results of the detection of gene, transcription, translation and cellular levels, which included the PCR, sequencing, Western blotting and acid-fast staining methods, showed that the pBudCE4.1/GLS/IL35/OriM-BCG was successfully constructed. ConclusionThe recombinant plasmid pBudCE4.1/GLS/IL35/OriM-BCG can correctly express IL-35, which lays a good foundation for further research on the function and application value of IL-35. -
Key words:
- bacillus calmette guerin /
- interleukin-35 /
- recombinant plasmid
-
[1] SAWANT DV, HAMILTON K, VIGNALI DA, et al.Interleukin-35:expanding its job profile[J].J Interferon Cytokine Res, 2015, 35(7):499. doi: 10.1089/jir.2015.0015 [2] THIOLAT A, DENYS A, PETIT M, et al.Interleukin-35 gene therapy exacerbates experimental rheumatoid arthritis in mice[J].Cytokine, 2014, 69(1):87. [3] WANG RX, YU CR, DAMBUZA IM, et al.Interleukin-35 induces regulatory B cells that suppress autoimmune disease[J].Nat Med, 2014, 20(6):633. doi: 10.1038/nm.3554 [4] ZHANG YL, ZHOU XY, GUO XY, et al.Association between serum interleukin-35 levels and severity of acute pancreatitis[J].Int J Clin Exp Med, 2015, 8(5):7430. [5] FILKOVA M, VEMEROVA Z, HULEJOVA H, et al.Pro-in Tammatory effects of interleukin-35 in rheumatoid arthritis[J].Cytokine, 2015, 73(1):36. [6] KOSEOGLU S, SAGLAM M, PEKBAGRIYANIK T, et al.Level of interleukin-35 ingingival crevicular Tuid, saliva, and plasma in periodontal disease and health[J].J Periodontol, 2015, 86(8):964. doi: 10.1902/jop.2015.140666 [7] DING LF, CHEN Q, LI L, et al.Effects of sublingual immunotherapy on serum IL-17 and IL-35 levels in children with allergic rhinitis or asthma[J].Zhongguo Dang Dai Er Ke Za Zhi, 2014, 16(12):1206. [8] COLLISON LW, PILLAI MR, CHATURVEDI V, et al.Regulatory T cell suppression is potentiated by target T cells in a cell contact:IL-35-and IL-10-dependent manner[J].J Immunol, 2009, 182(10):6121. doi: 10.4049/jimmunol.0803646 [9] COLLISON LW, WORKMAN CJ, KUO TT, et al.The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature, 2007, 450(7169):566. doi: 10.1038/nature06306 [10] TIAN X, TIAN X, HUO R, et al.Bacillus Calmette-Guerin alleviates airway inflammation and remodeling by preventing TGF-beta1 induced epithelial-mesenchymal transition[J].Hum Vaccin Immunother, 2017, 13(8):1758. doi: 10.1080/21645515.2017.1313366 [11] MOHAMMADI SV, REZAEI A, ANDALIB A, et al.Immunomodulatory effects of adjuvants CPG, MPLA, and BCG on the Derp2-induced acute asthma at early life in an animal model of BALB/c mice[J].Inflammation, 2017, 40(1):259. [12] KOWALEWICZ KM, LOCHT C.BCG and protection against inflammatory and auto-immune diseases[J].Expert Rev Vaccines, 2017, 16(7):1. [13] SOUZA MA, CRUZ AA.BCG vaccination and reduced risk of asthma[J].J Bras Pneumol, 2010, 36(3):275. doi: 10.1590/S1806-37132010000300001 [14] CUI Y, CHOI IS, KOH YA, et al.Effects of combined BCG and DHEA treatment in preventing the development of asthma[J].Immunol Invest, 2008, 37(3):191. [15] KE X, HUANG J, CHEN Q, et al.Protective effects of combined Mycobacterium bovis BCG and interleukin-12 vaccination on airway inflammation in a murine model of allergic asthma[J].Clin Invest Med, 2010, 33(3):196. doi: 10.25011/cim.v33i3.13726 [16] DENG Y, LI W, LUO Y, et al.Inhibition of IFN-gamma promotes anti-asthma effect of Mycobacterium bovis Bacillus Calmette-Guerin neonatal vaccination:a murine asthma model[J].Vaccine, 2014, 32(18):2070. doi: 10.1016/j.vaccine.2014.02.007 [17] HOU C, WU Q, OUGYANG C, et al.Effects of an intravitreal injection of interleukin-35-expressing plasmid on pro-infl ammatory and anti-infl ammatory cytokines[J].Int J Mol Med, 2016, 38(3):713. doi: 10.3892/ijmm.2016.2688 [18] 邓昱.IL-12+重组卡介苗新生期接种干预实验性哮喘模型的作用及其机制研究[D].重庆: 重庆医科大学, 2010. [19] CASTELLANI ML, ANGEIANAKI A, FELACO P, et al.IL-35, an antiinflammatory cytokine which expands CD4+CD25+ Treg cells[J].J Biol Regul Homeost Agents, 2010, 24(2):131. [20] TARIQUE M, SAINI C, NAQVI RA, et al.Increased IL-35 producing Tregs and CD19+IL-35+ cells are associated with disease progression in leprosy patients[J].Cytokine, 2017, 91:82. doi: 10.1016/j.cyto.2016.12.011 [21] SHEN H, WANG C, FAN E, et al.Upregulation of interleukin-35 subunits in regulatory T cells in a IL-35 alleviates lipopolysaccharide-Induced acute kidney injury murine model of allergic rhinitis[J].J Otorhinolaryngol, 2014, 76(5):237. [22] ZHAO N, LI H, YAN Y, et al.Mesenchymal stem cells overexpressing IL-35 effectively inhibit CD4+ T cell function[J].Cellular Immunology, 2017, 312:61. doi: 10.1016/j.cellimm.2016.12.001 [23] NIEDBALA W, WEI XQ, CAI B, et al.IL-35 is a novel cytokine withtherapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J].Eur J Immunol, 2007, 37(11):3021. doi: 10.1002/eji.200737810 [24] ZHANG F, LI MY, LAN YT, et al.Imbalance of Th17/Tregs in rats with smoke inhalation-induced acute lung injury[J].Sci Rep, 2016, 6:21348. doi: 10.1038/srep21348 [25] JIANG S, LI Y, LIN T, et al.IL-35 inhibits angiogenesis through VEGF/Ang2/Tie2 pathway in rheumatoid arthritis[J].Cellular Physiol Biochemistry, 2016, 40(5):1105. doi: 10.1159/000453165 [26] HU L, CHEN C, ZHANG J, et al.IL-35 pretreatment alleviates lipopolysaccharide-induced acute kidney injury in mice by inhibiting NF-κB activation[J].Inflammation, 2017, 40(4):1393. [27] ZHANG B, LIU Y, LAN X, et al.Oral escherichia coli expressing IL-35 meliorates experimental colitis in mice[J].J Transl Med, 2018, 16(1):71. [28] 李忠明.当代新疫苗[M].北京:高等教育出版社, 2001:93. [29] 沈雪艳, 陈三妹, 陈小萍, 等.新生期卡介苗和乙肝疫苗联合接种对哮喘小鼠IFN-γ、IL-4和IL-17A表达的影响[J].中国病理生理杂志, 2018, 34(3):515. doi: 10.3969/j.issn.1000-4718.2018.03.022 [30] 闻玉梅.治疗性疫苗的研究进展[J].中华微生物学和免疫学杂志, 1996, 16(3):155. [31] NASCIMENTO IP, DIAS WO, QUINTILIO W, et al.Neonatal immunization with a single dose of recombinant BCG expressing subunit S1 from pertussis toxin induces complete protection against Bordetella pertussis intracerebral challenge[J].Microbes Infect, 2008, 10(2):198. doi: 10.1016/j.micinf.2007.10.010 [32] 王秋悦.柔嫩艾美耳球虫rhomboid基因重组卡介苗的构建及其免疫保护性研究[D].长春: 吉林大学, 2009. -





 下载:
下载: