-
缺血再灌注损伤(ischemia and reperfusion injury, IRI)是指在缺血的基础上恢复血流后,组织器官的损伤反而加重的病理生理现象[1]。肝脏缺血再灌注损伤(liver ischemia and reperfusion injury, LIRI)以肝细胞缺血坏死为特征,临床上主要见于肝部分切除术、肝移植、创伤和低血容量性休克等[2]。但目前临床上针对LIRI的防治仅是支持疗法,因此,寻找防治LIRI的有效手段具有重要临床意义。
白细胞介素(IL)-33最近被鉴定为孤儿受体ST2(IL-1RLI)的配体,除了表达在淋巴器官的高内皮静脉细胞核外,还组成性地表达于正常人的血管内皮细胞、消化系统的上皮细胞以及淋巴组织纤维细胞[2]。IL-33在疾病中扮演双重角色:它通过增强Th2型反应保护机体免受寄生虫感染和动脉粥样硬化,同时也能加重由Th2细胞和肥大细胞介导的炎症性疾病[3]。但IL-33在肝脏缺血再灌注(I/R)中的作用未见报道。本研究将探讨IL-33在小鼠LIRI中的作用及可能机制。现作报道。
-
75只雄性SPF级C57BL/6小鼠, 8~10周龄,体质量20~25 g。均购自北京华阜康生物科技有限公司, 按照清洁级动物标准饲养和管理。兔抗小鼠IL-33多克隆抗体购自美国Santa Cruz公司;重组小鼠IL-33蛋白购自北京方程佰金科技有限公司;ALT/AST检测试剂盒购自Sigma公司;髓过氧化物酶(MPO)检测试剂盒购自南京建成生物工程研究所。IL-17A ELISA试剂盒购自Ebioscience公司。本实验使用的其他试剂均为分析纯。
-
小鼠购进后在SPF级动物房饲养1周,实验前12 h禁食不禁水。将小鼠随机分为3组:假手术组(Sham组)、磷酸盐缓冲液I/R组(PBS+I/R组)及重组IL-33蛋白组(rIL-33+I/R组),每组各15只。以戊巴比妥钠(30 mg/kg)腹腔注射麻醉小鼠,乙醇消毒腹部皮肤,沿腹部正中线切口入腹,在手术显微镜下从周围组织中分离出支配肝脏左、中、尾叶的肝动脉和门静脉及胆管,应用无损伤微血管夹阻断以上血管,造成70%肝脏缺血,缺血部分肝组织颜色由红润转为苍白,提示阻断成功。随后关闭腹腔。缺血60 min后再重新打开腹腔,移走无损伤微血管夹以解除阻断,恢复肝脏血流供应,肝脏颜色在1 min内由苍白变为红润提示再灌注成功。用3/0手术丝线缝合关闭腹腔。Sham组小鼠除了不夹闭无损伤微血管夹外其余处理同I/R组。每组分别于再灌注后6 h、12 h及24 h各时间点处死小鼠,处死前经眼球取血,用预冷的0.9%氯化钠注射液冲洗肝脏,直至变白,切取I/R肝脏组织,分别行生化及形态学检查。
-
将30只小鼠随机分为6组(Sham组,再灌注后1 h、3 h、6 h、12 h及24 h组)。组织中IL-33表达采用免疫组化SP法检测,操作步骤按试剂盒说明书进行,肝组织石蜡切片经脱蜡、水化、3%甲醇、H2O2避光孵育、高压抗原修复后,加入兔抗小鼠IL-33抗体(1: 400稀释),孵育并洗涤后滴加二抗,光镜下观察控制DAB显色时间,苏木精复染细胞核,梯度乙醇脱水干燥,中性树胶封固。用PBS代替一抗作阴性对照。参考陈杰等[5]研究方法,血清中IL-33表达采用ELISA检测法,根据试剂盒说明书进行。
-
参考FREITAS等[6-7]预处理方法,PBS+ I/R组于缺血前60 min腹腔注射1 mL PBS溶液;rIL-33+I/R组小鼠于缺血前60 min腹腔注射1 mL的重组rIL-33蛋白溶液(5 μg/mL);Sham组不夹闭无损伤微血管夹,余处理同I/R组。
-
将小鼠血液标本以3 000 r/min离心10 min,留取上层血清,根据试剂盒说明检测ALT和AST含量。
-
参考DUAN等[8]研究方法,按不同组在不同时间点处死小鼠取血,室温放置30 min后,4 ℃下2 000 r/min离心分离血清。血清中IL-17A浓度根据试剂盒说明书进行检测。
-
将小鼠肝脏组织标本经4%多聚甲醛固定,常规石蜡包埋,切片,二甲苯中常规脱蜡至水,苏木精染色10 min,流水冲洗后伊红染色2 min,乙醇脱水,二甲苯透明,中性树胶封固。光镜下观察各组肝脏组织变化。
-
取I/R后肝脏组织匀浆, 严格按MPO活性测定试剂盒说明书步骤要求, 460 nm波长测量各管吸光度值。根据说明书提供公式, 计算MPO活性数值。
-
采用方差分析和q检验。
-
本研究检测了小鼠缺血60 min,再灌注24 h血清中及肝脏组织表达IL-33的情况。小鼠缺血60 min,再灌注3 h后血清中IL-33开始明显升高(P < 0.05),12 h达高峰,24 h后逐渐下降(见图 1)。免疫组化结果显示,IL-33在小鼠缺血60 min,再灌注3 h后表达升高,一直持续至24 h(IL-33阳性细胞显示为棕色)(见图 2)。
-
小鼠缺血60 min再灌注12 h,PBS+I/R组血清ALT及AST含量明显高于Sham组(P < 0.01)。在缺血60 min,再灌注12 h,rIL-33+I/R组血清中ALT及AST水平明显低于PBS+I/R组(P < 0.01) (见表 1)。
分组 ALT AST Sham组 50.2±18.1 57.2±18.9 PBS+I/R组 4 842.0±624.1** 5 434.8±1 180.7** rIL-33+I/R组 2 789.6±280.8**## 3 542.6±761.2**# F 554.93 169.65 P < 0.01 < 0.01 MS组内 42 156 225.687 42 657 945.047 q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 表 1 小鼠I/R 12 h后各组血清ALT及AST变化(ni=15;U/L)
-
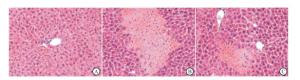
HE染色显示Sham组肝组织肝细胞形态正常,肝小叶结构正常(见图 3)。与Sham组相比,PBS+I/R组在缺血60 min再灌注12 h后,肝脏组织结构明显紊乱,肝脏有大面积缺血坏死,肝细胞明显肿胀,变性,坏死区有炎性细胞浸润;rIL-33+I/R组小鼠肝脏损伤较PBS+I/R组明显减轻。
-
结果显示:与Sham组相比,PBS+I/R组在缺血60 min,再灌注12 h后肝脏组织MPO含量明显升高(P < 0.01);rIL-33+I/R组较PBS+I/R组在缺血60 min,再灌注12 h后肝脏组织MPO含量明显降低(P < 0.01)(见表 2)。上述结果提示,rIL-33+I/R组较PBS+I/R组在小鼠肝脏缺血60 min,再灌注12 h后中性粒细胞浸润明显减少。
分组 MPO F P MS组内 Sham组 9.77±2.13 PBS+I/R组 23.18±4.31** 31.03 < 0.01 21.744 rIL-33+I/R组 16.76±6.49**## q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 表 2 小鼠I/R 12 h各组肝脏组织MPO含量(ni=15;U/g)
-
结果显示,小鼠肝脏缺血60 min, 再灌注12 h PBS+I/R组血清中IL-17A含量较Sham组明显升高(P < 0.01), rIL-33+I/R组较PBS+I/R组在小鼠肝脏缺血60 min,再灌注12 h后血清中IL-17A含量明显减少(P < 0.01)(见表 3)。
分组 IL-17A F P MS 组内 Sham组 6.68±3.61 PBS+I/R组 65.44±20.7** 63.08 < 0.01 211.949 rIL-33+I/R组 26.87±13.94**## q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 表 3 小鼠肝脏I/R 12 h血清中IL-17A表达(ni=15;pg/mL)
-
IL-33的mRNA表达于人和鼠的多种器官和细胞。在蛋白水平,IL-33主要表达在成纤维细胞、上皮细胞和内皮细胞[9-10],特别是高内皮小静脉[11]。本研究结果提示在小鼠肝脏I/R模型中,肝细胞也可以表达IL-33,再灌注后12 h达高峰,24 h逐渐降低,提示IL-33参与了小鼠LIRI。我们的预备实验结果提示,提前60 min腹腔注射rIL-33,IRI开始后血清中IL-33浓度最高,因此我们采用提前60 min预处理IL-33,这种预处理方法与FREITAS等[6-7]研究一致。
IL-33可通过其受体ST2保护小鼠心脏IRI,其保护机制可能与IL-33抑制心肌细胞凋亡有关。有学者进一步研究[12]发现,降低IL-33的表达能加重糖尿病小鼠心脏IRI,其机制可能与IL-33抑制PKCbII激活有关。最近研究[13]发现,IL-33能保护小鼠脑IRI,其机制可能与促进Th2反应,抑制Th17细胞反应有关。但也有研究[14]发现,IL-33能加重顺铂引起的急性肾损伤,其机制可能与IL-33促进CD4+细胞介导的趋化因子CXCL-1的表达有关,可见IL-33具有两面性,它在有些疾病中起保护作用,但在另外一些疾病中起促进作用。但有关IL-33在肝脏I/R中的作用鲜有报道。
我们的研究结果提示,IL-33能抑制中性粒细胞的浸润而保护LIRI。但IL-33如何抑制中性粒细胞浸润呢?有大量文献报道,IL-17A可促进中性粒细胞的募集而参与炎症的发生、发展。有研究[15]证明,IL-17A基因敲除小鼠能明显抑制中性粒细胞浸润而保护LIRI,提示IL-17A在LIRI过程中趋化中性粒细胞的浸润起关键作用。IL-17A可通过作用于巨噬细胞、内皮细胞、上皮细胞及成纤维细胞,分泌多种趋化因子促进中性粒细胞的浸润[16]。也有研究[17]结果显示,HMGB1可以通过抑制Th17细胞分泌IL-17A,从而抑制中性粒细胞的浸润,而延长心脏移植物的存活,提示IL-17A在中性粒细胞浸润过程中起关键作用。在LIRI过程中,中性粒细胞浸润到肝脏引起肝脏损伤依赖于CD4+T细胞,结果同时显示应用抗体清除CD4+T细胞能抑制中性粒细胞浸润而保护LIRI。CD4基因敲除小鼠能减少中性粒细胞浸润保护LIRI,而且应用抗IL-17抗体中和IL-17后,能通过抑制CXCL2的表达而抑制中性粒细胞浸润,进一步提示CD4+T细胞分泌的IL-17A在LIRI过程中中性粒细胞浸润起到关键作用。
有学者研究[13]发现,在小鼠脑IRI过程中,IL-33能通过促进Th2型反应而抑制Th17细胞的反应。但在肝脏I/R过程中IL-33对IL-17A引起中性粒细胞浸润的机制未见报道。我们的研究发现,在小鼠I/R过程中,IL-33能够减少中性粒细胞浸润,从而保护小鼠IRI。我们进一步探讨了加用rIL-33IL-17A水平的变化,提示IL-33能抑制IL-17A的表达,与上述研究[13]结果一致。因此,我们推测IL-33通过抑制IL-17A的表达,从而减少中性粒细胞的浸润而保护小鼠IRI。
DUAN等[8]研究结果提示IL-33在三硝基苯磺酸诱导的小鼠实验性结肠炎中表达升高,而且应用rIL-33预处理能保护小鼠实验性结肠炎。与DUAN等[8]研究结果一致,我们研究发现IL-33在小鼠肝脏I/R 3 h后开始升高,12 h达高峰,研究结果提示IL-33在此过程中发挥保护效应,因此,我们推测IL-33在小鼠I/R过程中表达升高是反馈性的升高,是机体自我调节IRI的机制之一,我们预先给予IL-33可以更好的保护小鼠IRI。我们的研究也进一步证实了上述推测。
本研究的不足之处在于未用ST2抗体阻断IL-33/ST2信号通路进行研究,因此,本研究结果不能排除IL-33除了ST2受体之外,还可能有其他信号通路参与保护LIRI。同时,本研究也未设置IL-33抗体组进行对比研究,探讨是否加入IL-33抗体后会加重LIRI。以上是本研究的两个不足之处,本课题在以后的研究中将进一步完善。
综上所述,IL-33能保护小鼠LIRI,其可能机制与IL-33抑制IL-17A表达、从而抑制中性粒细胞浸润有关。
IL-33预处理对小鼠肝脏缺血再灌注损伤的保护作用
Protective effect of IL-33 preconditioning on hepatic ischemia reperfusion injury in mice
-
摘要:
目的探讨白细胞介素(IL)-33预处理在小鼠肝脏缺血再灌注中的作用及可能机制。 方法将45只雄性C57BL/6小鼠随机分为3组,每组15只:对照组即肝脏缺血再灌注组(PBS+I/R组),静脉注射等量磷酸盐缓冲液,1 h后分离支配肝脏左、中、尾叶的肝动脉和门静脉及胆管, 应用无损伤微血管夹阻断以上血管60 min;实验组即重组白细胞介素(IL-33)预处理组(rIL-33+I/R组),静脉注射重组IL-33蛋白(每只5 μg),1 h后分离上述血管并夹闭60 min;假手术组(Sham组)小鼠除了不夹闭无损伤微血管夹外其余处理同对照组;每组小鼠再均分为3个亚组,每组5只,分别于再灌注6 h、12 h及24 h检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)及IL-17A水平;另将30只同型小鼠随机分为6组,分别测定不同时段缺血肝脏组织IL-33及髓过氧化物酶(MPO)表达。 结果在小鼠肝脏缺血再灌注过程中,IL-33的表达明显升高。再灌注后12 h,PBS+I/R组小鼠血清ALT、AST含量较Sham组明显升高(P < 0.01),rIL-33+I/R组血清ALT、AST含量较PBS+I/R组明显降低(P < 0.01);HE染色提示rIL-33+I/R组肝细胞损伤、中性粒细胞浸润、肝脏组织MPO含量明显低于PBS+I/R组(P < 0.01);ELISA检测血清IL-17A含量提示rIL-33+I/R组明显低于PBS+I/R组(P < 0.01)。 结论IL-33在小鼠肝脏缺血再灌注过程中起到保护作用,其机制可能与其抑制IL-17A的表达,减少中性粒细胞浸润有关。 Abstract:Objective To explore the effects of interleukin(IL)-33 preconditioning on hepatic ischemia reperfusion in mice, and its possible mechanism. MethodsForty-five male C57BL/6 mice were randomly divided into the sham operation group(Sham group), ischemia and reperfusion injury group(PBS+I/R group, control group) and IL-33+ischemia and reperfusion injury group(rIL-33+I/R group)(15 mice each group).The hepatic artery and portal vein and bile duct of left, middle and caudate lobe of liver in control group were separated, and blocked using no injury microvascular clip for 60 min after 1 h of intravenous injection of the same amount of phosphate buffer.The hepatic artery and portal vein and bile duct of left, middle and caudate lobe of liver in experimental group(rIL-33+I/R group) were separated, and blocked using no injury microvascular clip for 60 min after 1 h of intravenous injection of recombinant IL-33 protein.The treatment of the sham operation group(Sham group) was the same as the control group except for no using no injury microvascular clip.Each group was divided into three subgroups(5 mice each subgroup), the serum levels of ALT, AST and IL-17, and expression levels of IL-33 and myeloperoxidase(MPO) in ischemic liver tissue were detected after 6 h, 12 h and 24 h of reperfusion. Results The expression of IL-33 in muse liver significantly increased during liver ischemia and reperfusion.After 12 h of reperfusion, the serum levels of ALT and AST in PBS+I/R group significantly increased compared with the Sham group(P < 0.01), and the serum levels of ALT and AST in rIL-33+I/R group significantly decreased compared with the PBS+I/R group(P < 0.01).The Results of HE staining in rIL-33+I/R group showed that the hepatocyte damaged, the neutrophil infiltration was found, and the MPO content in liver tissue was significantly lower than that in PBS+I/R group(P < 0.01).The Results of ELISA showed that the serum levels of IL-17A in rIL-33+I/R group was significantly lower than that in PBS+I/R group(P < 0.01). Conclusions IL-33 can protect the hepatic ischemia reperfusion injury in mouse, the mechanism of which may be related to the inhibition of IL-17A expression and reduction of neutrophil infiltration. -
Key words:
- ischemia and reperfusion injury /
- interleukin /
- neutrophil
-
表 1 小鼠I/R 12 h后各组血清ALT及AST变化(ni=15;U/L)
分组 ALT AST Sham组 50.2±18.1 57.2±18.9 PBS+I/R组 4 842.0±624.1** 5 434.8±1 180.7** rIL-33+I/R组 2 789.6±280.8**## 3 542.6±761.2**# F 554.93 169.65 P < 0.01 < 0.01 MS组内 42 156 225.687 42 657 945.047 q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 表 2 小鼠I/R 12 h各组肝脏组织MPO含量(ni=15;U/g)
分组 MPO F P MS组内 Sham组 9.77±2.13 PBS+I/R组 23.18±4.31** 31.03 < 0.01 21.744 rIL-33+I/R组 16.76±6.49**## q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 表 3 小鼠肝脏I/R 12 h血清中IL-17A表达(ni=15;pg/mL)
分组 IL-17A F P MS 组内 Sham组 6.68±3.61 PBS+I/R组 65.44±20.7** 63.08 < 0.01 211.949 rIL-33+I/R组 26.87±13.94**## q检验:与Sham组比较**P < 0.01;与PBS+I/R组比较##P < 0.01 -
[1] ELTZSCHIG HK.ECKLE T.Ischemia and reperfusion——from mechanism to translation[J].Nat Med, 2011, 17(11):1391. doi: 10.1038/nm.2507 [2] HODZIC Z, SCHILL E M, BOLOCK AM, et al.IL-33 and the intestine:The good, the bad, and the inflammatory[J].Cytokine, 2017, 100:1. doi: 10.1016/j.cyto.2017.06.017 [3] DRAKE LY, KITA H.IL-33:biological properties, functions, and roles in airway disease[J].Immunol Rev, 2017, 278(1):173. [4] ZHU P, DUAN L, CHEN J, et al.Gene silencing of NALP3 protects against liver ischemia-reperfusion injury in mice[J].Hum Gene Ther, 2011, 22(7):853. doi: 10.1089/hum.2010.145 [5] CHEN J, DUAN L, XIONG A, et al.Blockade of IL-33 ameliorates Con A-induced hepatic injury by reducing NKT cell activation and IFN-gamma production in mice[J].J Mol Med (Berl), 2012, 90(12):1505. doi: 10.1007/s00109-012-0938-4 [6] FREITAS MC, UCHIDA Y, ZHAO D, et al.Blockade of Janus kinase-2 signaling ameliorates mouse liver damage due to ischemia and reperfusion[J].Liver Transpl, 2010, 16(9):600. [7] MASUDA T, IWASHITA Y, HAGIWARA S, et al.Dihydrolipoyl histidinate zinc complex, a new antioxidant, attenuates hepatic ischemia-reperfusion injury in rats[J].J Gastroenterol Hepatol, 2011, 26(11):1652. doi: 10.1111/jgh.2011.26.issue-11 [8] DUAN L, CHEN J, ZHANG H, et al.Interleukin-33 ameliorates experimental colitis through promoting Th2/Foxp3(+) regulatory T-cell responses in mice[J].Mol Med, 2012, 18(18):753. [9] CAYROL C, GIRARD JP.The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1[J].Proc Natl Acad Sci U S A, 2009, 106(22):9021. doi: 10.1073/pnas.0812690106 [10] TALABOT-AYER D, LAMACCHIA C, GABAY C, et al.Interleukin-33 is biologically active independently of caspase-1 cleavage[J].J Biol Chem, 2009, 284(29):19420. doi: 10.1074/jbc.M901744200 [11] LUTHI AU, CULLEN SP, MCNEELA EA, et al.Suppression of interleukin-33 bioactivity through proteolysis by apoptotic caspases[J].Immunity, 2009, 31(1):84. doi: 10.1016/j.immuni.2009.05.007 [12] SEKI K, SANADA S, KUDINOVA AY, et al.Interleukin-33 prevents apoptosis and improves survival after experimental myocardial infarction through ST2 signaling[J].Circ Heart Fail, 2009, 2(6):684. doi: 10.1161/CIRCHEARTFAILURE.109.873240 [13] SAKAI N, VAN SWERINGEN HL, QUILLIN RC, et al.Interleukin-33 is hepatoprotective during liver ischemia/reperfusion in mice[J].Hepatology, 2012, 56(4):1468. doi: 10.1002/hep.v56.4 [14] LUO Y, ZHOU YQ, XIAO W, et al.Interleukin-33 ameliorates ischemic brain injury in experimental stroke through promoting Th2 response and suppressing Th17 response[J].Brain Res, 2015, 9(1597):86. [15] KONO H, FUJⅡ H, OGIKU M, et al.Role of IL-17A in neutrophil recruitment and hepatic injury after warm ischemia-reperfusion mice[J].J Immunol, 2011, 187(9):4818. doi: 10.4049/jimmunol.1100490 [16] AKCAY A, NGUYEN Q, HE Z, et al.IL-33 exacerbates acute kidney injury[J].J Am Soc Nephrol, 2011, 22(11):2057. doi: 10.1681/ASN.2010091011 [17] DUAN L, WANG CY, CHEN J, et al.High-mobility group box 1 promotes early acute allograft rejection by enhancing IL-6-dependent Th17 alloreactive response[J].Lab Invest, 2011, 91(1):43. -





 下载:
下载: