-
胃癌是一种高发的消化系统恶性肿瘤,其死亡率和发病率在恶性肿瘤中均位居前列,由胃癌导致的死亡在恶性肿瘤病死原因中位居第二位,研究胃癌的发病机制,延长胃癌病人的生存期,减少死亡人数及复发是目前亟需解决的关键问题[1-2]。肿瘤细胞以有氧糖酵解为主要供能方式,丙酮酸激酶、己糖激酶等是糖酵解过程中的关键限速酶,乳酸是糖酵解的主要产物之一,肿瘤细胞糖酵解水平与己糖激酶、丙酮酸激酶等的水平有关,肿瘤细胞增殖、凋亡等过程离不开三磷酸腺苷(ATP)的参与[3-4]。Yes相关蛋白(Yes-associated protein, YAP)参与调控肿瘤的发生,其在肺癌、肝癌等多种癌症中高度表达,可以调控肺癌等癌细胞的生长[5-6]。研究[7]显示,YAP在胃癌中表达上调与胃癌的预后等有关,而对于其是否可以调控肿瘤细胞的生长、凋亡和能量代谢尚不明确。本实验以胃癌细胞为研究对象,通过体外细胞转染YAP小干扰RNA下调细胞中YAP的表达,探讨YAP在胃癌细胞增殖、克隆形成及能量代谢中的作用,为研究胃癌的发病机制奠定基础。
-
胃癌细胞BGC823购自中国科学院上海细胞研究所;己糖激酶2(hexokinase 2,HK2)单克隆抗体、丙酮酸激酶M2亚型(pyruvate kinase M2 isoform, PKM2)单克隆抗体为美国LSBio产品;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)单克隆抗体为美国CTS公司产品;YAP小干扰RNA(YAP siRNA)和小干扰RNA阴性对照(siRNA-control)为美国SantaCruzBiotech产品;兔抗人YAP单克隆抗体为苏州Abgent产品;Lipofectamine2000为美国invitrogen产品;YAP、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物由南京金斯瑞合成;ATP含量测定试剂盒为北京Solarbio产品;乳酸含量测定试剂盒为美国Sigma产品。
-
BGC823细胞种植到6孔板中,在37 ℃、5% CO2培养箱中培养,观察细胞密度为50%时进行细胞转染。按照每孔中加入5 μL的Lipofectamine2000,用250 μL的Opti-MEM稀释以后,在室温条件下孵育5 min。同样按照每孔中加入5 μL的siRNA,用250 μL的Opti-MEM稀释。将上述两种稀释物混合后,在室温条件下孵育20 min。加入到细胞中,孵育6 h,更换细胞培养液继续培养48 h。将转染YAP siRNA和siRNA-control的细胞记为YAP siRNA、siRNA-NC,同时把不做处理的细胞作为Con。胃癌细胞培养用含有10%胎牛血清的RPMI1640培养液培养。
-
Con、siRNA-NC、YAP siRNA细胞培养48 h以后,加入1 mL的Trizol裂解液,冰上孵育5 min。在裂解液中加入200 μL的三氯甲烷溶液,剧烈振荡15 s以后,放在室温条件下孵育10 min。4 ℃、12 000 g离心10 min。将溶液的上层吸取到EP管中,加入500 μL的冰预冷的异丙醇溶液,放在冰上静置10 min。4 ℃、12 000 g离心10 min。将上清液吸除,在RNA沉淀中加入75%的乙醇洗涤2次,4 ℃、8 000 g离心10 min,吸除上清液后,室温下晾干。DEPC水20 μL溶解后,测定吸光度值,检测其浓度和纯度。逆转录反应:42 ℃ 60 min,70 ℃ 50 min。qRT-PCR反应:94 ℃,45 s;60 ℃,60 s;72 ℃,80 s,40个循环。YAP上游引物为5′-TGG GAC TCA AAA TCC TCC AGT GTC-3′,下游引物5′-CCA TCT CCT TCC AGT GTT CC-3′。GAPDH上游引物为5′-AGG TGA AGG TCG GAG TCA AC-3′,下游引物5′-CGC TCC TGG AAG ATG GTG AT-3′。内参基因为GAPDH,2-△△Ct法计算YAP水平。
-
Con、siRNA-NC、YAP siRNA细胞培养48 h以后,移液器吸除培养液后,磷酸缓冲盐溶液洗涤细胞2次。加入细胞裂解液,置于冰上,30 min后,收集细胞裂解液,4 ℃、12 000 g离心10 min,吸取培养液上清液,Bradford法对蛋白定量。蛋白样品加入等体积的上样缓冲液,100 ℃煮沸后,置于室温下冷却。采用10%的聚丙烯酰胺凝胶进行电泳,90 V电压,电泳约2 h以后,观察溴酚蓝进入到底部后,停止电泳。转膜:400 mA电流,4 ℃转膜2 h,把凝胶上的蛋白转印到PVDF膜上。封闭:5%脱脂奶粉,室温,摇床封闭60 min。一抗结合:与1:1 000稀释的YAP抗体在4 ℃结合过夜。二抗结合:1:3 000稀释的二抗在室温结合60 min。ECL显色,X光胶片定影,以GAPDH为内参,分析蛋白水平。
-
Con、siRNA-NC、YAP siRNA细胞接种到96孔细胞培养板中,接种密度为1×105个/mL,每孔中加入100 μL的细胞悬浮液,每组设置5个复孔。放在37 ℃、5% CO2培养箱中培养48 h以后,在每孔迅速加入浓度为5 mg/mL的MTT溶液各10 μL,继续在CO2培养箱中孵育4 h。取出培养板,用移液枪把孔中的上清液吸除,再加入100 μL的二甲基亚砜溶液,摇床反应10 min。观察结晶物溶解以后,酶标仪检测570 nm处的吸光度值。
-
Con、siRNA-NC、YAP siRNA细胞接种到6孔培养板中,调整浓度,使每孔中加入200个细胞,放在37 ℃、5% CO2培养箱中培养,每隔3 d换液1次,培养12 d以后,把孔中的培养液吸除,用多聚甲醛固定细胞,吉姆萨染色20 min。计数≥50个细胞的克隆数目,计算克隆形成率。克隆形成率=细胞克隆数目/细胞总数×100%。
-
Con、siRNA-NC、YAP siRNA细胞培养48 h以后,吸取培养液上清液,乳酸含量检测试剂盒检测乳酸水平。同时收集细胞,用ATP含量检测细胞中的ATP水平。步骤均参照试剂盒。ATP含量和乳酸含量分别以Con为对照,分析ATP相对含量和乳酸相对含量。
-
Con、siRNA-NC、YAP siRNA细胞以每孔加入400 μL的细胞悬浮液接种到48孔细胞培养板中,接种密度为5×106个/mL,每组设置4个复孔。在37℃、5% CO2培养箱中孵育48 h以后,把原来的培养液吸除,加入胰蛋白酶消化后,收集106个细胞,用PBS重悬细胞1次,4 ℃、12 000 g离心5 min以后,再用100 μL的结合缓冲液悬浮细胞,再加入2 μL的20 μg/mL的膜联蛋白V-FITC(Annexin V-FITC),混合以后,放置于冰上孵育15 min。转移到流式管中,加入PBS 400 μL,每个样品在上机前加入50 μg/mL的碘化丙啶各1 μL,迅速用流式细胞仪检测细胞凋亡。
-
Con、siRNA-NC、YAP siRNA细胞培养48 h后,Western blotting法检测细胞中HK2、PKM2、Cleaved Caspase-3蛋白水平,步骤同1.4。
-
采用方差分析和q检验。
-
siRNA-NC细胞中YAP mRNA和蛋白水平与Con差异无统计学意义(P>0.05)。YAP siRNA细胞中YAP mRNA和蛋白水平明显低于Con(P < 0.05)(见表 1)。
分组 YAP mRNA YAP蛋白 Con 1.00±0.00 1.14±0.12 siRNA-NC 1.02±0.13 1.13±0.10 YAP siRNA 0.35±0.04*# 0.42±0.06*# F 70.69 54.78 P < 0.01 < 0.01 MS组内 0.007 0.009 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 1 各组细胞中YAP mRNA和蛋白水平(x±s;ni=3)
-
siRNA-NC细胞吸光度值和克隆形成率与Con差异无统计学意义(P>0.05)。YAP siRNA细胞吸光度值和克隆形成率明显低于Con(P < 0.05)。下调YAP抑制胃癌细胞增殖活性,降低细胞克隆形成能力(见表 2)。
分组 吸光度值 克隆形成率/% Con 0.74±0.08 35.28±3.47 siRNA-NC 0.73±0.06 36.17±3.64 YAP siRNA 0.45±0.03*# 22.76±2.12*# F 22.38 16.99 P < 0.01 < 0.01 MS组内 0.004 9.928 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 2 细胞吸光度值和克隆形成率(x±s;ni=3)
-
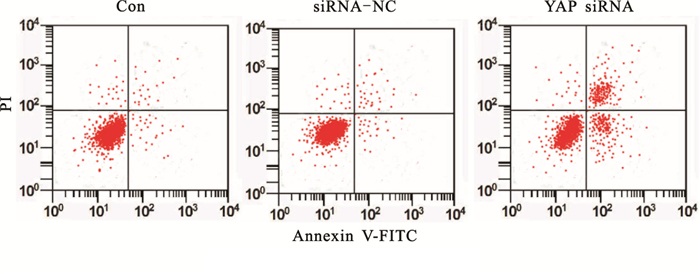
siRNA-NC细胞凋亡率与Con差异无统计学意义(P>0.05)。YAP siRNA细胞凋亡率明显高于Con(P < 0.05)。下调YAP诱导胃癌细胞凋亡(见图 1、表 3)。
分组 细胞凋亡率/% F P MS组内 Con 9.96±0.82 siRNA-NC 10.34±1.07 126.72 < 0.01 6.237 YAP siRNA 38.26±4.11*# q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 3 各组细胞凋亡率比较(x±s;ni=3)
-
siRNA-NC细胞ATP水平、上清液中乳酸含量与Con差异均无统计学意义(P>0.05)。YAP siRNA细胞ATP水平、上清液中乳酸含量明显低于Con(P < 0.05)。下调YAP抑制胃癌细胞糖酵解(见表 4)。
分组 ATP相对含量 乳酸相对含量 Con 1.00±0.00 1.00±0.00 siRNA-NC 0.98±0.08 1.01±0.09 YAP siRNA 0.65±0.04*# 0.55±0.07*# F 43.46 47.79 P < 0.01 < 0.01 MS组内 0.008 0.008 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 Con, Cleaved Caspase-3水平明显高于Con(P < 0.05) 表 4 各组细胞ATP相对含量和培养液上清液中乳酸相对含量(x±s;ni=3)
-
siRNA-NC细胞HK2、PKM2、Cleaved Caspase-3水平与Con差异均无统计学意义(P>0.05)。YAP siRNA细胞HK2、PKM2水平明显低于。下调YAP抑制胃癌细胞HK2、PKM2表达,促进Cleaved Caspase-3表达(见表 5)。
分组 HK2 PKM2 Cleaved Caspase-3 Con 0.99±0.08 1.04±0.11 0.47±0.06 siRNA-NC 1.02±0.06 1.03±0.12 0.45±0.07 YAP siRNA 0.48±0.04*# 0.51±0.06*# 0.98±0.09*# F 71.46 27.48 48.92 P < 0.01 < 0.01 < 0.01 MS组内 0.007 0.009 0.006 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 5 HK2、PKM2、Cleaved Caspase-3蛋白水平(x±s;ni=3)
-
Hippo蛋白在生物体的器官发育和组织生长中具有重要作用,YAP是Hippo通路的中心蛋白,具有促进细胞生长的作用,人类YAP基因定位于11q22染色体上,是一种原癌基因,在肿瘤中表达上调,在YAP上游的一系列基因可以在特定的信号因子作用下被激活,促进泛素化降解或者是蛋白转移,从而抑制YAP的功能[8-9]。YAP在正常细胞生长过程中也具有调控作用,正常细胞中存在接触抑制的现象,这种现象可以阻止细胞生长速度过快,而肿瘤细胞是一种接触抑制失调的细胞,而Hippo在细胞的生长过程中具有重要作用,因此推测YAP可能参与接触抑制作用,从而调控细胞生长[10-11]。张正良等[12]报道YAP在胃癌中表达上调,并且其表达水平与病人的肿瘤大小、转移程度、病理分期等有关。曹立宇等[13]研究显示,YAP在大肠癌组织中的阳性率高达73%,并且下调其表达后的大肠癌细胞生长被抑制,凋亡率高达23%。
肿瘤细胞的凋亡与Caspase-3的活化水平有关,Caspase-3通常以不具有活性的酶原形式存在,其作为Caspase凋亡级联反应的执行因子,活化水平升高后标志着细胞凋亡进入不可逆的阶段[14]。本实验中用小干扰RNA下调胃癌细胞中YAP的基因和蛋白表达,发现抑制YAP表达可以降低胃癌细胞增殖活性,抑制胃癌细胞克隆形成能力,促进细胞中Caspase-3活化,诱导胃癌细胞凋亡,YAP参与胃癌细胞的生长和凋亡,在胃癌中发挥癌基因的作用,与上述报道相符合。
能量代谢在细胞正常生物学特性发挥中具有重要作用,主要来源于葡萄糖转化过程,正常细胞可以通过葡萄糖的有氧氧化产生能量,肿瘤细胞则以糖酵解的方式摄取能量,虽然糖酵解产生的能量远远低于正常的有氧氧化,但糖酵解可以快速地为细胞的生长提供ATP,其代谢过程中产生的代谢物质可以被细胞利用[15-16]。己糖激酶可以把葡萄糖催化为6-磷酸葡萄糖,6-磷酸葡萄糖经过丙酮酸激酶等的催化,产生ATP,为肿瘤的生长提供条件[17]。YAP可以调控肿瘤细胞生长,肿瘤细胞的生长需要ATP的参与,YAP可能参与肿瘤细胞能量代谢过程[18]。本研究结果显示,下调YAP表达后的胃癌细胞中HK2、PKM2表达水平下调,细胞培养液中乳酸含量也明显下降,细胞中ATP水平下降,YAP下调抑制胃癌细胞糖酵解。
以上表明,YAP在胃癌细胞生长中发挥癌基因的作用,YAP表达下调后可以抑制胃癌细胞增殖活性和克隆能力,诱导Caspase-3介导的胃癌细胞凋亡,阻碍肿瘤细胞糖酵解。本研究为探讨YAP在胃癌细胞中的作用机制提供了参考,对于研究胃癌的发生机制具有重要意义。本研究存在一定的局限性,没有在多株细胞中进行验证,对于其作用机制尚不清楚,后续实验中会对上述部分进行验证及探讨。
下调Yes相关蛋白对胃癌细胞克隆形成能力和能量代谢的影响
Effect of the down-regulation of Yes-associated protein on the cloning ability and energy metabolism of gastric cancer cells
-
摘要:
目的研究下调Yes相关蛋白(Yes-associated protein,YAP)对胃癌细胞克隆形成能力及能量代谢的影响。 方法胃癌细胞BGC823转染YAP小干扰RNA(YAP siRNA)和小干扰RNA阴性对照(siRNA-NC),同时以不做转染的细胞为对照(Con),qRT-PCR测定细胞中YAP mRNA水平,Western blotting测定细胞中YAP蛋白水平,噻唑蓝(MTT)测定细胞增殖活性,平板克隆实验测定细胞克隆形成能力,试剂盒测定细胞中三磷酸腺苷(ATP)水平及培养液上清中乳酸含量,Western blotting测定能量代谢相关蛋白己糖激酶2(HK2)、丙酮酸激酶M2亚型(PKM2)和活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)的水平。 结果YAP siRNA细胞中YAP mRNA和蛋白水平均明显低于Con(P < 0.05),siRNA-NC细胞中YAP mRNA和蛋白水平与Con差异均无统计学意义(P>0.05)。YAP siRNA细胞增殖活性、克隆形成率明显低于Con(P < 0.05),细胞凋亡率明显高于Con(P < 0.05),细胞中ATP水平低于Con(P < 0.05),上清中乳酸含量低于Con(P < 0.05),细胞中HK2、PKM2蛋白水平也低于Con(P < 0.05),而Cleaved Caspase-3水平高于Con(P < 0.05)。 结论下调YAP可以降低胃癌细胞克隆形成能力和增殖活性,诱导Caspase-3介导的胃癌细胞凋亡,干扰糖酵解关键酶HK2、PKM2的表达,降低细胞ATP水平,抑制胃癌细胞糖酵解。 Abstract:ObjectiveTo investigate the effects of the down-regulation of Yes-associated protein (YAP) on the cloning ability and energy metabolism of gastric cancer cells. MethodsThe YAP small interfering RNA (YAP siRNA) and negative small interfering RNA (siRNA-NC) were transfected into the gastric cancer cell line BGC823, respectively, and the cells without transfection was set as the control (con).The levels of mRNA and protein level of YAP in cells were detected using the qRT-PCR and western blotting, respectively.The cell proliferation activity and cloning ability were determined using the MTT and plate cloning assay, respectively.The level of ATP in cells and content of lactic acid in supernatant of culture medium were determined by kit.The levels of related energy metabolism proteins HK2, PKM2 and apoptotic protein cleaved caspase-3 were determined using western blotting. ResultsThe levels of YAP mRNA and protein in YAP siRNA cells were significantly lower than those in Con cells (P < 0.05), and the differences of the levels of YAP mRNA and protein between siRNA-NC and Con cells were not statistically significant (P>0.05).The cell proliferation and colony formation rate in YAP siRNA cells were significantly lower than those in Con cells (P < 0.05), and the apoptosis rate in YAP siRNA cells was significantly higher than that in Con cells (P < 0.05).The level of ATP in cells, content of lactic acid in supernatant and levels of HK2 and PKM2 protein in YAP siRNA cells were lower than those in Con cells (P < 0.05), and the level of cleaved caspase-3 in YAP siRNA cells was higher than that in Con cells (P < 0.05). ConclusionsThe down regulation of YAP can reduce the abilities of clone formation and proliferation, induce the caspase-3 mediated apoptosis, interfer the expression of key enzymes HK2 and PKM2, decrease the level of ATP and inhibit the glycolysis in gastric cancer cells. -
Key words:
- gastric neoplasms /
- energy metabolism /
- Yes-associated protein /
- cell cloning
-
表 1 各组细胞中YAP mRNA和蛋白水平(x±s;ni=3)
分组 YAP mRNA YAP蛋白 Con 1.00±0.00 1.14±0.12 siRNA-NC 1.02±0.13 1.13±0.10 YAP siRNA 0.35±0.04*# 0.42±0.06*# F 70.69 54.78 P < 0.01 < 0.01 MS组内 0.007 0.009 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 2 细胞吸光度值和克隆形成率(x±s;ni=3)
分组 吸光度值 克隆形成率/% Con 0.74±0.08 35.28±3.47 siRNA-NC 0.73±0.06 36.17±3.64 YAP siRNA 0.45±0.03*# 22.76±2.12*# F 22.38 16.99 P < 0.01 < 0.01 MS组内 0.004 9.928 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 3 各组细胞凋亡率比较(x±s;ni=3)
分组 细胞凋亡率/% F P MS组内 Con 9.96±0.82 siRNA-NC 10.34±1.07 126.72 < 0.01 6.237 YAP siRNA 38.26±4.11*# q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 表 4 各组细胞ATP相对含量和培养液上清液中乳酸相对含量(x±s;ni=3)
分组 ATP相对含量 乳酸相对含量 Con 1.00±0.00 1.00±0.00 siRNA-NC 0.98±0.08 1.01±0.09 YAP siRNA 0.65±0.04*# 0.55±0.07*# F 43.46 47.79 P < 0.01 < 0.01 MS组内 0.008 0.008 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 Con, Cleaved Caspase-3水平明显高于Con(P < 0.05) 表 5 HK2、PKM2、Cleaved Caspase-3蛋白水平(x±s;ni=3)
分组 HK2 PKM2 Cleaved Caspase-3 Con 0.99±0.08 1.04±0.11 0.47±0.06 siRNA-NC 1.02±0.06 1.03±0.12 0.45±0.07 YAP siRNA 0.48±0.04*# 0.51±0.06*# 0.98±0.09*# F 71.46 27.48 48.92 P < 0.01 < 0.01 < 0.01 MS组内 0.007 0.009 0.006 q检验:与Con比较*P < 0.05;与siRNA-NC比较#P < 0.05 -
[1] 郭爱叶, 胡金龙, 郭思, 等.转染Chk1 siRNA的人胃癌SGC7901细胞对顺铂的敏感性[J].郑州大学学报(医学版), 2017, 52(6):722. [2] 贾萌萌, 周英发, 赵治国, 等.血清胃蛋白酶原和IL-23用于胃癌早期诊断的价值[J].郑州大学学报(医学版), 2017, 52(3):366. [3] CHEN Y, WANG Z, XU M, et al.Nanosilver incurs an adaptive shunt of energy metabolism mode to glycolysis in tumor and nontumor cells[J].ACS Nano, 2014, 8(6):5813. doi: 10.1021/nn500719m [4] SHIMURA T, NOMA N, SANO Y, et al.AKT-mediated enhanced aerobic glycolysis causes acquired radioresistance by human tumor cells[J].Radiother Oncol, 2014, 112(2):302. doi: 10.1016/j.radonc.2014.07.015 [5] ZHANG S, LIU Z, WU L, et al.MiR-361 targets Yes-associated protein (YAP) mRNA to suppress cell proliferation in lung cancer[J].Biochem Biophys Res Commun, 2017, 492(3):468. doi: 10.1016/j.bbrc.2017.08.072 [6] TSCHAHARGANEH DF, CHEN X, LATZKO P, et al.Yes-associated protein up-regulates Jagged-1 and activates the Notch pathway in human hepatocellular carcinoma[J].Gastroenterology, 2013, 144(7):1530. doi: 10.1053/j.gastro.2013.02.009 [7] XU Z, CHEN J, SHAO L, et al.Erratum to:promyelocytic leukemia protein enhances apoptosis of gastric cancer cells through Yes-associated protein[J].Tumor Biol, 2016, 37(2):2775. [8] WANG Y, DONG Q, ZHANG Q, et al.Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer[J].Cancer Sci, 2010, 101(5):1279. doi: 10.1111/cas.2010.101.issue-5 [9] CAMPBELL KN, WONG JS, GUPTA R, et al.Yes-associated protein (YAP) promotes cell survival by inhibiting proapoptotic dendrin signaling[J].J Biol Chem, 2013, 288(24):17057. doi: 10.1074/jbc.C113.457390 [10] 李映璇, 高绥之, 苏松, 等.Hippo-YAP信号通路活化参与二甲双胍抑制胰腺癌细胞生长的作用[J].中华胰腺病杂志, 2016, 16(2):82. doi: 10.3760/cma.j.issn.1674-1935.2016.02.003 [11] JIN J, HUA K, FANG M, et al.miR-506, downregulated in glioma, inhibits cell growth and disrupts the cell cycle by regulating YAP[J].Intern J Clin Exp Med, 2016, 9(4):7494. [12] 张正良, 车向明, 白郑海, 等.FOXA1和YAP在胃癌中的表达及临床意义[J].西安交通大学学报(医学版), 2015, 36(5):667. [13] 曹立宇.Hippo及Wnt信号通路在大肠癌发生中的作用及沉默YAP, Survivin基因对大肠癌细胞生物学行为的影响[D].合肥: 安徽医科大学, 2016. [14] 翟越, 赵海丰.黄芩素对SCC15口腔癌细胞增殖和Caspase-3活性的影响[J].中国老年学杂志, 2015, 35(1):139. doi: 10.3969/j.issn.1005-9202.2015.01.065 [15] 刘臻, 唐圣松.肿瘤细胞能量代谢及其调控机制的研究进展[J].微量元素与健康研究, 2015, 32(3):65. [16] PINHEIRO C, GARCIA EA, MORAIS-SANTOS F, et al.Reprogramming energy metabolism and inducing angiogenesis:co-expression of monocarboxylate transporters with VEGF family members in cervical adenocarcinomas[J].Bmc Cancer, 2015, 15(1):1. doi: 10.1186/1471-2407-15-1 [17] ZENG L, WANG YH, AI CX, et al.Effects of β-glucan on ROS production and energy metabolism in yellow croaker(Pseudosciaena crocea) under acute hypoxic stress[J].Fish Physiol Biochem, 2016, 42(5):1395. doi: 10.1007/s10695-016-0227-1 [18] 舒志平.HIPPO信号通路调控HEPG2细胞糖酵解与脂肪酸合成的作用和机制研究[D].武汉: 华中科技大学, 2015. -




 下载:
下载: