-
肝硬化的发生率显著地上升,流行病学研究证实,肝硬化的发病率可达(262~373)/10万人[1],在合并有慢性病毒感染的病人中,肝硬化的发生风险或者病情进展风险更高[2]。临床上对肝硬化的早期诊断对于疾病的早期临床干预具有重要的意义,其能够指导临床上肝硬化病人的早期抗纤维化治疗,从而改善病人的肝功能结局,降低肝功能衰竭的风险。白蛋白(ALB)是由肝脏上皮细胞分泌的蛋白成分,在肝脏上皮细胞病变的过程中,ALB的合成显著下降,同时由于腹水或者体内渗透压的改变等,均能够导致血清中蛋白漏出增多,导致了ALB的下降[3];胆碱酯酶(CHE)是肝脏上皮细胞分泌的重要水解酶,其能够通过对于胆碱成分的水解作用,进而参与到神经纤维的电冲动传递等生理过程中[4];凝血酶原活动度(PTA)是评估病人体内凝血功能的指标,在肝硬化病人中由于凝血因子的合成减少,凝血时间均有不同程度的延长,PTA可显著下降[5]。部分研究者报道了ALB等指标在肝硬化病人血清中的差异性表达情况,认为ALB等的表达下降与病人的病情密切相关,而缺乏对于相关指标的诊断学价值分析。为了指导临床上肝硬化病人的诊疗,本次研究收集了相关病毒性肝炎肝硬化病人,探讨ALB、CHE、PTA检测对病毒性肝炎肝硬化的诊断价值。现作报道。
-
选取2016年1月至2017年10月在我院治疗的病毒性肝炎肝硬化病人63例(肝硬化组),病毒性肝炎病人60例(肝炎组),纳入标准:(1)诊断符合《病毒性肝炎防治方案》中的标准;(2)病人及家属知情同意。排除标准:(1)酒精性肝硬化、血吸虫病肝纤维化、其他原因所致的肝硬化等;(2)合并有恶性肿瘤者。同时选取健康志愿者60名作为对照组,各组受试者一般资料比较差异均无统计学意义(P>0.05)(见表 1),具有可比性。
分组 n 男 女 年龄(x±s)/岁 对照组 60 40 20 51.46±8.49 肝炎组 60 38 22 50.21±9.01 肝硬化组 63 41 22 49.88±9.48 F — 0.15* 1.20 P — >0.05 >0.05 MS组内 — — 81.043 *示χ2值 表 1 各组受试者一般资料的比较
-
采集入院后静脉血,离心后收集上清液,采用免疫发光法检测ALB、CHE水平,检测仪器为美国Bio-Bad全自动酶标仪,配套试剂盒购自罗氏检测公司;采用全自动血凝分析仪检测PTA值,配套试剂盒购自南京碧云天生物检测公司。
-
采用χ2检验、方差分析、q检验和受试者工作特征(ROC)曲线。
-
3组ALB、CHE和PTA水平比较,肝硬化组均最低(P < 0.01), 肝炎组次之(P < 0.01),对照组最高(P < 0.01)(见表 2)。
分组 n ALB/(g/L) CHE/(U/L) PTA/% 对照组 60 45.52±5.46 8 645.00±1 420.22 88.46±18.46 肝炎组 60 34.20±6.10** 5 100.48±1 241.82** 60.21±20.15** 肝硬化组 63 23.22±7.25**△△ 2 708.16±1 344.50**△△ 42.54±15.16**△△ F — 190.69 305.55 101.41 P — < 0.01 < 0.01 < 0.01 MS组内 — 40.073 1 801 789 252.997 323.945 q检验:与对照组比较**P < 0.01;与肝炎组比较△△P < 0.01 表 2 3组ALB、CHE和PTA水平的比较(x±s)
-
ALB、CHE和PTA水平,肝硬化组Child-pugh C级病人最低(P < 0.05~ P < 0.01),B级病人次之(P < 0.05~P < 0.01),A级病人最高(P < 0.01)(见表 3)。
Child-pugh分级 n ALB/(g/L) CHE/(U/L) PTA/% A级 17 30.51±4.82 3 700.64±1 350.03 51.16±12.03 B级 22 25.16±5.11** 2 500.18±1 260.63** 40.81±11.56* C级 24 18.96±4.06**△△ 2 001.84±1 150.62**△ 32.21±16.22**△ F — 31.31 9.46 9.62 P — < 0.01 < 0.01 < 0.01 MS组内 — 21.653 610 549 742.513 186.215 q检验:与A级比较*P < 0.05,**P < 0.01;与B级比较△P < 0.05,△△P < 0.01 表 3 肝硬化组不同Child-pugh分级病人ALB、CHE和PTA水平的比较(x±s)
-
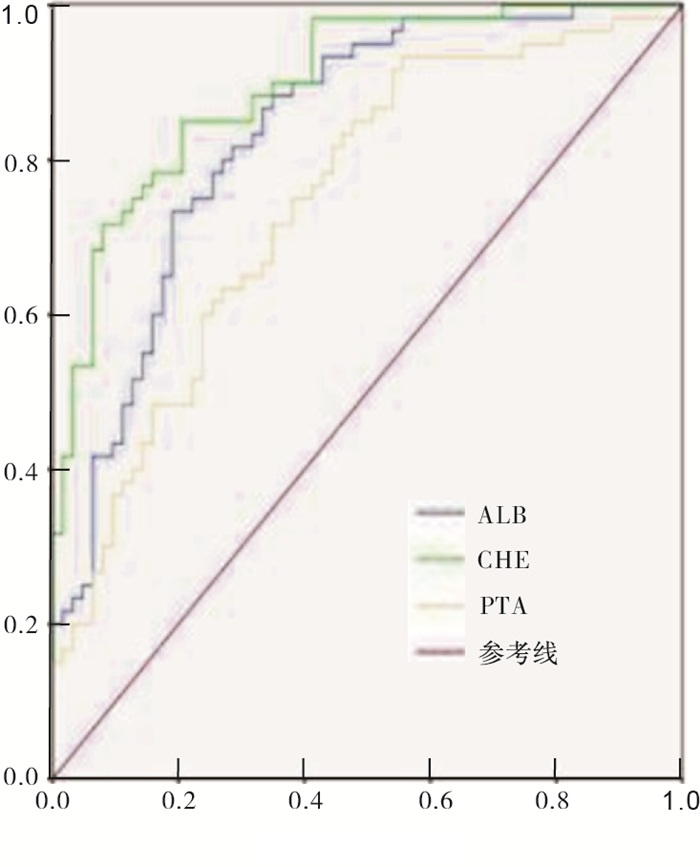
ALB、CHE和PTA诊断病毒性肝炎肝硬化的ROC曲线下面积分别为0.835、0.897和0.746,CHE指标在病毒性肝炎肝硬化中的诊断价值较好,其次为ALB指标(见表 4和图 1)。
指标 曲线下面积 Z P 截断值 灵敏度/% 特异度/% ALB 0.835 12.445 <0.05 31.41 g/L 73.30 81.00 CHE 0.897 10.860 <0.05 3 785.41 U/L 85.00 79.40 PTA 0.746 11.257 <0.05 36.59% 93.30 44.44 表 4 ALB、CHE和PTA诊断病毒性肝炎肝硬化的ROC曲线参数
-
病毒性肝硬化的发生主要与长期的病毒性感染导致上皮细胞的损伤和间质成分的再生有关,在上皮细胞损伤基础上,间质成分的纤维化等病理改变,能够增加肝脏小叶结构重塑的风险,导致假小叶结构的形成。特别是在合并有慢性基础性疾病的人群中,病毒性肝硬化病人的发生风险更高,终末期肝功能衰竭的风险也可显著上升[6]。现阶段临床上主要通过影像学检查评估肝硬化的发生风险,但单纯依靠影像学检查诊断的灵敏度较低,特别是对于早期肝硬化病人的筛查价值不高[7]。一项囊括了262例样本量的病毒性肝硬化病人的影像学诊断分析研究可见,依靠超声检查诊断病毒性肝硬化的灵敏度不足35%,特异度不足50%,同时漏诊率或者误诊率均较高[8]。而本次研究对于病毒性肝硬化病人血清相关因子的分析,能够揭示病毒性肝硬化的病情进展机制,并为病毒性肝硬化的血清学因子的诊断价值的分析提供参考。
ALB的表达主要与肝脏上皮细胞合成能力的改变有关,肝脏对于ALB的合成作用能够提高血清中ALB水平的上升,进而参与到自身免疫过程、营养物质循环、机体细胞代谢等生理过程。肝硬化的过程中肝脏上皮细胞的凋亡或者纤维化的发生,均能够影响到上皮细胞的合成能力,导致ALB水平的下降[9];CHE是肝脏上皮细胞内质网内合成和释放的相关激素酶,其表达水平的改变能够反映肝脏上皮细胞的内质网功能或者线粒体的活性,对于维持上皮细胞生理活性或者评估肝脏上皮细胞的功能状态均具有一定的参考价值[5, 10];PTA的改变是评估病人体内凝血功能活化程度的指标,PTA的上升主要与体内凝血因子水平或者活性的改变有关,肝硬化病人中由于肝脏上皮细胞合成功能的下降,凝血因子的合成能力显著的不足,影响到了凝血功能的活化程度。
本研究发现,ALB、CHE、PTA等在肝炎或者肝硬化病人中的表达均明显下降,其中ALB、CHE、PTA等在肝硬化病人中的表达水平可进一步地下降,提示了ALB、CHE、PTA均能够参与到肝硬化的发生发作过程中,通过荟萃国内外相关文献,笔者认为ALB、CHE、PTA表达的下降主要考虑与下列几个方面的因素有关[11-13]:(1)ALB的表达下降不仅与肝脏上皮细胞合成能力的下降有关,同时还与腹水形成活性局部内环境渗透压的改变导致ALB的漏出增多有关;(2)CHE的表达下降主要考虑与肝硬化病人肝脏上皮细胞的内质网功能的下降有关;(3)PTA表达水平的下降主要由于肝脏上皮细胞对于凝血因子Ⅷ、凝血因子Ⅵ等的合成减少有关。廖庚等[14-15]也认为,在肝硬化病人中,ALB的表达水平可平均下降26%以上,同时在肝硬化病程较长或者远期的病死率较高的病人中,ALB的下降可进一步地上升。Child-pugh分级是评估肝硬化病人肝功能残留功能的重要指标,Child-pugh的分级越高, 病人的肝脏代偿功能越差,本研究中发现Child-pugh分级越高,病人血清中ALB等相关成分的表达水平下降越为明显,提示ALB等指标与Child-pugh分级的密切关系,这主要考虑与ALB等指标能够反映病人肝脏上皮细胞残留功能,并能够对于肝脏上皮细胞的纤维化程度或者间质成分的代偿性增生进行相关的评估。但部分研究者并未发现ALB等指标与Child-pugh的关系,不同研究间存在不同的结论,考虑主要与ALB等指标的检测时机的不同、肝硬化病人随访时间的不同等因素有关。最后本次研究发现,ALB、CHE和PTA诊断病毒性肝炎肝硬化的ROC曲线下面积分别为0.835、0.897和0.746,CHE指标在诊断肝硬化的过程中具有较为理想的参考价值,提示临床上可以通过早期筛查CHE指标水平,进而评估病毒性肝硬化的发生风险。
本次研究的创新性在于探讨了ALB、CHE、PTA等指标与Child-pugh分级的关系。病毒性肝炎肝硬化病人ALB、CHE、PTA水平明显降低,可反映病人Child-pugh分级情况,同时具有一定的诊断价值。
血清白蛋白、胆碱酯酶及凝血酶原活动度对病毒性肝炎肝硬化的诊断价值
Value of the serum albumin, cholinesterase and prothrombin activity in the diagnosis of viral hepatitis cirrhosis
-
摘要:
目的探讨血清白蛋白(ALB)、胆碱酯酶(CHE)、凝血酶原活动度(PTA)检测在病毒性肝炎肝硬化诊断中的价值。 方法选取病毒性肝炎肝硬化病人63例(肝硬化组),病毒性肝炎病人60例(肝炎组),同时选取健康体检者60名作为对照组,检测各组ALB、CHE、PTA水平。 结果肝硬化组ALB、CHE和PTA明显低于肝炎组和对照组(P < 0.01);肝硬化组Child-pugh C级病人ALB、CHE和PTA明显低于Child-pugh B级和Child-pugh A级病人(P < 0.05~P < 0.01);ALB、CHE和PTA诊断病毒性肝炎肝硬化的ROC曲线下面积分别为0.835、0.897和0.746,截断值分别为31.41 g/L、3 785.41 U/L和36.59%时,灵敏度分别为73.30%、85.00%和93.30%,特异度分别为81.00%、79.40%和44.44%。 结论病毒性肝炎肝硬化病人ALB、CHE、PTA水平明显降低,可反映病人Child-pugh分级情况,同时具有一定的诊断价值。 -
关键词:
- 病毒性肝炎肝硬化 /
- 白蛋白 /
- 胆碱酯酶 /
- 凝血酶源活动度 /
- Child-pugh分级
Abstract:ObjectiveTo investigate the value of serum albumin (ALB), cholinesterase (CHE) and prothrombin activity (PTA) in the diagnosis of viral hepatitis cirrhosis. MethodsSixty-three viral hepatitis cirrhosis patients, 60 viral hepatitis patients and 60 healthy volunteers were divided into the cirrhosis group, hepatitis group and control group, respectively.The levels of ALB, CHE and PTA were detected in three groups. ResultsThe levels of ALB, CHE and PTA in cirrhosis group were significantly lower than those in hepatitis group and control group (P < 0.01).The levels of ALB, CHE and PTA in Child-pugh C patients were significantly lower than those in Child-pugh B and A in cirrhosis group (P < 0.05 to P < 0.01).The areas under the ROC curve of ALB, CHE and PTA in diagnosing viral hepatitis cirrhosis were 0.835, 0.897 and 0.746, respectively; the cut-off values of those were 31.41g/L, 3 785.41 U/L and 36.59%, respectively; the sensitivity of those were 73.30%, 85.00% and 93.30%, respectively, and the specificities of whose were 81.00%, 79.40% and 44.44%, respectively. ConclusionsThe levels of ALB, CHE and PTA in patients with viral hepatitis cirrhosis significantly decrease, which can reflect the classification of Child-pugh, and has certain diagnostic value. -
Key words:
- viral hepatitis cirrhosis /
- albumin /
- cholinesterase /
- prothrombin activity /
- Child-pugh score
-
表 1 各组受试者一般资料的比较
分组 n 男 女 年龄(x±s)/岁 对照组 60 40 20 51.46±8.49 肝炎组 60 38 22 50.21±9.01 肝硬化组 63 41 22 49.88±9.48 F — 0.15* 1.20 P — >0.05 >0.05 MS组内 — — 81.043 *示χ2值 表 2 3组ALB、CHE和PTA水平的比较(x±s)
分组 n ALB/(g/L) CHE/(U/L) PTA/% 对照组 60 45.52±5.46 8 645.00±1 420.22 88.46±18.46 肝炎组 60 34.20±6.10** 5 100.48±1 241.82** 60.21±20.15** 肝硬化组 63 23.22±7.25**△△ 2 708.16±1 344.50**△△ 42.54±15.16**△△ F — 190.69 305.55 101.41 P — < 0.01 < 0.01 < 0.01 MS组内 — 40.073 1 801 789 252.997 323.945 q检验:与对照组比较**P < 0.01;与肝炎组比较△△P < 0.01 表 3 肝硬化组不同Child-pugh分级病人ALB、CHE和PTA水平的比较(x±s)
Child-pugh分级 n ALB/(g/L) CHE/(U/L) PTA/% A级 17 30.51±4.82 3 700.64±1 350.03 51.16±12.03 B级 22 25.16±5.11** 2 500.18±1 260.63** 40.81±11.56* C级 24 18.96±4.06**△△ 2 001.84±1 150.62**△ 32.21±16.22**△ F — 31.31 9.46 9.62 P — < 0.01 < 0.01 < 0.01 MS组内 — 21.653 610 549 742.513 186.215 q检验:与A级比较*P < 0.05,**P < 0.01;与B级比较△P < 0.05,△△P < 0.01 表 4 ALB、CHE和PTA诊断病毒性肝炎肝硬化的ROC曲线参数
指标 曲线下面积 Z P 截断值 灵敏度/% 特异度/% ALB 0.835 12.445 <0.05 31.41 g/L 73.30 81.00 CHE 0.897 10.860 <0.05 3 785.41 U/L 85.00 79.40 PTA 0.746 11.257 <0.05 36.59% 93.30 44.44 -
[1] YANG F, WANG Q, WANG Z, et al.The Natural History and Prognosis of Primary Biliary Cirrhosis with Clinical Features of Autoimmune Hepatitis[J].Clin Rev Allergy Immunol, 2016, 50(1):114. doi: 10.1007/s12016-015-8516-5 [2] HIGAKI A, ITO K, TAMADA T, et al.Prognosis of small hepatocellular nodules detected only at the hepatobiliary phase of Gd-EOB-DTPA-enhanced MR imaging as hypointensity in cirrhosis or chronic hepatitis[J].Eur Radiol, 2014, 24(10):2476. doi: 10.1007/s00330-014-3293-8 [3] 张志丽, 曲金宁, 李娟, 等.肝炎肝硬化患者血清白蛋白、胆碱酯酶、凝血酶原活动度测定的临床意义[J].肝脏, 2015, 35(10):829. doi: 10.3969/j.issn.1008-1704.2015.10.023 [4] 臧晓珍, 黄迪, 李静.老年肝硬化患者血清白蛋白、前白蛋白、胆碱酯酶、胆汁酸检测的意义[J].中国老年学杂志, 2015, 35(4):922. doi: 10.3969/j.issn.1005-9202.2015.04.025 [5] 王爽, 柯盈月, 李权伦, 等.血清前白蛋白、胆碱酯酶、凝血酶原活动度水平联合Child-Pugh分级对肝硬化患者预后的判断[J].临床消化病杂志, 2017, 29(6):346. doi: 10.3870/lcxh.j.issn.1005-541X.2017.06.04 [6] TARHUNI A, GUYOT E, RUFAT P, et al.Impact of cytokine gene variants on the prediction and prognosis of hepatocellular carcinoma in patients with cirrhosis[J].J Hepatol, 2014, 61(2):342. doi: 10.1016/j.jhep.2014.04.011 [7] MIZUGUCHI T, KAWAMOTO M, MEGURO M, et al.Prognosis and predictors of surgical complications in hepatocellular carcinoma patients with or without cirrhosis after hepatectomy[J].World J Surg, 2013, 37(6):1379. doi: 10.1007/s00268-013-1989-6 [8] LEWIN M, GELU-SIMEON M, OSTOS M, et al.Imaging features and prognosis of hepatocellular carcinoma in patients with cirrhosis who are coinfected with human immunodeficiency virus and hepatitis C virus[J].Radiology, 2015, 277(2):443. doi: 10.1148/radiol.2015141500 [9] 翟永贞, 岳阳阳, 丁德平, 等.血清前白蛋白联合终末期肝病模型评分评估失代偿期肝硬化患者预后的临床价值[J].中华肝脏病杂志, 2017, 25(7):533. doi: 10.3760/cma.j.issn.1007-3418.2017.07.012 [10] 谭建荣, 罗显克, 王大东, 等.肝硬化患者血清胆碱酯酶和腺苷脱氨酶联合检测的临床意义[J].现代生物医学进展, 2014, 14(8):1494. [11] 郭飞波, 吴安爽, 曾理.血清甲胎蛋白联合胆碱酯酶对肝硬化合并肝癌的诊断价值及与Child-Pugh分级的相关性[J/CD].中华临床医师杂志(电子版), 2017, 11(2): 226. [12] 郭飞波.肝硬化伴肝癌患者血氨、甲胎蛋白、胆碱酯酶、肝纤维化指标与Child-Pugh分级的相关性[J].中国免疫学杂志, 2017, 33(8):1209. doi: 10.3969/j.issn.1000-484X.2017.08.018 [13] 童杨雯, 张青.肝硬化患者外周血甲胎蛋白与丙酮酸激酶M2和白蛋白mRNA的表达及临床意义[J].中国临床药理学杂志, 2017, 33(12):1094. [14] 廖庚, 欧士钰.血清糖类抗原125、胆碱酯酶、前白蛋白与肝硬化患者肝功能关系研究[J].湖北科技学院学报(医学版), 2016, 30(2):122. [15] 侯玉丽, 高梦丹, 郭鸿雁, 等.白蛋白-胆红素指数与血氨联合检测对肝硬化并发肝性脑病的诊断价值评估[J].中华医学杂志, 2018, 98(2):127. doi: 10.3760/cma.j.issn.0376-2491.2018.02.011 -




 下载:
下载: