-
血管瘤是婴幼儿最常见的血管性良性肿瘤,其确切的发病机制尚未完全阐明[1],治疗方法繁多(如激光、皮质激素、干扰素、手术等),但缺乏靶向性,疗效远不尽人意。建立一种理想的血管瘤动物模型, 为血管瘤的研究建立平台成为临床上的迫切需求。本研究利用组织块法体外培养增生期血管瘤内皮细胞,植入裸鼠皮下,生长成瘤建立裸鼠血管瘤动物模型。现作报道。
-
收集蚌埠医学院第一附属医院整形外科手术切除的婴幼儿增生期血管瘤标本15例,无菌操作剪成1 mm3大小颗粒,接种于含M199培养液的培养瓶底部,颗粒间距约5 mm。48 h后更换培养液,以后每隔3~4 d更换培养液,待细胞汇合成片铺满瓶底即可常规传代。期间在相差显微镜下动态观察并记录细胞生长情况、绘制血管瘤内皮细胞生长曲线。传代期间通过机械刮除法、酶消化法、反复贴壁法对所培养细胞进行纯化。取第4代细胞进行性质鉴定。鉴定采用形态学观察法和CD31、CD34及第Ⅷ因子相关抗原免疫组化染色法(SP法)。
-
10只BALB/c裸鼠,雌性、4~6周龄、质量18~22 g,购自南京大学动物研究中心。将体外培养的3~6代血管瘤内皮细胞浓集,达到3×108/mL,然后用注射器植入10只裸小鼠双侧胸壁、双侧腰部皮下组织内,每处约0.1 mL,每只4处,共40处。植入完成后自然生长,每周定期观察移植瘤生长情况。于移植后第1、2、4、8周用游标卡尺测量肿瘤最大直径a及横径b,根据公式V=π/6×a×b2估算肿瘤体积变化。
-
第8周、12周分别切取瘤体组织,同时取裸鼠肌肉组织作为阴性对照,均进行切片鼠抗人CD31、CD34单克隆抗体(西安华美生物技术有限公司提供)免疫组织化学标记,并做阳性细胞计数。判断标准:镜下以细胞质出现黄色、棕黄色、棕褐色颗粒为阳性,高倍镜下取4个不同视野,各计数100个细胞,按阳性细胞所占的百分率分为-~4+,无阳性细胞为阴性表达(-),阳性细胞 < 10%为+, 阳性细胞占10%~50%为2+, 阳性细胞占>50%~75%为3+, 阳性细胞>75%为4+。
-
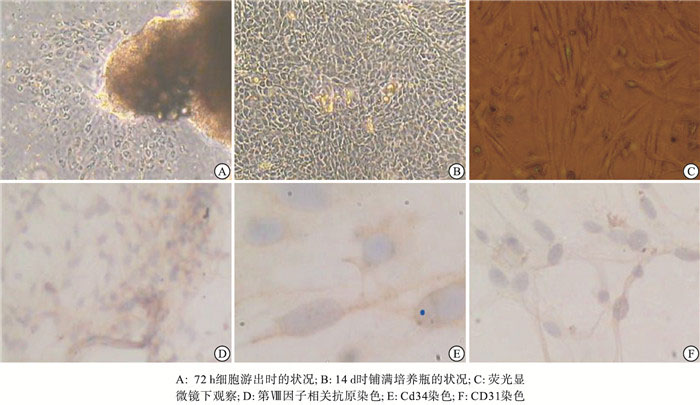
接种48~72 h后内皮细胞从组织块边缘成团游出,贴壁生长,细胞呈圆形、椭圆形或多角形,饱满,边界清楚,折光性强,胞膜完整,细胞核呈圆或椭圆形,居中。2~3周后内皮细胞铺满培养瓶瓶底,呈单层分布,呈接触抑制生长特性,形成典型“铺路卵石状”排列。细胞质或膜中有明显的棕黄色颗粒沉着,细胞核无染色,表明第Ⅷ因子相关抗原、CD31和CD34染色均呈阳性表达(见图 1)。
-
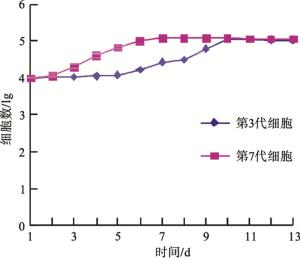
根据细胞计数结果,绘制第3代、第7代血管瘤内皮细胞生长曲线。第3代血管瘤内皮细胞的生长曲线呈“S”形,细胞数量在接种后6~7 d进入快速增殖期,第10 d左右细胞数量达到高峰值,此后进入平台期,观察期间未见明显的衰退期。第7代血管瘤内皮细胞生长曲线与第3代细胞生长曲线有所区别,走势较陡直,接种第3~4天细胞快速增殖,第6~7天数量达到高峰值,此后细胞数量进入持续时间较长的稳定期即平台期;从血管瘤内皮细胞的生长曲线看出,第7代细胞和第3代细胞生长情况差别较大。笔者推测可能是由于经反复传代后细胞的性状发生了改变,有可能7代以后细胞已不具备内皮细胞的生长特性(见图 2)。
-
在模型建立8周时间,有1只裸鼠出现质量减轻、活动较少、精神萎靡,其余小鼠均存活良好,食欲旺盛、反应敏捷、活动有力。所形成的瘤体呈浅粉红色,质韧,切开表皮发现瘤体被包膜包绕,边界清楚,血供丰富,出血较多。所种40处瘤体存活率87.5%(35/40)。种植瘤体积生长情况见表 1、图 3。在第1周内,种植的内皮细胞所形成的包块体积进行性缩小至完全吸收。第2周以后,发现有瘤体渐进性增长,第2周到第4周时间内瘤体体积增长缓慢,4~8周瘤体体积增长较快。8周以后种植瘤体再次进入生长缓慢期,瘤体相继缓慢缩小,颜色变浅,第12周发现瘤体体积只有8周时的2/3,切开瘤体多是纤维和脂肪细胞,残存少量血管瘤内皮细胞和扩张的血管。这与临床观察到的血管瘤的发展过程极其相似:早期增殖极其迅速,常在出生后1个月内发病,6个月内廇体迅速增大,此后的6个月增长速度有所减慢,从1岁左右开始血管瘤大多开始趋向消退,50%在5岁以内完全消退不留任何痕迹。另有50%血管瘤消退后可残留瘢痕、纤维、脂肪组织和扩张血管等。
饲养时间/周 瘤体体积/cm3 1 0.022±0.001 2 0.295±0.027 4 0.357±0.032 8 0.918±0.043 12 0.692±0.103 表 1 肿瘤体积增长情况(x±s)
-
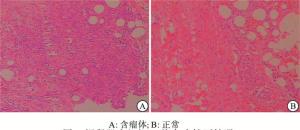
切取的瘤体组织行切片HE染色,光镜下可见内皮细胞密集,呈团块样增生,形成条索或管状结构,另有纤维组织和少量脂肪细胞。内皮细胞质被染成红色,核被染成蓝紫色,偶见核分裂。正常的裸鼠肌肉组织作为对照,发现其细胞核分布均匀,无深染。未见明显细胞核聚集分布,细胞增殖正常(见图 4)。
-
在光学显微镜下观察发现棕黄色颗粒满视野弥漫性分布,呈阳性表达。第8周,CD31和CD34阳性指数分别为92.43± 5.56(4+)和92.53±5.01(4+);第12周,其阳性指数分别为72.23±10.74(3+)和65.89±18.69(3+)。肌肉组织阴性表达。表明瘤体来源于体外培养的血管瘤内皮细胞,而非裸鼠组织(见图 5)。
-
近年来,制作血管瘤动物模型成为研究血管瘤的一种理想方法[2]。HOAK等[3]1971年给同源小鼠移植血管内皮瘤而制作出血管瘤模型,但这种肿瘤为混合细胞型,其中的非内皮细胞可能有助于肿瘤形成;PRIMO等[4]成功利用多瘤病毒基因片段为载体,建立起血管瘤动物模型,并已经形成特定的F-2和Py-4-1系细胞,但这种方法建立的模型表现的是恶性瘤的特点,常导致裸鼠死亡,其生物学特性与临床人血管瘤有本质的区别;2004年有学者[5]应用婴儿增生期毛细血管瘤,将瘤体组织直接转种于裸小鼠皮下,动态观察瘤体生长情况及组织学变化,获得成功,其模型的建立虽然能客观、真实地反映人血管瘤临床发展过程,但由于血管瘤组织在裸鼠体内延续了其原来供体组织的生长进程,对于血管瘤的发生亦未能完全重现。虎小毅等[6]通过直接选择合适标本体外培养出血管瘤内皮细胞注射于裸鼠皮下,建立血管瘤模型获得成功。为此本实验通过组织块法血管瘤内皮细胞的体外培养,获得大量增殖的纯化的血管瘤内皮细胞移植于裸鼠皮下,建立真正反映血管瘤发生、发展的动物模型。
-
来源不同的血管瘤细胞生物学性质有很大区别。尚未见将人血管瘤内皮细胞克隆成系的报道。MEININGE等[7]研究发现培养的血管瘤内皮细胞可增加干细胞因子的释放。干细胞因子对肥大细胞有化学趋化作用,可以解释血管瘤中有大量肥大细胞聚集。而肥大细胞聚集后脱颗粒,产生许多刺激血管瘤内皮细胞生长的物质。同时,在培养中肥大细胞颗粒可引起人毛细血管内皮细胞的增殖。对培养的其他毛细血管内皮细胞的研究也证实内皮细胞可以分泌多种生长因子以及部分细胞外基质成分,这可以解释为什么纯化的内皮细胞能在体外形成血管[8]。血管瘤以内皮细胞增殖为特征,因此培养血管瘤内皮细胞就要求尽可能地去除内皮细胞以外的其他细胞。血管瘤内皮细胞有两种主要的培养方法:酶消化法和组织块法[9]。其中消化法得到的内皮细胞中杂细胞比较多,而组织块培养法培养的细胞从组织块四周放射性贴壁长出,此方法获得的杂细胞比较少[10]。
与传统的消化法相比,组织块法培养血管瘤内皮细胞细胞损伤较小,便于细胞贴壁生长,避免了因组织消化而混入大量的成纤维细胞以及其他细胞[11],提高了该细胞的纯度。尽管如此,用组织块法培养的内皮细胞还必须经过纯化。另外可以利用内皮细胞表达一些特异性的标志物如CD34、Ï相关抗原等用免疫磁珠或流式细胞仪来分离细胞,这种方法获得的细胞纯度高,所需时间短,并且不影响进一步的研究[12]。但是这两种方法比较昂贵,不利于推广。
一般异种组织种植到裸鼠体内,经过2~3周的恢复期,这期间移植物重新建立血供,早期因缺血缺氧发生的细胞变性转归为功能状态重新开始恢复,并进入增殖期[13-15]。我们的试验研究表明种植血管瘤内皮细胞至裸鼠皮下亦存在类似的情况,但是时间上与直接种植组织的恢复时间要提前到1周,可能是由于细胞增殖活性不同而出现不同的恢复时间,再加上血管瘤内皮细胞本身可以促进血管生成,血供易于建立有关。种植成活瘤体有着类似临床人血管瘤特殊的增生、消退生物学特性过程。
本研究在临床上收集增生期婴幼儿毛细血管瘤标本通过组织块法体外培养,然后再纯化浓集血管瘤内皮细胞转种于裸小鼠皮下建立血管瘤动物模型,成活的血管瘤瘤体与原人体血管瘤比较, 其血管瘤的生物学和病理特征基本一致,可以观察到从发生到迅速增殖再到消退的类似临床人血管瘤演变过程。组织块法增生期血管瘤裸鼠动物模型的建立为进一步阐明现有疗法的作用机制并对血管瘤的新疗法的发现提供一较理想平台。
内皮祖细胞在裸鼠体内再现人血管瘤的生物学特性研究
Biological characteristics of the endothelial progenitor cells in regenerating human hemangioma in nude mice
-
摘要:
目的研究人血管瘤内皮祖细胞(EPcs)在裸鼠体内分化情况,进一步揭示其生物学特性。 方法组织块法体外培养增生期血管瘤内皮祖细胞(经CD31、CD34及Ⅷ因子相关抗原鉴定),浓集后分别种植于裸鼠双侧胸壁、腰部皮下,动态观察移植瘤生长情况及组织学变化,并用血管内皮细胞特异性标志物鼠抗人CD31、CD34免疫组化单克隆抗体染色研究所成瘤体的同源性。 结果体外培养血管瘤内皮祖细胞生长良好,细胞计数为3×108个/培养瓶,CD31、CD34及Ⅷ因子相关抗原免疫组化检测阳性表达,裸鼠皮下植入后所形成的瘤体与原血管瘤生物学特点及病理特征相似,经CD31、CD34鉴定瘤体来源于人血管瘤内皮细胞。 结论内皮祖细胞是血管瘤发生的细胞来源,此可作为血管瘤的动物模型,为血管瘤的研究提供较理想平台。 Abstract:ObjectiveTo study the differentiation of human hemangioma endothelial progenitor cells(EPcs) in nude mice, and further reveal its biological characteristics. MethodsThe hemangioma endothelial progenitor cells in proliferative stage were cultured in vitro, identified by CD31, CD34 and Ⅷ-factor related antigens, and subcutaneously inoculated into the bilateral chest wall and waist of nude mice.The growth characteristics and histologic changes of transplanted tumors were regularly observed.The transplanted tumor's homology was identified by immunohistochemical staining of the vascular endothelial cell specific marker CD31 and CD34. ResultsThe growth of EPcs was good in vitro, the number of EPcs was 3×108, and the positive expressions of CD31, CD34 and Ⅷ-factor related antigen were detected by immunohistochemistry.The biological and pathological characteristics between tumor formation after subcutaneous implantation and original hemangioma were similar in nude mice.The tumor identified by CD31 and CD34 was derived from human hemangioma endothelial cells. ConclusionsThe cell source of hemangioma is derived from EPCs, which can be used as the animal models of hemangioma, and provide an ideal platform for the study of hemangioma. -
Key words:
- hemangioma /
- endothelial progenitor cell /
- animal model /
- nude mice
-
表 1 肿瘤体积增长情况(x±s)
饲养时间/周 瘤体体积/cm3 1 0.022±0.001 2 0.295±0.027 4 0.357±0.032 8 0.918±0.043 12 0.692±0.103 -
[1] BRUCKNER AL, FRIEDEN IJ.Hemangioma of infancy[J].J Am Acad Dermatol, 2003, 48(4):477. doi: 10.1067/mjd.2003.200 [2] TAN ST, HASANQ, VELICKOVIC M, et al.A Novel in vitro human model of hemangioma[J].Mod Pathol, 2000, 13(1):92. doi: 10.1038/modpathol.3880014 [3] HOAK JC, WARNER ED, CHENG HF, et al.Hemangioma with thrombocytopenia and microangiopathic anemia (Kasabach-Merritt syndrome):an animal model[J].J Lab Clin Med, 1971, 77(6):941. [4] PRIMO L, ROCA C, FERRANDI C, et al.Human endothelial cells expressing polyma middle T induce tumors[J].Oncogene, 2000, 19(32):3632. doi: 10.1038/sj.onc.1203708 [5] TANG Y, LIU W, YU S, et al.A novel in vivo model of human hemangioma:xenograft of human hemangioma tissue on nude mice[J].Plast Reconstr Surg, 2007, 120(4):869. doi: 10.1097/01.prs.0000277661.49581.c9 [6] 虎小毅, 杨壮群, 宋勇, 等.细胞悬液接种法血管瘤裸鼠动物模型的建立[J].中国美容医学, 2008, 17(7):1012. doi: 10.3969/j.issn.1008-6455.2008.07.027 [7] MEININGER CJ, BRIGHTMAN SE, KELLY K A, et al.Increased stem cell factor release by hemangioma-derived endothelial cells[J].Lab Invest, 1995, 72(2):166. [8] PETERSON AW, CALDWELL DJ, RIOJA AY, et al.Vasculogenesis and angiogenesis in modular collagen-fibrin microtissues[J].Biomater Sci, 2014, 2(10):1497. doi: 10.1039/C4BM00141A [9] 稂翠玲, 孙斌, 雷红召, 等.血管瘤血管内皮细胞体外分离纯化方法的优化[J].中国美容医学, 2018, 27(4):65. [10] 李攀登, 陈润芳, 张莉, 等.婴幼儿增生期血管瘤内皮细胞观察:培养、鉴定及生长状况[J].中国组织工程研究, 2015, 19(51):8276. doi: 10.3969/j.issn.2095-4344.2015.51.014 [11] CHALAJOUR F, TREEDE H, EBRAH IMNEJAD A, et al.Angiogenic activation of vascular endothelial cells in aortic valve stenosis[J].Exp Cell Res, 2004, 298(2):455. doi: 10.1016/j.yexcr.2004.04.034 [12] BALAN S, KALE VP, LIMAYE LS.A simple two-step culture system for the large-scale generation of mature and functional dendritic cells from umbilical cord blood CD34+ cells[J].Transfusion, 2009, 49(10):13. [13] 米萱.自噬抑制2-DG诱导的内皮细胞凋亡及自噬在婴幼儿血管瘤中的活性研究[D].西安: 第四军医大学, 2016. [14] HARBI S, PARK H, GREGORY M, et al.Arrested development:infantile hemangioma and the stem cell teratogenic hypothesis[J].Lymphat Res Biol, 2017, 15(2):153. doi: 10.1089/lrb.2016.0030 [15] 徐艳朋, 俞松, 彭岗, 等.Raf-1和p-ERK在血管瘤裸鼠移植模型中的表达及意义[J].中华小儿外科杂志, 2015, 36(12):936. doi: 10.3760/cma.j.issn.0253-3006.2015.12.013 -




 下载:
下载: