-
乙型肝炎病毒(HBV)感染是一个重要的全球公共卫生问题,慢性乙型病毒性肝炎(CHB)可进展为终末期肝病,包括肝硬化、肝功能失代偿及原发性肝细胞癌(HCC)等[1]。抗病毒治疗是控制HBV感染的重要措施。目前乙型肝炎抗病毒治疗的终点分为部分功能性治愈、功能性治愈、彻底治愈等[2]。抗病毒治疗药物主要包括干扰素和核苷(酸)类似物(NAs),包括拉米夫定、阿德福韦酯、恩替卡韦、替诺福韦酯、替比夫定。NAs的作用主要是抑制病毒复制,它不能消除肝细胞内的cccDNA,所以NAs治疗CHB疗程较长。本研究通过观察CHB病人接受NAs治疗HBV DNA阴转后血清HBsAg的变化,探讨NAs药物治疗CHB的可能疗程。
-
选取2016年8月至2017年10月蚌埠医学院第一附属医院感染病科门诊及住院的采用NAs治疗的CHB病人225例。其中HBeAg阳性病人109例,男77例,女32例,年龄12~70岁;HBeAg阴性病人116例,男71例,女45例,年龄23~69岁。入组病人均符合中华医学会肝病学分会制定的《慢性乙型肝炎防治指南(2015年版)》[3]规定的诊断标准,入组标准:(1)所有口服NAs药物治疗且HBsAg阳性≥6个月;(2)HBV DNA≤500 copies/mL。排除标准:(1)合并其他病毒感染如甲型病毒肝炎、丙型肝炎病毒、丁型肝炎病毒;(2)酒精性肝病、肝硬化、自身免疫性肝病、肝癌等;(3)代谢性肝病、脂肪肝等。
-
入组病人均口服NAs单药治疗,观察HBV DNA阴转后(基线)、6个月、1年、3年、5年、7年HBsAg水平的变化。
-
HBsAg滴度通过Cobas e 411型电化学发光全自动免疫分析仪及Elecsys试剂盒进行定量测定(德国罗氏诊断),其线性检测范围为0.05~52 000 IU/mL;HBV DNA定量检测方法为荧光PCR定量核酸分析技术,最低检出限为500 copies/mL;肝功能检测方法为酶学法检测,采用全自动生化仪。
-
对纳入的所有病人进行治疗及随访观察,不同时间点(基线、6个月、1年、3年、5年、7年)检测乙型肝炎五项定量及HBV DNA,并进行肝功能等检查,记录治疗后各阶段HBsAg、HBeAg、HBV DNA定量值及丙氨酸氨基转移酶(ALT)值。
-
采用方差分析和q检验、多元线性回归分析。
-
随访显示,HBeAg阳性病人和HBeAg阴性病人经NAs治疗后,基线、6个月、1年、3年、5年、7年HBsAg水平呈波动性下降趋势(P < 0.01)(见表 1)。
分组 n 基线 6个月 1年 3年 5年 7年 F P MS组内 HBeAg阳性 109 3.347±0.686 3.329±0.435 3.107±0.579**△△ 3.369±0.418# 2.960±0.497**△△##++ 2.164±0.571**△△##++▲▲ 79.86 < 0.01 0.291 HBeAg阴性 116 3.133±0.612 3.193±0.480 2.971±0.769△ 2.964±0.564△ 2.536±0.602**△△##++ 2.083±0.626**△△##++▲▲ 52.13 < 0.01 0.378 合计 225 3.202±0.662 3.230±0.484 3.010±0.69**△△ 3.077±0.562*△ 2.862±0.573**△△#++ 2.164±0.605**△△##++▲▲ 97.39 < 0.01 0.362 q检验:与基线比较*P < 0.05, **P < 0.01;与6个月比较△P < 0.05, △△P < 0.01;与1年比较#P < 0.05,##P < 0.01;与3年比较++P < 0.01;与5年比较▲▲P < 0.01 表 1 HBV DNA阴转后HBsAg水平变化(x±s;log10IU/mL)
-
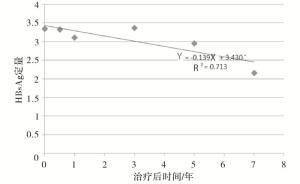
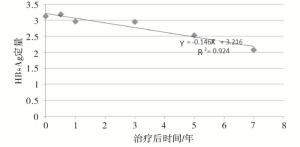
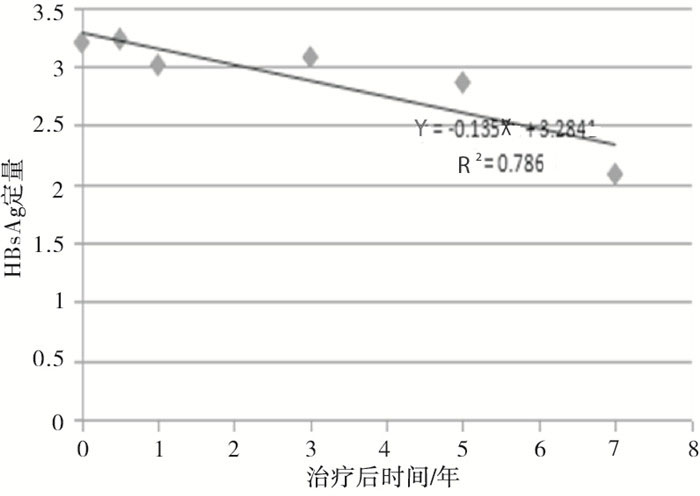
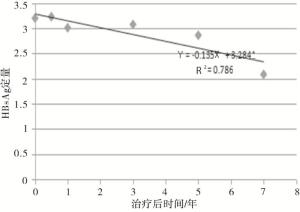
根据HBsAg定量的下降趋势拟合数据线性回归方程为:$\hat{Y}$=-0.135X+3.284(R2=0.786,P < 0.01)(见图 1),其中HBeAg阳性组$\hat{Y}$=-0.139X+3.430(R2= 0.713,P < 0.01)(见图 2),HBeAg阴性组$\hat{Y}$=-0.146X+3.216(R2=0.924,P < 0.01)(见图 3),从而推算HBeAg阳性组和HBeAg阴性组HBsAg清除时间分别为25年和22年。
-
血清中HBsAg是HBV感染者体内最先出现的HBV相关蛋白,由HBV DNA编码产生,能反映肝内cccDNA的水平[4]。MAYNARD等[5]研究表明,阿德福韦酯联合拉米夫定抗病毒治疗后病人出现血清HBsAg的阴转并伴肝组织内HBV cccDNA的显著降低。CHB治疗的理想终点是HBsAg转阴。传统检测方法仅能对HBsAg进行定性检测,本实验的检测指标为HBsAg定量,与传统检测仅能判断HBsAg有无相比,HBsAg定量把指标量化,使乙型肝炎自然史、疾病转归以及疗效预测逐渐变得清晰。通过HBsAg定量的动态变化评价抗病毒药物治疗的疗效,对指导治疗及判断预后有重要意义。
本研究结果表明,在NAs治疗中HBsAg定量总体呈下降趋势, 和BOGLIONE等[6]对不同基因型乙型肝炎经恩替卡韦治疗的研究结果相似,他比较了治疗后6个月、1年、2年、3年HBsAg定量,发现在治疗过程中HBsAg定量不论在何种基因型中都呈降低趋势。并根据这些模型计算出HBsAg定量消失预期时间为A、D、E基因型分别为15.6年、17年和24.6年。有实验[7]证明在NAs治疗中HBsAg定量的下降比在聚乙二醇干扰素治疗期间的下降要慢。干扰素可显著降低肝细胞内HBV cccDNA。钮志林等[8]研究表明经干扰素治疗48周后肝组织内的HBV cccDNA较治疗前明显下降,与外周血的HBsAg定量及HBV DNA定量均有明显的相关性。一项对干扰素治疗CHB的研究[9]指出病人中有70.8%在48周疗程结束时获得病毒学应答;随访24周,有38.8%病人获得持续病毒学应答。临床研究[10]表明,经干扰素治疗病人约有30%治疗后可获得停药后的持续病毒学应答,经过长期随访得知获得血清学转换率或HBsAg消失的病人可高达10%,而且不同HBV基因型的应答情况有显著性差异。但是干扰素需皮下注射,价格昂贵,且不良反应多,很多病人难以耐受。
在CHB的自然史中HBeAg阳性慢性HBV感染期(既往称为免疫耐受期)的HBsAg水平是最高的,其次为HBeAg阳性慢性肝炎即免疫清除期[11]。HBeAg阳性病人的HBsAg水平显著高于HBeAg阴性病人。在本研究的各个时间节点中HBeAg阳性病人的HBsAg水平均高于HBeAg阴性组病人。HBeAg阳性病人组HBsAg水平的下降程度明显高于HBeAg阴性病人组(分别为0.169 log10 IU·mL-1·年-1和0.085 log10 IU·mL-1·年-1,P=0.02)这与SETO等[12]对恩替卡韦治疗5年的随访结果一致,恩替卡韦治疗5年后HBsAg定量平均每年下降约0.125 log10IU/mL,HBeAg阳性病人组和HBeAg阴性病人组HBsAg水平的下降程度分别为0.144 log10 IU·mL-1·年-1和0.098 log10 IU·mL-1·年-1。HBeAg阴性病人组HBsAg水平下降程度较HBeAg阳性病人组少。
根据HBsAg定量的下降趋势拟合线性回归方程为:$\hat{Y}$=-0.135X+3.284(R2=0.786),其中HBeAg阳性组$\hat{Y}$=-0.139X+3.430(R2=0.713),HBeAg阴性组$\hat{Y}$=-0.146X+3.216(R2=0.924),推算HBsAg清除时间HBeAg阳性组和HBeAg阴性组分别为25年和22年。HBeAg阳性组HBsAg定量高于HBeAg阴性组,因此基线HBsAg定量相对低水平治疗效果更好。CHB治疗最理想的目标是HBsAg阴转伴或不伴有抗-HBs血清学转换,从上述的研究结果表明采用NAs治疗CHB要达到理想的目标需要一个长期的疗程。
本研究纳入样本需进一步扩大且缺乏同一病人HBsAg定量连续监测数据,对此进行补充能使研究结果更科学,能更真实地反映出在抗病毒药物治疗下CHB的转归。因此,增加样本量,将5种抗病毒药物进行组间比较是非常重要的。HBsAg水平的监测对确定CHB病人停药时间以及评估停药后的复发等方面同样具有重要意义[13-14]。
综上所述,随着HBsAg定量检测技术的不断进步,血清中HBsAg与体内HBV的关系越来越明确,通过对HBsAg滴度水平的监测,临床医生能对乙型肝炎的发生、发展、指导治疗用药以及治疗后疾病的转归、预后都能有较清晰的认识,有助于优化治疗方案、提高疗效。
NAs治疗慢性乙型肝炎后HBsAg变化的特点和影响因素分析
Analysis of the characteristics and influencing factors of HBsAg change in chronic hepatitis B patients treated with NAs
-
摘要:
目的观察慢性乙型病毒性肝炎(CHB)病人接受核苷(酸)类似物(NAs)治疗HBV DNA阴转后血清HBsAg定量的动态变化,对HBeAg阳性和HBeAg阴性组病人HBsAg定量的变化进行比较,推算HBsAg清除所需时间,探讨NAs药物治疗CHB的可能疗程。 方法以NAs治疗HBV DNA阴转时HBsAg定量为基线值,观察6个月、1年、3年、5年、7年的HBsAg水平的动态变化,并比较HBeAg阳性组及HBeAg阴性组HBsAg定量之间的差异。 结果109例HBeAg阳性病人,HBV DNA阴转时及6个月、1年、3年、5年、7年后HBsAg平均水平分别为3.347、3.329、3.107、3.169、2.960、2.164 log10IU/mL;116例HBeAg阴性病人,HBsAg平均水平分别为3.133、3.193、2.970、2.967、2.536、2.083 log10IU/mL。经NAs治疗,HBeAg阳性病人和HBeAg阴性病人HBV DNA阴转后、6个月、1年、3年、5年、7年HBsAg水平呈波动性下降趋势(P < 0.01)。根据HBsAg定量的下降趋势拟合的线性回归方程,推算HBeAg阳性组和HBeAg阴性组的HBsAg清除时间分别为25年和22年。 结论NAs治疗的CHB病人,理论上推测HBeAg阳性组和HBeAg阴性组HBsAg的清除均需20年以上的时间,采用NAs治疗CHB需要较长的疗程。 Abstract:ObjectiveTo observe the dynamic change of HBsAg serum level in chronic hepatitis B(CHB) patients treated with NAs for HBVDNA negative conversion, compare the change of HBsAg between HBeAg-positive and HBeAg-negative patients, estimate the time of HBsAg clearance, and explore the possible course of CHB treated with NAs. MethodsThe quantitation of HBsAg in patients treated with NA HBVDNA negative conversion was set as the baseline value, the dynamic change of HBsAg levels were observed after 6 months, 1 year, 3 years, 5 years and 7 years of HBVDNA negative conversion, and the difference of HBsAg quantification between HBeAg(+) group and HBeAg(-) group was compared. ResultsAmong 109 HBeAg-positive patients, the mean levels of HBsAg after 6 months, 1 year, 3 years, 5 years and 7 years of HBVDNA negative conversion were 3.347, 3.329, 3.107, 3.169, 2.960 and 2.164 log10IU/mL, respectively.Among 116 HBeAg-negative patients, the mean levels of HBsAg after 6 months, 1 year, 3 years, 5 years and 7 years of HBVDNA negative conversion were 3.133, 3.193, 2.970, 2.967, 2.536 and 2.083 log10IU/mL, respectively.After NAs treatment, the HBsAg levels in HBeAg-positive and HBeAg-negative patients showed a decreasing trend of fluctuation at 6 months, 1 year, 3 years, 5 years and 7 years after HBVDNA negative conversion(P < 0.01).According to the linear regression equation fitted by the quantitative decline trend of HBsAg, the HBsAg clearance time in HBeAg positive group and HBeAg negative group were calculated to be 25 years and 22 years, respectively. ConclusionsAmong the CHB treated with NAs, the clearance time of HBsAg in HBeAg positive group and HBeAg negative group will take more than 20 years in theory.Therefore, the treatment of CHB with NAs requires a long course of treatment. -
Key words:
- hepatitis B /
- HBsAg /
- NAs /
- HBV DNA
-
表 1 HBV DNA阴转后HBsAg水平变化(x±s;log10IU/mL)
分组 n 基线 6个月 1年 3年 5年 7年 F P MS组内 HBeAg阳性 109 3.347±0.686 3.329±0.435 3.107±0.579**△△ 3.369±0.418# 2.960±0.497**△△##++ 2.164±0.571**△△##++▲▲ 79.86 < 0.01 0.291 HBeAg阴性 116 3.133±0.612 3.193±0.480 2.971±0.769△ 2.964±0.564△ 2.536±0.602**△△##++ 2.083±0.626**△△##++▲▲ 52.13 < 0.01 0.378 合计 225 3.202±0.662 3.230±0.484 3.010±0.69**△△ 3.077±0.562*△ 2.862±0.573**△△#++ 2.164±0.605**△△##++▲▲ 97.39 < 0.01 0.362 q检验:与基线比较*P < 0.05, **P < 0.01;与6个月比较△P < 0.05, △△P < 0.01;与1年比较#P < 0.05,##P < 0.01;与3年比较++P < 0.01;与5年比较▲▲P < 0.01 -
[1] WANG FS, FAN JG, ZHANG Z, et al.The global burden of liver disease:the major impact of China[J].Hepatology, 2014, 60(6):2099. doi: 10.1002/hep.v60.6 [2] LIANG TJ, BLOCK TM, MCMAHON BJ, et al.Present and future therapies of hepatitis B:from discovery to cure[J].Hepatology, 2015, 62(6):1893. doi: 10.1002/hep.28025 [3] 王贵强, 王福生, 成军, 等.慢性乙型肝炎防治指南(2015年更新版)[J].临床肝胆病杂志, 2015, 31(12):1941. doi: 10.3969/j.issn.1001-5256.2015.12.002 [4] 陈嵬, 吴峰, 窦晓光, 等.慢性HBV感染者肝脏HBV cccDNA含量相关因素分析[J].临床肝胆病杂志, 2013, 29(6):434. doi: 10.3969/j.issn.1001-5256.2013.06.011 [5] MAYNARD M, PARVAZ P, DURANTEL S, et al.Sustained HBs seroconversion during lamivudine and adefovir dipovoxil combination therapy for lamivudine failure[J].Hepatol, 2005, 42(2):279. doi: 10.1016/j.jhep.2004.09.017 [6] BOGLIONE L, CARDELLINO CS, DE NICOLÒ A, et al.Different HBsAg decline after 3 years of therapy with entecavir in patients affected by chronic hepatitis B HBeAg-negative and genotype A, D and E[J].J Med Virol, 2014, 86(11):1845. doi: 10.1002/jmv.v86.11 [7] ZENG LY, LIAN JS, CHEN JY, et al.Hepatitis B surface antigen levels during natural history of chronic hepatitis B:a Chinese perspective study[J].World J Gastroenterol, 2014, 20(27):9178. [8] 钮志林, 朱翔, 沈伟强.干扰素对慢性乙型肝炎病人肝细胞内HBV cccDNA、血清HBsAg、HBV-DNA的影响研究[J].中华医院感染学杂志, 2014, 24(4):792. [9] 肖作汉, 孟冈, 王立志.HBsAg定量对HBeAg阴性病人PEG-IFN治疗应答的预测[J].肝脏, 2014, 19(12):949. doi: 10.3969/j.issn.1008-1704.2014.12.013 [10] 陶晨, 叶伟, 赵伟.聚乙二醇干扰素对普通干扰素治疗失败慢性乙型肝炎病人的疗效[J].江苏医药, 2012, 38(23):2864. [11] LI MH, ZHANG L, QU XJ, et al.Kinetics of hepatitis B surface antigen level in chronic hepatitis B patients who achieved hepatitis B surface antigen loss during pegylated interferon α-2a treatment[J].Chin Med J (Engl), 2017, 130(5):559. doi: 10.4103/0366-6999.200554 [12] SETO WK, LAM YF, FUNG J, et al.Changes of HBsAg and HBV DNA levels in Chinese chronic hepatitis B patients after 5 years of entecavir treatment[J].J Gastroenterol Hepatol, 2014, 29(5):1028. doi: 10.1111/jgh.12476 [13] QIU YW, HUANG LH, YANG WL, et al.Hepatitis B surface antigen quantification at hepatitis B e antigen seroconversion predicts virological relapse after the cessation of entecavir treatment in hepatitis B e antigen-positive patients[J].Int J Infect Dis, 2016, 43:43. doi: 10.1016/j.ijid.2015.10.019 [14] LIANG Y, JIANG J, SU M, et al.Predictors of relapse in chronic hepatitis B after discontinuation of antiviral therapy[J].Aliment Pharmacol Ther, 2011, 34(3):344. doi: 10.1111/apt.2011.34.issue-3 -




 下载:
下载: