-
胃癌是临床上常见疾病之一,发病率与致死率均为恶性肿瘤前列[1]。目前胃癌的发病机制尚未完全清晰,但普遍观点认为,胃癌的发生、发展是一个漫长而又不断进展的过程,其生物学行为亦较为复杂[2]。有学者[3]提出,肿瘤的部位、浸润程度、分化、生长方式以及淋巴结转移的范围相互联系而又相互作用,并影响病人的预后。现已证实,生长因子与生长因子所携带的细胞外刺激信号通过酪氨酸激酶2/信号转导和转录激活因子3(janus kinase 2/signal transducer and activator of transcription 3,JAK2/STAT3)信号通路传入细胞核内,从而调控肿瘤的发生、发展[4-5]。本研究旨在探究JAK2/STAT3信号通路对胃癌微血管生成的影响。现作报道。
-
选择2016年5月至2017年5月蚌埠医学院第一附属医院收治的非贲门部行限期胃癌根治术的病人30例为研究对象,其中男19例,女11例,年龄27~81岁。纳入标准:病人经术前胃镜检查和术后病理检查,确诊为胃癌;签署知情同意书;术前未接受过放化疗方案治疗。排除标准:就诊前1个月内多次使用糖皮质激素史;除胃癌外还合并其他系统肿瘤或者有血液病;已被确诊有家族性腺瘤病史或结肠癌史。病人均知情同意本研究,一般资料完整,同时经医院伦理委员会批准。
-
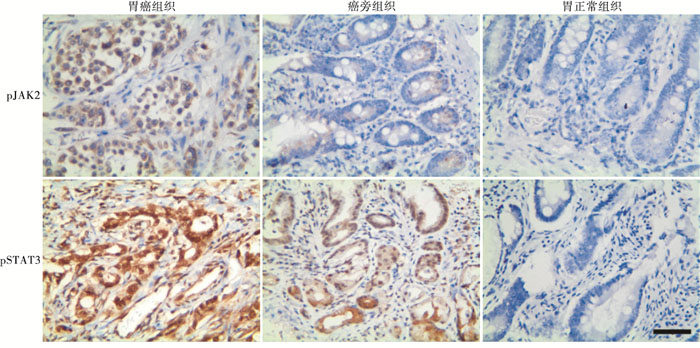
收集病人手术病理组织、正常组织以及癌旁组织。所有标本切片脱蜡后皆行免疫组化染色,烤箱过夜烤干树脂后,置于显微镜下(×400)观察。随机选取5个视野,以Cappuzzo评分标准进行判定,观察阳性细胞的比例与阳性着色强度,前者范围为0~100%,后者按照颜色分为5个等级,无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,棕黑色为4分。两项相乘,若其结果为0~200,则判定结果为阴性,若为201~400,则判定结果为阳性。
-
在胃癌细胞株SGC7901中分别过表达和抑制内源性JAK2蛋白或STAT3蛋白表达,正常培养或血清饥饿实验处理后,采用激光共聚焦显微镜观察mRFP-GFP-LC3转染靶细胞后细胞自噬体的产生[6];采用Brdu法检测胃癌细胞增殖能力[7]。
-
在胃癌细胞株SGC7901中分别过表达和抑制内源性自噬蛋白(Beclin-1、LC3)的表达,用ELISA法检测上述自噬蛋白对MMP2和MMP9的影响;利用ELISA法检测血管内皮生长因子(vascular endothelial growth factor, VEGF)和血小板衍化生长因子(platelet-derived growth factor, PDGF)的变化。
-
在胃癌细胞株SGC7901中建立稳定抑制内源性JAK2、STAT3表达的细胞株SGC7901-siJAK2以及SGC7901-siSTAT3,ELISA法对处理后的胃癌细胞株中JAK2、STAT3、VEGF、PDGF进行检测。
-
采用t检验。
-
免疫组织化学结果显示:胃癌组织中pJAK2、pSTAT3的表达均高于癌旁组织,且两者均高于正常组织(见图 1)。
-
过表达JAK2/STAT3信号通路后的胃癌株的细胞自噬能力、细胞活力均明显优于抑制JAK2/STAT3信号通路后的胃癌株(P < 0.01)(见表 1)。
分组 n 自噬能力 细胞活力 过表达组 30 0.923±0.234 2.123±0.234 抑制组 30 0.242±0.023 1.232±0.231 t — 15.86 14.84 P — <0.01 <0.01 表 1 JAK2/STAT3信号通路对细胞自噬以及细胞活力的影响(x±s)
-
过表达自噬蛋白Beclin-1后胃癌细胞分泌MMP2、MMP9的水平明显高于抑制组(P<0.01),与此同时VEGF、PDGF表达水平亦明显高于抑制组(P<0.01);而过表达自噬蛋白LC3后MMP2、MMP9与抑制组差异无统计学意义(P>0.05),同时,2组VEGF、PDGF表达水平差异无统计学意义(P>0.05)(见表 2)。
分组 n Beclin-1 LC3 MMP2 MMP9 VEGF PDGF MMP2 MMP9 VEGF PDGF 过表达组 30 12.23±2.23 14.34±2.23 18.23±2.34 4.23±0.23 9.25±2.28 11.34±2.56 9.26±2.34 2.27±0.46 抑制组 30 9.23±2.34 10.34±2.33 8.23±3.23 2.12±0.23 9.28±2.36 10.33±2.35 8.26±3.28 2.46±0.57 t — 5.08 6.79 13.73 35.53 0.05 1.59 1.36 1.42 P — <0.01 <0.01 <0.01 <0.01 >0.05 >0.05 >0.05 >0.05 表 2 自噬蛋白对胃癌细胞分泌MMP2、MMP9以及血管生成影响的研究(x±s;pg/mL)
-
JAK2信号通路抑制剂AG490作用于胃癌细胞株细胞后48 h,细胞中JAK2和STAT3蛋白表达量无明显变化(P>0.05),但其活化形式pJAK2和pSTAT3蛋白明显下降(P<0.01)。ELISA结果显示,AG490作用48 h后,人胃癌细胞表达的VEGF和PDGF水平亦明显下降(P<0.01)(见表 3)。
分组 JAK2 STAT3 pJAK2 pSTAT3 VEGF PDGF 对照组 1.02±0.33 1.12±0.23 1.45±0.35 1.36±0.34 210.34±62.34 160.45±54.34 实验组 1.14±0.32 1.20±0.21 0.91±0.54 0.81±0.32 170.33±53.23 120.34±30.45 t 1.43 1.41 4.06 6.45 2.67 3.53 P >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 表 3 AG490对胃癌细胞株的抑制作用(x±s;ni=30)
-
胃癌是临床上常见的癌症之一,主要是由胃黏膜上皮与腺上皮发生的恶性肿瘤,在我国恶性肿瘤中发病率占第一位或者第二位[8]。胃癌的发病年龄常在40~60岁,男性发病率多于女性,常见发病位置为胃窦部小弯侧。目前为止,关于胃癌的发病原因尚未完全阐明,现认为其与饮食、环境相关,具有地理分布特点。统计学[9-10]表明,日本、智利、哥伦比亚、匈牙利以及中国某些西部地区的胃癌发病率远远高于美国或西欧。我国胃癌平均年死亡率约16/10万[11]。目前来讲,治疗胃癌的主要方法为手术、放疗以及化疗,然而其治疗与预后效果皆不理想。胃癌的复发与转移是“种子”(胃癌细胞)和“土壤”(微环境)相互作用的结果。而细胞自噬和微血管生成是胃癌细胞为了适应微环境改变而表现出来的适应性反应;在此过程中,JAK2/STAT3信号通路作为一个重要的信号通路参与其中,但确切机制尚不完全清楚[12-13]。
本研究结果显示,胃癌组织中pJAK2、pSTAT3的表达皆高于癌旁组织,且两者皆高于正常组织;过表达JAK2/STAT3信号通路后的胃癌株SGC7901细胞自噬能力、细胞活力皆明显优于抑制JAK2/STAT3信号通路后的胃癌株。STAT3的激活过程如下:细胞外的细胞因子可以与细胞膜上的受体相结合,从而使JAR激酶激活,STAT3蛋白单体在细胞质中聚集并磷酸化成p-STAT3[14]。通过SH2结构域,游离的p-STAT3形成二聚体并在短时间内进入细胞核,在转录调节因子作用下,二聚体与DNA上启动子位点结合,进而调控信号通路下游靶基因的相关表达[15];随后在胞核内p-STAT3通过酪氨酸磷酸酶和/或蛋白降解作用去磷酸化,最终信号传导终止。正常组织中STAT3激活需要数分钟至数小时;但是在恶性肿瘤中,由于生长信号持续作用,从而导致STAT3持续处于活化状态。在恶性肿瘤生长、侵袭、转移和凋亡的过程中,JAK2/STAT3信号通路调节与之相关的多种细胞因子,如Survivin、Cyclin D1和VEGF等[16]。这些细胞因子对于恶性肿瘤的生长、侵袭、转移和凋亡过程具有重要的理论和现实意义[17]。过表达自噬蛋白Beclin-1后胃癌细胞分泌MMP2、MMP9的水平明显高于抑制组,与此同时VEGF、PDGF表达水平亦高于抑制组;而过表达自噬蛋白LC3后MMP2、MMP9、VEGF、PDGF表达水平均无明显差异。MMP是一种由肿瘤细胞或组织细胞分泌及合成的蛋白水解酶,在肿瘤的转移和侵蚀过程中有重要的促进作用,MMP-2通过破坏病人的小血管和淋巴管的基底膜,对肿瘤包绕的基质屏障进行突破,从而对肿瘤的转移和侵蚀起到加速的作用,而MMP-9可以加强降解病人的肿瘤细胞间质[18]。VEGF是促进血管生长因子里面作用最强的,和其受体VEGFR1和VEGFR2组合之后能够迅速的加快新生的血管生长[19-20]。除此之外,JAK2信号通路抑制剂AG490作用于胃癌细胞株细胞后48 h,细胞中JAK2和STAT3蛋白表达量无明显变化,但其活化形式pJAK2和pSTAT3蛋白下降趋势明显。RT-PCR结果显示,AG490作用48 h后,人胃癌细胞表达的VEGF和PDGF水平亦有所下降(P<0.05)。表明JAK2/STAT3信号通路可调控胃癌微血管形成,因而对此信号通路进行抑制,有望成为胃癌治疗的新途径。
综上所述,JAK2/STAT3信号通路可通过调控细胞自噬进而影响胃癌病人微血管生成能力,这有可能是通过激活Beclin-1而提高VEGF、PDGF表达水平而实现的。
JAK2/STAT3信号通路对胃癌血管生成的影响
Effect of JAK2/STAT3 signaling pathway on the angiogenesis of gastric cancer
-
摘要:
目的探讨酪氨酸激酶2/信号转导和转录激活因子3(JAK2/STAT3)信号通路对胃癌血管生成的影响。 方法选择胃癌根治术病人30例,收集胃癌组织、癌旁组织以及正常组织,体外检测JAK2/STAT3信号通路对细胞自噬以及细胞活力的影响,以及自噬蛋白对胃癌细胞分泌血管生成因子的影响。 结果胃癌组织中pJAK2、pSTAT3表达水平高于癌旁组织及正常组织;加入JAK2/STAT3信号通路阻滞剂后,胃癌细胞自噬能力、细胞活力明显减弱(P < 0.01);过表达自噬蛋白Beclin-1后胃癌细胞分泌血管内皮生长因子(VEGF)和血小板衍化生长因子(PDGF)水平明显高于抑制组(P < 0.01);而过表达自噬蛋白LC3后,VEGF、PDGF水平与抑制组差异无统计学意义(P>0.05)。 结论JAK2/STAT3信号通路通过调控细胞自噬影响胃癌微血管生成能力,可能是通过激活Beclin-1提高VEGF、PDGF的表达水平。 -
关键词:
- 胃肿瘤 /
- 血管生成 /
- 酪氨酸激酶2/信号转导和转录激活因子3 /
- 信号通路 /
- 细胞自噬
Abstract:ObjectiveTo investigate the effects of JAK2/STAT3 signaling pathway on the angiogenesis of gastric cancer. MethodsThe gastric cancer tissue, pericarcinomatous tissue and normal tissue from 30 patients treated with radical gastrectomy were collected.The effects of JAK2/STAT3 signaling pathway on autophagy and cell viability, and effects of autophagy proteins on the secretion of angiogenic factors in gastric cancer cells were investigated in vitro. ResultsThe expression levels of pJAK2 and pSTAT3 in gastric cancer tissue were higher than those in pericarcinomatous tissue and normal tissue.The autophagy abilities and cell viabilities of gastric cancer cells significantly decreased after the JAK2/STAT3 signaling pathway was inhibited(P < 0.01).After Beclin-1 was overexpressed, the expression levels of VEGF and PDGF secreted by gastric cancer cells were significantly higher than those in inhibition group(P < 0.01).After the autophagy protein LC3 was overexpressed, the expression levels of VEGF and PDGF between two groups were not statistically significant(P>0.05). ConclusionsJAK2/STAT3 signaling pathway can affect the microangiogenic ability of gastric cancer cells by regulating the autophagy ability, which maybe increase the expression levels of VEGF and PDGF by activating beclin-1. -
Key words:
- gastric neoplasms /
- angiogenesis /
- JAK2/STAT3 /
- signaling pathway /
- autophagy
-
表 1 JAK2/STAT3信号通路对细胞自噬以及细胞活力的影响(x±s)
分组 n 自噬能力 细胞活力 过表达组 30 0.923±0.234 2.123±0.234 抑制组 30 0.242±0.023 1.232±0.231 t — 15.86 14.84 P — <0.01 <0.01 表 2 自噬蛋白对胃癌细胞分泌MMP2、MMP9以及血管生成影响的研究(x±s;pg/mL)
分组 n Beclin-1 LC3 MMP2 MMP9 VEGF PDGF MMP2 MMP9 VEGF PDGF 过表达组 30 12.23±2.23 14.34±2.23 18.23±2.34 4.23±0.23 9.25±2.28 11.34±2.56 9.26±2.34 2.27±0.46 抑制组 30 9.23±2.34 10.34±2.33 8.23±3.23 2.12±0.23 9.28±2.36 10.33±2.35 8.26±3.28 2.46±0.57 t — 5.08 6.79 13.73 35.53 0.05 1.59 1.36 1.42 P — <0.01 <0.01 <0.01 <0.01 >0.05 >0.05 >0.05 >0.05 表 3 AG490对胃癌细胞株的抑制作用(x±s;ni=30)
分组 JAK2 STAT3 pJAK2 pSTAT3 VEGF PDGF 对照组 1.02±0.33 1.12±0.23 1.45±0.35 1.36±0.34 210.34±62.34 160.45±54.34 实验组 1.14±0.32 1.20±0.21 0.91±0.54 0.81±0.32 170.33±53.23 120.34±30.45 t 1.43 1.41 4.06 6.45 2.67 3.53 P >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 -
[1] 赵冀安, 聂文佳, 李卫, 等.β干扰素联合全反式维甲酸通过抑制JAK2/STAT3信号通路抑制HepG2人肝癌细胞增殖并促进其凋亡[J].细胞与分子免疫学杂志, 2016, 32(7):901. [2] 刘翠颖, 谢昌利, 林艳, 等.IL-12通过AKT/mTOR/STAT3信号通路诱导肝癌细胞自噬[J].细胞与分子免疫学杂志, 2016, 32(7):870. [3] 赵博, 冷燕, 吴晓静, 等.JAK2/STAT3信号通路在糖尿病大鼠心肌缺血再灌注诱发脑损伤中的作用[J].中华麻醉学杂志, 2016, 36(2):211. doi: 10.3760/cma.j.issn.0254-1416.2016.02.023 [4] 张志鑫, 李彦杰, 秦合伟, 等.基于PI3K/Akt/mTOR信号通路调控巨噬细胞自噬探讨黄芪甲苷抗动脉粥样硬化的作用机制[J].中草药, 2017, 48(17):3575. doi: 10.7501/j.issn.0253-2670.2017.17.019 [5] WANG X, CHEN L, LIU J, et al.In vivo treatment of rat arterial adventitia with interleukin?1β induces intimal proliferation via the JAK2/STAT3 signaling pathway[J].Mol Med Rep, 2016, 13(4):3451. doi: 10.3892/mmr.2016.4982 [6] 俞发荣, 陈望军, 雷中坚, 等.不饱和脂肪酸对人胃癌细胞蛋白激酶B信号通路的调控作用[J].中国临床药理学杂志, 2017, 33(10):897. [7] 李凤萍, 杨孟雪, 李显文, 等.2型糖尿病大血管病变患者血清诱导的人脐静脉内皮细胞中JAK2/STAT3信号通路的表达[J].第二军医大学学报, 2016, 37(4):452. [8] KIM B, KIM HS, KIM S, et al.Adipose stromal cells from visceral and subcutaneous fat facilitate migration of ovarian cancer cells via IL-6/JAK2/STAT3 pathway[J].Cancer Res Treat, 2017, 49(2):338. doi: 10.4143/crt.2016.175 [9] 赵冀安, 刘文聪, 孙会凤, 等.JAK2/STAT3信号通路在肝细胞性肝癌中表达及意义[J].中国普通外科杂志, 2016, 25(1):83. [10] 陈健芳, 陈景福, 陈巍, 等.血管紧张素(1-7)通过抑制JAK/STAT信号通路对抗高糖诱导的人脐静脉内皮细胞损伤[J].中国病理生理杂志, 2017, 33(3):481. doi: 10.3969/j.issn.1000-4718.2017.03.016 [11] 张海云, 常香荣.黄芪甲苷通过抑制JAK2/STAT3信号通路减轻重症急性胰腺炎大鼠肝损伤[J].中国病理生理杂志, 2016, 32(6):984. doi: 10.3969/j.issn.1000-4718.2016.06.004 [12] JO HA, KIM JY, YANG SH, et al.The role of local IL6/JAK2/STAT3 signaling in high glucose-induced podocyte hypertrophy[J].Kidney Res Clin Pract, 2016, 35(4):212. doi: 10.1016/j.krcp.2016.09.003 [13] 吴景华, 郭佳培, 王志刚, 等.IL-6-JAK2/STAT3信号途径在骨质疏松症的作用机制研究[J].现代预防医学, 2016, 43(14):2621. [14] 贾莉莉, 鲍永娟, 王菲, 等.异丙酚对肝移植术大鼠海马JAK2/STAT3信号通路的影响[J].中华麻醉学杂志, 2016, 36(6):720. doi: 10.3760/cma.j.issn.0254-1416.2016.06.019 [15] 席进, 葛思堂, 左芦根, 等.绿茶多酚抑制肠道JAK2/STAT3信号通路保护三硝基苯磺酸诱导的小鼠结肠炎肠黏膜屏障[J].细胞与分子免疫学杂志, 2018, 45(3):243. [16] 刘焱伟, 薛锐, 夏中元, 等.第10号染色体丢失性磷酸酶及张力蛋白同源基因调控的酪氨酸蛋白激酶2/信号传导与转录因子3信号通路对糖尿病心肌缺血后处理敏感性的作用[J].中国糖尿病杂志, 2017, 9(8):515. [17] YANG C, ZHANG W, WANG L, et al.Musashi-2 promotes migration and invasion in bladder cancer via activation of the JAK2/STAT3 pathway[J].Lab Invest, 2016, 96(9):950. doi: 10.1038/labinvest.2016.71 [18] 李凯, 刘杰.胃癌组织中CXCR3表达与微血管形成的关系及其临床意义[J].临床与实验病理学杂志, 2016, 32(10):1097. [19] 廖静秋, 林佳琼, 张伟杰, 等.JAK/STAT信号通路在高糖诱导人脐静脉内皮细胞损伤中的作用[J].中国病理生理杂志, 2016, 32(3):392. doi: 10.3969/j.issn.1000-4718.2016.03.002 [20] LUO JY, FU D, WU YQ, et al.Inhibition of the JAK2/STAT3/SOSC1 signaling pathway improves secretion function of vascular endothelial cells in a rat model of pregnancy-induced hypertension[J].Cell Physiol Biochem, 2016, 40(3/4):527. -




 下载:
下载: