-
肝癌发病隐匿、发展迅速、恶性程度高, 术后易复发和转移,5年生存率低,且近些年的发病率和死亡率明显上升[1]。肝癌是一个多基因参与、多因素作用和多阶段发病的疾病,其发生发展机制尚未明确[2]。有研究[3-4]发现,抑癌基因、癌基因、信号通路等参与了肿瘤形成,如RTEN基因、p53基因、Wnt信号通路等。因此,研究引起肝癌发生发展的分子机制对于其诊疗尤为重要。SOX7是含高迁移率族蛋白(HMG)结构域的SOX家族成员之一,可与β-catenin竞争结合TCF/LEF,从而抑制Wnt/β-catenin信号通路激活[5]。有研究[6-7]报道,肝癌、肺癌等多种肿瘤中SOX7呈现低表达,其表达与肿瘤进展明显相关。miR-935可通过靶向抑制SOX7促进肝癌细胞增殖和迁移[8];miR-184可靶向抑制SOX7促进肝癌细胞增殖,加速细胞周期进程[9]。关于SOX7对肝癌细胞凋亡影响及机制尚未明确。因此,本研究将pcDNA3.1-SOX7重组质粒转染人肝癌细胞,旨在观察过表达SOX7对肝癌细胞凋亡影响,并进一步研究其对细胞活性氧(ROS)水平及Wnt/β-catenin信号通路影响, 以期为肝癌治疗提供理论基础。
-
人肝癌Huh-7细胞购自中国科学院上海细胞研究所;DMEM培养基购自美国Gibco;FBS购自杭州四季青;MTT、DMSO均购自美国Sigma;流式细胞仪和Annexin V-FITC/PI双染法细胞凋亡试剂盒均购自美国BD;SOX7、β-catenin、cyclin D1和cleaved-caspase 3抗体及HRP标记的二抗均购自美国Abcam;酶标仪购自美国Thermo。
-
Huh-7细胞在含10% FBS的DMEM培养基中,于37 ℃、5%CO2培养箱中常规传代培养。细胞分为空白组、空质粒pcDNA3.1组(Vector组)和pcDNA3.1-SOX7重组质粒组(pcDNA3.1-SOX7组)。
-
依据GeneBank中提供的SOX7基因CDS序列(NM-031439),委托上海生工生物工程有限公司设计合成pcDNA3.1-SOX7重组质粒。参照lipofectamineTM2000说明书进行转染。转染前24 h,将生长至对数期的Huh-7细胞接种于6孔板,每孔2 mL(约3×105个细胞),于37 ℃、5%CO2培养箱中培养,使转染时细胞达50%~60%的生长融合度。制备pcDNA3.1与lipofectamineTM 2000混合物,将混合物加入6孔板各分组相应的孔内,常规孵育6 h后,换为含血清的培养基,继续培养48 h,用于后续实验研究。
-
以每孔200 μL细胞悬液(约5×103个细胞)接种生长至对数期的Huh-7细胞于96孔板,常规孵育24 h后,将pcDNA3.1转染细胞,并设置未转染的细胞作为空白组,分别于转染的24、48和72 h,每孔细胞中加10 μL MTT溶液(5 mg/mL),于培养箱中继续孵育4 h,将上清液吸弃,每孔加DMSO溶液150 μL,摇床上低速振荡10 min,以使结晶能够溶解充分。490 nm波长,酶标仪测定各孔的吸光度值(A)。每组设置5个复孔,实验重复3次。
-
pcDNA3.1-SOX7重组质粒转染Huh-7细胞48 h,预冷PBS洗涤细胞,500 μL 1×binding buffer重悬细胞。计算比例取出1×105个细胞,加10 μL Annexin V-FITC,混匀,再加入5 μL PI,混匀,暗室室温避光反应15~20 min,上机前再加入1×binding buffer 200 μL,流式细胞仪检测各组细胞凋亡情况(1 h内)。实验重复3次。
-
pcDNA3.1-SOX7重组质粒转染Huh-7细胞48 h,收集细胞,更换为含10 μmol/L DCFH-DA的DMEM培养液,于37 ℃孵育20 min,弃掉培养液,无血清培养液洗涤细胞3次,镜下观察。同时收获细胞,并将细胞浓度调整为1×106/mL,流式细胞仪检测各组的荧光强度。激发波长488 nm,发射波长525 nm。实验重复3次。
-
pcDNA3.1-SOX7重组质粒转染Huh-7细胞48 h,收集细胞,加适量RIPA裂解液提取细胞总蛋白,BCA法测定总蛋白浓度。SDS-PAGE后湿转PVDF膜,膜用5%脱脂奶粉封闭1 h,TBST洗膜,加一抗稀释液(SOX7、β-catenin、cyclin D1和cleaved-caspase 3抗体,均为1:1 000稀释),4 ℃冰箱孵育过夜,TBST洗膜,加HRP标记的二抗稀释液(1:3 000稀释),室温孵育1 h,在膜上滴加ECL显色液,在暗盒中使用X光胶片曝光。拍照。Image J图像分析软件分析各条带的灰度值。实验重复3次。
-
采用方差分析和q检验。
-
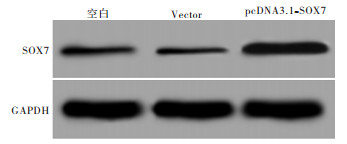
pcDNA3.1-SOX7重组质粒转染Huh-7细胞48 h,Western blotting检测结果显示,pcDNA3.1-SOX7组SOX7表达明显高于空白组(P < 0.05),Vector组SOX7表达与空白组差异无统计学意义(P>0.05)(见图 1、表 1)。
分组 SOX7蛋白相对表达量 空白组 0.072±0.008 Vector组 0.065±0.007 pcDNA3.1-SOX7组 0.572±0.042* F 405.25 P < 0.01 MS组内 0.001 与空白组比较*P < 0.05 表 1 pcDNA3.1-SOX7重组质粒转染Huh-7细胞后SOX7蛋白表达情况(x±s)
-
pcDNA3.1-SOX7重组质粒转染Huh-7细胞24、48和72 h,MTT检测结果显示,与空白组比较,pcDNA3.1-SOX7组在3个时间点的细胞活力均明显降低(P < 0.05)(见表 2)。
分组 24 h 48 h 72 h 空白组 0.488±0.045 0.712±0.059 0.978±0.072 Vector组 0.501±0.042 0.687±0.051 0.954±0.078 pcDNA3.1-SOX7组 0.311±0.028* 0.502±0.043* 0.697±0.056* F 22.17 14.93 15.16 P < 0.01 < 0.01 < 0.01 MS组内 0.002 0.003 0.005 与空白组比较*P < 0.05 表 2 过表达SOX7对Huh-7细胞活力的影响(x±s)
-
pcDNA3.1-SOX7重组质粒转染Huh-7细胞48 h,Annexin V-FITC/PI双染法检测细胞凋亡结果显示,与空白组比较,pcDNA3.1-SOX7组细胞凋亡率及ROS含量均明显升高(P < 0.05)(见图 2、表 3)。
分组 凋亡率/% 荧光强度 空白组 4.15±0.46 51.25±5.06 Vector组 4.26±0.51 52.88±5.39 pcDNA3.1-SOX7组 25.54±1.62* 114.9±8.42* F 441.06 94.39 P < 0.01 < 0.01 MS组内 1.032 41.851 与空白组比较*P < 0.05 表 3 过表达SOX7对Huh-7细胞凋亡的影响(x±s)
-
Western blotting检测各组细胞β-catenin、cyclin D1和cleaved-caspase 3蛋白表达,与空白组比较,pcDNA3.1-SOX7组β-catenin和cyclin D1明显降低,cleaved-caspase 3表达明显升高(P < 0.05)(见图 3、表 4)。
分组 β-catenin cyclin D1 cleaved-caspase 3 空白组 0.815±0.069 0.271±0.032 0.026±0.004 Vector组 0.832±0.072 0.294±0.035 0.030±0.005 pcDNA3.1-SOX7组 0.356±0.039* 0.150±0.018* 0.104±0.010* F 57.24 20.93 123.15 P < 0.01 < 0.01 < 0.01 MS组内 0.004 0.001 0.001 与空白组比较*P < 0.05 表 4 β-catenin、cyclin D1和cleaved-caspase 3的蛋白相对表达量情况(x±s)
-
Wnt/β-catenin信号通路是Wnt信号通路中的经典信号途径,在进化上高度保守,参与调节多种人类疾病,特别是肿瘤的发生发展及预后[10]。Wnt/β-catenin信号通路的异常活化可引起肿瘤发生。β-catenin是Wnt/β-catenin信号的关键分子,入核后可结合于TCF/LEF,从而激活cyclin D1、c-myc等下游与肿瘤发生发展相关的靶基因,从而促进肿瘤进展[11]。近些年来,关于高迁移率族蛋白结构域SOX家族基因与肿瘤发生发展关系已成为研究热点。SOX7是Wnt/β-catenin信号的关键负性调控因子,发挥抑癌基因样作用[12]。有研究[13]显示,SOX7质粒转染脑胶质瘤细胞后,细胞增殖明显被抑制,Wnt/β-catenin信号转录水平降低,且下游靶基因cyclin D1和c-myc的表达降低,而抑制SOX7表达后不能引起上述现象。因此认为,SOX7可通过将自身HGM-box结构域与β-catenin结合,抑制β-catenin表达,从而降低β-catenin介导的细胞增殖活性,扮演着抑癌基因作用。此外,在胃癌、子宫内膜癌等多种肿瘤中也有类似的报道[14-15]。过表达SOX7是否可诱导肝癌细胞凋亡还未明确。本研究结果显示,过表达SOX7组肝癌Huh-7细胞在24 h、48 h和72 h的细胞活力均明显低于空白组,细胞凋亡率高于空白组,β-catenin和cyclin D1蛋白表达低于空白组,这与在其他肿瘤研究结果一致。
肿瘤细胞增殖和凋亡不平衡是其发生发展的重要环节。caspase 3是可介导细胞凋亡的一类蛋白水解酶,是caspase家族中的关键效应酶,也是凋亡的执行者,其活化可使凋亡不可逆[16]。研究[17]显示,人正常组织及多种肿瘤组织中caspase 3广泛表达。caspase 3蛋白酶激活与肝癌凋亡密切相关[18]。多种肿瘤中Wnt/β-catenin信号功能亢进,可通过抑制caspase 3表达,进而使癌细胞增殖凋亡失衡[19]。本研究结果发现,过表达SOX7组Huh-7细胞剪切后的caspase 3表达明显高于空白组。ROS包括过氧化氢、羟自由基、脂过氧化自由基等,目前研究[20]显示ROS与细胞生长抑制、细胞凋亡间有密切关系,ROS水平变化可引起与肿瘤增殖凋亡有关的NF-κB、Wnt等信号通路变化,活化caspase 3,从而引起肿瘤细胞凋亡[20]。目前诱导ROS产生已作为引起细胞凋亡的机制之一。有研究[21]表明,ROS可诱导肝癌细胞凋亡。本研究结果显示,过表达SOX7组细胞ROS水平明显高于空白组。提示提高ROS水平可能是SOX7诱导肝癌细胞凋亡途径之一。
综上所述,本研究将重组体pcDNA3.1-SOX7转染人肝癌Huh-7细胞,通过MTT法、流式细胞术、DCFH-DA法及Western blotting分别检测过表达SOX7对Huh-7细胞活力、凋亡、ROS水平及Wnt/β-catenin信号通路β-catenin、cyclin D1和凋亡相关的cleaved-caspase 3蛋白表达的影响。发现过表达SOX7可明显抑制Huh-7细胞活力,诱导细胞凋亡,机制可能与提高细胞ROS水平及抑制Wnt/β-catenin信号通路有关。提示SOX7可能是肝癌诊疗的靶点之一,值得进一步深入探究。
SOX7基因对肝癌细胞凋亡、氧化应激及Wnt/β-catenin信号通路的影响
Effect of SOX7 gene on the apoptosis, oxidative stress and Wnt/β-catenin signaling pathway in liver cancer cells
-
摘要:
目的探讨过表达SOX7对肝癌细胞凋亡、活性氧(ROS)水平及Wnt/β-catenin信号通路的影响。 方法人肝癌Huh-7细胞分为空白组、空质粒pcDNA3.1组(Vector组)和pcDNA3.1-SOX7重组质粒组(pcDNA3.1-SOX7组)。转染48 h,Annexin V-FITC/PI双染法细胞凋亡试剂盒、DCFH-DA法及Western blotting分别检测细胞凋亡率、ROS含量及SOX7、β-catenin、cyclin D1和cleaved-caspase 3蛋白表达。MTT法检测pcDNA3.1转染24 h、48 h和72 h的细胞活力。 结果pcDNA3.1-SOX7重组质粒组SOX7蛋白表达明显高于空白组(P < 0.05)。与空白组比较,pcDNA3.1-SOX7组细胞活力及β-catenin和cyclin D1蛋白表达均明显降低,细胞凋亡率、ROS含量及cleaved-caspase 3蛋白表达明显升高(P < 0.05)。 结论过表达SOX7可诱导肝癌细胞凋亡,凋亡机制与细胞内ROS水平提高及Wnt/β-catenin信号通路抑制有关。 -
关键词:
- 肝肿瘤 /
- SOX7基因 /
- 氧化应激 /
- Wnt/β-catenin信号通路 /
- 细胞凋亡
Abstract:ObjectiveTo investigate the effects of overexpression of SOX7 gene on apoptosis, ractive oxygen species (ROS) level and Wnt/β-catenin signaling pathway in hepatocellular carcinoma (HCC) cells. MethodsThe human hepatoma Huh-7 cells were divided into the blank group, blank plasmid pcDNA3.1 group (vector group) and pcDNA3.1-SOX7 recombinant plasmid group (pcDNA3.1-SOX7 group).The apoptosis rate, ROS content, and expression levels of SOX7, β-catenin, cyclin D1 and cleaved-caspase 3 protein were detected by Annexin V-FITC/PI double staining, DCFH-DA assay and Western blotting at 48 h after transfection, respectively.The cell viability was detected using MTT assay after 24 h, 48 h and 72 h of pcDNA3.1 transfecting. ResultsThe expression level of SOX7 protein in pcDNA3.1-SOX7 recombinant plasmid group was significantly higher than that in blank group (P < 0.05).Compared with the blank group, the cell viability and expression levels of β-catenin and cyclin D1 protein in pcDNA3.1-SOX7 group significantly decreased, while the apoptosis rate, ROS content and cleaved-caspase 3 protein expression level significantly increased (P < 0.05). ConclusionsThe overexpression of SOX7 can induce the apoptosis of HCC cells.The mechanism of apoptosis is related to the increasing of ROS level and inhibition of Wnt/β-catenin signaling pathway. -
Key words:
- liver neoplasms /
- SOX7 gene /
- oxidative stress /
- Wnt/β-catenin signaling pathway /
- cells apoptosis
-
表 1 pcDNA3.1-SOX7重组质粒转染Huh-7细胞后SOX7蛋白表达情况(x±s)
分组 SOX7蛋白相对表达量 空白组 0.072±0.008 Vector组 0.065±0.007 pcDNA3.1-SOX7组 0.572±0.042* F 405.25 P < 0.01 MS组内 0.001 与空白组比较*P < 0.05 表 2 过表达SOX7对Huh-7细胞活力的影响(x±s)
分组 24 h 48 h 72 h 空白组 0.488±0.045 0.712±0.059 0.978±0.072 Vector组 0.501±0.042 0.687±0.051 0.954±0.078 pcDNA3.1-SOX7组 0.311±0.028* 0.502±0.043* 0.697±0.056* F 22.17 14.93 15.16 P < 0.01 < 0.01 < 0.01 MS组内 0.002 0.003 0.005 与空白组比较*P < 0.05 表 3 过表达SOX7对Huh-7细胞凋亡的影响(x±s)
分组 凋亡率/% 荧光强度 空白组 4.15±0.46 51.25±5.06 Vector组 4.26±0.51 52.88±5.39 pcDNA3.1-SOX7组 25.54±1.62* 114.9±8.42* F 441.06 94.39 P < 0.01 < 0.01 MS组内 1.032 41.851 与空白组比较*P < 0.05 表 4 β-catenin、cyclin D1和cleaved-caspase 3的蛋白相对表达量情况(x±s)
分组 β-catenin cyclin D1 cleaved-caspase 3 空白组 0.815±0.069 0.271±0.032 0.026±0.004 Vector组 0.832±0.072 0.294±0.035 0.030±0.005 pcDNA3.1-SOX7组 0.356±0.039* 0.150±0.018* 0.104±0.010* F 57.24 20.93 123.15 P < 0.01 < 0.01 < 0.01 MS组内 0.004 0.001 0.001 与空白组比较*P < 0.05 -
[1] 朱威威, 陈晓龙, 陈建安, 等.α-烯醇化酶在肝癌组织中的表达及临床意义[J].郑州大学学报:医学版, 2018, 53(4):412. [2] FENG X, JIANG J, SHI S, et al.Knockdown of miR-25 increases the sensitivity of liver cancer stem cells to TRAIL-induced apoptosis via PTEN/PI3K/Akt/Bad signaling pathway[J].Int J Oncol, 2016, 49(6):2600. doi: 10.3892/ijo.2016.3751 [3] HONG H, AN JC, DE LA CRUZ JF, et al.Cnidium officinale Makino extract induces apoptosis through activation of caspase-3 and p53 in human liver cancer HepG2 cells[J].Exp Ther Med, 2017, 14(4):3191. doi: 10.3892/etm.2017.4916 [4] 聂金霞, 刘娅, 徐明明.长链非编码RNA PVT1调控miR-551通过Wnt信号通路对卵巢癌迁移和侵袭的影响[J].中国病理生理杂志, 2018, 34(2):232. doi: 10.3969/j.issn.1000-4718.2018.02.007 [5] LI Y, GANG Z, WEN Z, et al.Long noncoding RNA AB073614 promotes the malignance of glioma by activating Wnt/β-catenin signaling through downregulating SOX7[J].Oncotarget, 2017, 8(39):65577. [6] WANG J, ZHANG S, WU J, et al.Clinical significance and prognostic value of SOX7 expression in liver and pancreatic carcinoma[J].Mol Med Rep, 2017, 16(1):499. [7] LIANG Y, MA J, ZHU Y, et al.miR-24-3p promotes cell migration and proliferation in lung cancer by targeting SOX7[J].J Cell Biochem, 2017, 119(5):3989. [8] LIU X, LI J, YU Z, et al.MiR-935 promotes liver cancer cell proliferation and migration by targeting SOX7[J].Oncol Res, 2017, 25(3):427. [9] WU GG, LI WH, HE WG, et al.miR-184 post-transcriptionally regulates SOX7 expression and promotes cell proliferation in human hepatocellular carcinoma[J].PLoS One, 2014, 9(2):e88796. doi: 10.1371/journal.pone.0088796 [10] 陆周一, 陈晓峰.WNT/β-catenin信号通路与miRNA在原发性肺癌中的研究进展[J].中国癌症杂志, 2017, 27(2):151. [11] GUO D, DI Z, WANG Q, et al.Baicalein inhibits progression of osteosarcoma cells through inactivation of the Wnt/β-catenin signaling pathway[J].Oncotarget, 2017, 8(49):86098. [12] 刘洪羽, 吴再锋, 曾峥, 等.抑癌因子SOX7在乳腺癌中的表达及其与AXIN2表达的相关性[J].国际遗传学杂志, 2017, 40(2):72. doi: 10.3760/cma.j.issn.1673-4386.2017.02.002 [13] ZHAO T, YANG H, YU T, et al.SOX7 is associated with the suppression of human glioma by HMG-box dependent regulation of Wnt/β-catenin signaling[J].Cancer Lett, 2016, 375(1):100. doi: 10.1016/j.canlet.2016.02.044 [14] CUI J, XI H, CAI A, et al.Decreased expression of Sox7 correlates with the upregulation of the Wnt/β-catenin signaling pathway and the poor survival of gastric cancer patients[J].Int J Mol Med, 2014, 34(1):197. doi: 10.3892/ijmm.2014.1759 [15] CHAN DW, MAK CS, LEUNG TH, et al.Down-regulation of Sox7 is associated with aberrant activation of Wnt/β-catenin signaling in endometrial cancer[J].Oncotarget, 2012, 3(12):1546. [16] PU X, STORR SJ, ZHANG Y, et al.Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J].Apoptosis, 2017, 22(3):1. [17] LI S, YANG Y, DING Y, et al.Impacts of survivin and caspase-3 on apoptosis and angiogenesis in oral cancer[J].Oncol Lett, 2017, 14(3):3774. doi: 10.3892/ol.2017.6626 [18] 李先佳, 任丽平, 金少举.马鞭草总黄酮诱导肝癌HepG-2细胞凋亡及可能机制[J].国际药学研究杂志, 2017, 44(8):790. [19] SU N, WANG P, LI Y.Role of Wnt/β-catenin pathway in inducing autophagy and apoptosis in multiple myeloma cells[J].Oncol Lett, 2016, 12(6):4623. doi: 10.3892/ol.2016.5289 [20] KALEEM S, SIDDIQUI S, HUSSAIN A, et al.Eupalitin induces apoptosis in prostate carcinoma cells through ROS generation and increase of caspase-3 activity[J].Cell Biol Int, 2016, 40(2):196. [21] CUSIMANO A, BALASUS D, AZZOLINA A, et al.Oleocanthal exerts antitumor effects on human liver and colon cancer cells through ROS generation[J].Int J Oncol, 2017, 51(2):533. doi: 10.3892/ijo.2017.4049 -





 下载:
下载: