-
放射治疗(放疗)是乳腺癌治疗的重要手段之一,而肿瘤细胞对放射的不敏感性是影响放射治疗的重要因素。随着研究的不断深入,越来越多的证据表明, 乳腺癌细胞中特异或差异性表达的一些微小RNA(microRNAs,miRNAs)在放疗抵抗过程中发挥着重要作用,而干扰或过表达这些miRNAs可逆转肿瘤细胞对放疗的抵抗,增加放疗的敏感性[1-3]。miRNA(miR)-125b与肿瘤进展密切相关miRNA,在细胞增殖、转移、凋亡和耐药等方面发挥着重要作用[4]。miR-125b在乳腺癌等中异常低表达,被证实在乳腺癌的发生发展和放疗过程过程中发挥着积极作用[5-6],但其在肿瘤细胞放射增敏过程中的机制却知之甚少。己糖激酶-2(HK2)是糖酵解过程中的一种关键限速酶,被证实沉默其表达可增强乳腺癌细胞的放疗敏感性[7]。本研究通过生物信息学软件预测发现,HK2可能是miR-125b的潜在靶基因。因此,猜测miR-125b可能通过靶向抑制HK2表达在乳腺癌细胞中发挥放射增敏作用,故设计实验加以验证。本研究以乳腺癌MCF-7细胞为研究对象,通过观察miR-125b和HK2的靶向关系,探讨miR-125b增强乳腺癌MCF-7细胞放射敏感性的分子机制。
-
RPMI1640培养基购于美国Hyclone公司,胎牛血清购于杭州四季青公司,二甲基亚砜、MTT试剂和胰蛋白酶购于美国Sigma公司,LipofectamineTM2000购于美国Invitrogen公司,PVDF膜购于德国Roche公司,兔抗人β-action多克隆抗体购于美国Santa Cuze公司,鼠抗人HK2单克隆抗体购于美国Abcam公司,辣根标记羊抗兔/鼠IgG二抗购于北京博奥森公司。总RNA提取试剂盒购于北京天根生化公司,Bradford蛋白浓度测定试剂盒和SDS-PAGE凝胶配制试剂盒购于上海Beyotime公司,AnnexinV-APC/7-AAD凋亡检测试剂盒购于南京凯基公司,HiFi-MMLV cDNA第一链合成试剂盒购和蛋白抽提试剂盒于北京康为世纪生物公司,Promega双荧光素酶报告基因检测试剂盒购于上海力敏实业公司。miR-125b模拟物及其阴性对照以及HK2真核表达质粒pcDNA3.1-HK2由广州锐博生物公司设计合成。凝胶成像系统购于美国BIO-RAD公司,二氧化碳培养箱购于苏州净化设备制造厂,流式细胞仪购于美国Becton Dickinson公司,医用直线加速器购于美国Varian公司,PCR仪购于德国SensoQuest Lab Cycler公司。
-
采用RPMI1640培养基(含10%胎牛血清)于5%二氧化碳的37 ℃恒温培养箱中常规培养人乳腺癌MCF-7细胞(来自于中科院上海细胞库)。当细胞融合度超过85%时,采用0.25%胰蛋白酶消化传代。实验所有细胞均处于对数生长期。将对数生长期细胞接种至6孔细胞板上,培养至70%~80%汇合度时,参照LipofectamineTM2000说明书将miR-125b模拟物及其阴性对照转染至MCF-7细胞中,并标记为miR-125b组和miR-NC组。转染5 h后更换新鲜培养基,继续培养48 h后收集各组细胞采用RT-PCR检测细胞中miR-125b的表达以评价转染效果。
-
根据总RNA提取试剂盒说明书步骤提取MCF-7细胞的总RNA,并采用核酸浓度检测仪检测RNA的浓度。按照cDNA第一链合成试剂盒说明书步骤将RNA逆转录合成cDNA。由上海生工合成的PCR引物分别为miR-125b正向引物:5′-CGT CCC TGA GAC CCT AAC TTG T-3′,反向引物:5′-GTG CAG GGT CCG AGG T-3′;内参U6正向引物:5′-GCG CGT CGT GAA GCG TTC-3′,反向引物:5′-GTG CAG GGT CCG AGG T-3′;HK2正向引物:5′-AAG GCT TCA AGG CAT CTG-3′,反向引物:5′-CCA CAG GTC ATC ATA GTT CC-3′;内参β-actin正向引物:5′-CTA CAA TGA GCT GCG TGT GG-3′,反向引物:5′-CGT GAG AAG GTC GGA AGG AA-3′。取PCR正反向引物(浓度为10 μmol/L)各2 μL、模板cDNA 2 μL、2×Taq Master Mix 25 μL和RNase-Free Water 18 μL配制成总体积为50 μL的PCR反应体系,上PCR仪按照94 ℃ 2 min(预变性),94 ℃ 30 s(变性)、58 ℃ 30 s(退火)、72 ℃ 30 s(延伸),共38个循环进行PCR扩增。采用2-△△CT法检测miR-125b和HK2 mRNA的表达水平。
-
参照蛋白抽提试剂盒说明书步骤提取MCF-7细胞的总蛋白后,采用Bradford法测定蛋白浓度。将蛋白样品与1/4体积的5×SDS-PAGE蛋白上样缓冲液混匀后置于沸水中煮沸5 min。取变性蛋白,以每孔60 μg上样至SDS-PAGE凝胶中进行电泳。待蛋白充分分离后,结束电泳。采用转膜仪将蛋白样品电转至PVDF膜上。取出PVDF膜,置于含5%脱脂奶粉TBST封闭液中封闭1 h。封闭液洗膜后,加入封闭液稀释的HK2抗体(工作浓度1:500),4 ℃孵育24 h。洗膜后,加入辣根标记羊抗兔/鼠IgG二抗(工作浓度1:1 000)室温下孵育2 h。再次洗膜后,采用化学发光法显影及定影,BIO-RAD成像仪分析。以目的蛋白HK2与内参β-actin条带灰度值的比较表示HK2蛋白的相对表达水平。
-
采用TargetScan预测软件预测HK2 3′UTR与miR-125b存在互补的核苷酸序列。为了验证miR-125b和HK2之间是否存在靶向关系,分别设计合成野生型(HK2-WT)和突变型(HK2-MUT)的HK2 3′UTR荧光素酶报告载体,将其分别与miR-125b模拟物及其阴性对照共转染至MCF-7细胞中,并分别标记为miR-125b+HK2-WT组、miR-125b+HK2-MUT组、miR-NC+HK2-WT组和miR-NC+HK2-MUT组。转染48 h后,采用双荧光素酶报告基因检测试剂盒分别检测各组细胞的荧光素酶活性。
-
将对数生长期MCF-7细胞分为3组:miR-NC组(转染miR-125b模拟物阴性对照)、miR-125b组(转染miR-125b模拟物)和miR-125b+HK2组(转染miR-125b模拟物和pcDNA3.1-HK2质粒)。根据上述分组采用脂质体法转染48 h后,采用6MV-X射线对各组细胞按照200 cGy/min照射剂量率、20 cm×20 cm照射野面积和100 cm固定源皮距进行照射。
-
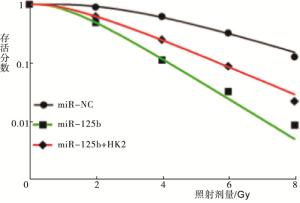
胰蛋白酶消化收集转染48 h后的各组细胞,调整细胞浓度为2×103个/毫升,按照每孔2 mL接种至6孔细胞板上,培养过夜。以0、2、4、6和8 Gy剂量的X射线垂直照射各组细胞,照射结束后,继续培养12 d后终止培养。吸去培养液后,以甲醇固定细胞10 min,姬姆萨染液染色20 min。显微镜下观察,以超过50个细胞集落作为有效克隆,以(克隆数/接种细胞数)×100%表示克隆形成率(PE),并根据公式:存活分数(SF)=克隆数/(PE×接种细胞数)计算各组细胞的存活分数。根据多靶单击模型拟合细胞存活曲线,记录平均致死量(D0)、准阈剂量(Dq)、2Gy剂量下对应的SF值(SF2)和增敏比(SER)放射生物学参数。
-
给予4 Gy剂量X射线照射后,继续培养48 h,胰蛋白酶消化收集各组细胞,调整细胞浓度,使每毫升细胞悬液中含有105个细胞。参照细胞凋亡试剂盒说明书步骤检测各组细胞的凋亡率。
-
采用单因素方差分析、q检验和t检验。
-
RT-PCR检测结果显示,转染miR-125b模拟物后MCF-7细胞中miR-125b的表达水平(4.25±0.16)较miR-NC组(0.96±0.07)显著升高(t=32.63,P<0.01)。
-
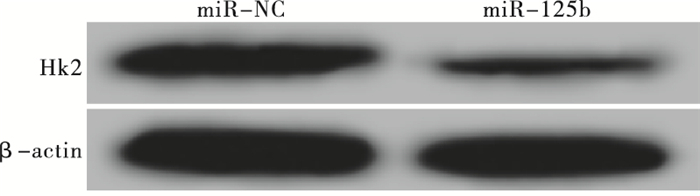
RT-PCR和Western blotting检测结果显示,转染miR-125b模拟物后MCF-7细胞中HK2 mRNA和蛋白的表达水平分别为0.35±0.03和0.27±0.03,较miR-NC组中HK2 mRNA和蛋白的表达水平(1.02±0.09和0.88±0.07)均显著降低(tmRNA=12.23,P<0.01;t蛋白=13.87,P<0.01)(见图 1)。
-
TargetScan生物信息学软件预测结果显示,HK2的3′UTR中存在与miR-125b互补的结合位点,详见表 1。同时,双荧光素酶报告基因实验结果显示,共转染miR-125b模拟物和HK2-WT质粒的MCF-7细胞的荧光素酶活性较共转染miR-NC和HK2-WT质粒的荧光素酶活性显著降低(P<0.01);但与共转染miR-NC和HK2-MUT质粒相比,共转染miR-125b模拟物和HK2-MUT质粒的MCF-7细胞的荧光素酶活性无显著改变(P>0.05)(见表 2)。
基因 互补的核苷酸序列 结合位点 HK2 5′....ACA GCC AAA UAA AAC CUC AGG GA...3′ 1370-1377 of HK2 miR-125b 3′......AGU GUU CAA UCC CAG AGU CCC U......5′ 3′ UTR 表 1 miR-125b与HK2 3′ UTR的结合位点
分组 荧光素酶活性 miR-NC+HK2-WT组 1.12±0.09 miR-125b+HK2-WT组 0.53±0.04** miR-NC+HK2-MUT组 1.08±0.07 miR-125b+HK2-MUT组 0.99±0.06 F 48.84 P <0.01 MS组内 0.005 q检验:与miR-NC + HK2-WT组比较* *P<0.01 表 2 各MCF-7细胞的荧光素酶活性的比较(x±s)
-
RT-PCR检测得到miR-NC组、miR-125b组和miR-125b+HK2组细胞中HK2 mRNA的相对表达量分别为1.00±0.06、0.34±0.02和0.65±0.03,Western blotting检测得出HK2蛋白的相对表达量分别为1.02±0.08、0.27±0.02和0.45±0.03(见图 2);各组细胞间HK2 mRNA和蛋白的表达差异有统计学意义(FmRNA=200.27,P<0.01,MS组内=0.002;F蛋白=179.18,P<0.01,MS组内=0.003);与miR-NC组相比,HK2 mRNA和蛋白的表达水平在miR-125b组细胞中显著降低(P<0.01),而miR-125b+HK2组与miR-125b组相比显著升高(P<0.01)。根据打击多靶模型拟合MCF-7细胞的生存曲线见图 3,各组细胞的放射相关参数见表 2。与miR-NC组相比,miR-125b组细胞的存活分数明显降低(P<0.01),放射增敏比SER为1.44;与miR-125b组相比,miR-125b+HK2组细胞的存活分数明显升高(P<0.01),细胞增敏比为0.69。给予4 Gy剂量X射线照射后,流式细胞仪检测miR-NC组、miR-125b组和miR-125b+HK2组的细胞凋亡率分别为(7.58±0.12)%、(20.64±0.23)%和(13.26±0.13)%;与miR-NC组相比,miR-125b组细胞凋亡率明显升高(t=86.31,P<0.01);而miR-125b+HK2组细胞的凋亡率较miR-125b组显著降低(t=47.91,P<0.01)(见图 4)。
分组 D0/Gy Dq/Gy SF2 SER miR-NC 2.47 3.48 0.91 miR-125b 1.26 1.35 0.49 1.44 miR-125b+HK2 1.82 1.58 0.62 0.69 表 3 各组细胞的放射生物学参数比较
-
miRNAs是一类可通过与靶基因3′UTR区域特异性结合调控靶基因表达的短链非编码RNA,肿瘤细胞中异常表达的miRNAs不仅与细胞的DNA修复、增殖和凋亡等有关,还与细胞的放射敏感性关系密切[8-9]。本研究关注的miR-125b就是一个很好的例子。口腔鳞癌中下调的miR-125b表达与细胞增殖和抗辐射机制有关,上调其表达可增强放射的敏感性[10]。miR-125b在乳腺癌细胞中低表达,而上调其表达可通过靶向KIAA1522抑制癌细胞增殖、侵袭和迁移[5];同时,强制表达miR-125b可通过降低克隆生存率、增强凋亡活性和增强红外线后的衰老等提高放射敏感性[6]。然而,miR-125b在乳腺癌细胞放射致敏中的分子机制并不完全清楚。miRNA可与靶基因形成复杂的调控网络,从而调控细胞的生长,本研究认为miR-125b可能通过调控其靶基因发挥放射增敏作用。
有研究[11-12]证实,miR-125b在骨肉瘤和喉鳞状细胞癌中表达下调,可通过直接靶向调控HK2表达抑制癌细胞的有氧糖酵解过程,进而抑制肿瘤的恶性进展。本研究通过转染miR-125b模拟物上调乳腺癌MCF-7细胞中的miR-125b表达后,检测到HK2从转录和翻译水平上均明显受到抑制;双荧光素酶报告基因实验进一步检测证实miR-125b可与HK2 3′UTR区域结合。这表明HK2是miR-125b的潜在靶基因。
电离辐射使细胞DNA双链断裂进而引起癌细胞死亡的过程是放射治疗的内在机制,而机体细胞自身的DNA修复系统是导致放射不敏感的重要机制;HK2是糖酵解起始过程中的关键限速酶,而糖酵解过程产生的ATP是DNA合成获得能量的重要方式,可见HK2与DNA修复断裂关系密切[13-14]。同时,HK2还是一种与肿瘤发生发展息息相关的致癌基因,在肿瘤细胞增殖、转移、凋亡中发挥着重要作用,并介导肿瘤的治疗耐受。HK2在胰腺导管腺癌中表达上调,敲低其表达通过降低乳酸的产生抑制肿瘤细胞的生长和转移,上调其表达则促进细胞的生长和转移[15];在胶质母细胞瘤中,靶向抑制HK2表达可增强肿瘤细胞的放射化疗反应[16];在HPV16 E7诱导的宫颈癌中,靶向抑制HK2表达可增强肿瘤细胞的放射敏感性,抑制细胞增殖并促进细胞凋亡[17]。已有研究[7, 18]证实,靶向抑制HK2表达可增强乳腺癌细胞的放射敏感性。本研究在上调miR-125b表达后进一步检测发现,X射线照射的MCF-7细胞的存活分数降低,凋亡率升高,这表明miR-125b过表达可增强MCF-7细胞的放射敏感性;而转染HK2真核表达质粒pcDNA3.1-HK2成功上调HK2表达后,miR-125b过表达对MCF-7细胞的放射增敏作用明显受到抑制,提示miR-125b可通过靶向抑制HK2增强MCF-7细胞的放射敏感性。
综上所述,miR-125b在乳腺癌MCF-7细胞中发挥着放射增敏作用,而靶向抑制HK2表达可能是其重要的分子机制,为miR-125b成为乳腺癌放射增敏的分子靶点提供了新的实验依据。
miR-125b靶向调控HK2表达增强乳腺癌MCF-7细胞放射敏感性的研究
Study on the mechanism of miR-125b targeting HK2 expression to enhance radiosensitivity of breast cancer MCF-7 cells
-
摘要:
目的探讨miR-125b靶向调控HK2对乳腺癌MCF-7细胞放射敏感性的影响。 方法将miR-125b模拟物及其阴性对照转染至乳腺癌MCF-7细胞,分别记为miR-125b组和miR-NC组,采用RT-PCR检测MCF-7细胞中miR-125b和HK2 mRNA的表达,Western blotting检测HK2蛋白的表达;双荧光素酶报告基因实验检测miR-125b和HK2的靶向关系。另外将miR-125b模拟物和pcDNA3.1-HK2质粒共转染至MCF-7细胞中,记为miR-125b+HK2组,通过克隆形成实验和流式细胞仪检测miR-NC组、miR-125b组和miR-125b+HK2组细胞的存活分数和凋亡率。 结果与miR-NC组相比,转染miR-125b模拟物后MCF-7细胞中miR-125b表达升高(P < 0.01),而HK2 mRNA和蛋白的表达降低(P < 0.01)。双荧光素酶报告基因实验证实HK2是miR-125b的潜在靶基因。与miR-NC组相比,miR-125b组细胞的存活分数降低、凋亡率升高(P < 0.01);与miR-125b组相比,miR-125b+HK2组存活分数降低明显升高而凋亡率降低(P < 0.01)。 结论miR-125b可通过靶向调控HK2表达增强乳腺癌MCF-7细胞的放射敏感性。 Abstract:ObjectiveTo investigate the effects of miR-125b targeting HK2 expression on the radiosensitivity of breast cancer MCF-7 cells. MethodsThe miR-125b mimics and its negative control were transfected into breast cancer MCF-7 cells, and divided into the miR-125b group and miR-NC group, respectively.The expression levels of miR-125b and HK2 mRNA in MCF-7 cells were detected using RT-PCR, and the expression of HK2 protein was detected by Western blotting.The targeting relationship between miR-125b and HK2 was detected using double luciferase reporter gene assay.The mimic of miR-125b and pcDNA3.1-HK2 plasmid were co-transfected into MCF-7 cells(miR-125b+HK2 group), and the survival fraction and apoptotic rate of cells in three groups were detected by clone formation assay and flow cytometry. ResultsAfter transfecting miR-125b mimics, compared with the miR-NC group, the expression level of miR-125b in MCF-7 cells increased(P < 0.01), and the expression levels of HK2 mRNA and protein decreased(P < 0.01).The results of double luciferase reporter gene assay confirmed that the HK2 was a potential target gene of miR-125b.Compared with the miR-NC group, the survival fraction and apoptotic rate of cells in miR-125b group decreased and increased, respectively(P < 0.01).Compared with the miR-125b group, the survival fraction and apoptotic rate in miR-125b + HK2 group significantly increased and decreased, respectively(P < 0.01). ConclusionsMiR-125b can enhance the radiosensitivity of breast cancer MCF-7 cells by targeting HK2 expression. -
Key words:
- breast neoplasms /
- miR-125b /
- HK2 /
- radiosensitivity
-
表 1 miR-125b与HK2 3′ UTR的结合位点
基因 互补的核苷酸序列 结合位点 HK2 5′....ACA GCC AAA UAA AAC CUC AGG GA...3′ 1370-1377 of HK2 miR-125b 3′......AGU GUU CAA UCC CAG AGU CCC U......5′ 3′ UTR 表 2 各MCF-7细胞的荧光素酶活性的比较(x±s)
分组 荧光素酶活性 miR-NC+HK2-WT组 1.12±0.09 miR-125b+HK2-WT组 0.53±0.04** miR-NC+HK2-MUT组 1.08±0.07 miR-125b+HK2-MUT组 0.99±0.06 F 48.84 P <0.01 MS组内 0.005 q检验:与miR-NC + HK2-WT组比较* *P<0.01 表 3 各组细胞的放射生物学参数比较
分组 D0/Gy Dq/Gy SF2 SER miR-NC 2.47 3.48 0.91 miR-125b 1.26 1.35 0.49 1.44 miR-125b+HK2 1.82 1.58 0.62 0.69 -
[1] PAJIC M, FROIO D, DALY S, et al.miR-139-5p modulates radiotherapy resistance in breast cancer by repressing multiple gene networks of DNA repair and ROS defense[J].Cancer Res, 2018, 78(2):501. doi: 10.1158/0008-5472.CAN-16-3105 [2] LUO M, DING L, LI Q, et al.miR-668 enhances the radioresistance of human breast cancer cell by targeting IκBα[J].Breast Cancer, 2017, 24(5):673. doi: 10.1007/s12282-017-0756-1 [3] ZHU J, YE Q, CHANG L, et al.Upregulation of miR-195 enhances the radiosensitivity of breast cancer cells through the inhibition of BCL-2[J].Int J Clin Exp Med, 2015, 8(6):9142. [4] 赵雪煜, 钱亚云.microRNA-125b在肿瘤发生发展中的研究进展[J].中国医药导报, 2017, 14(34):25. [5] LI Y, WANG Y, FAN H, et al.miR-125b-5p inhibits breast cancer cell proliferation, migration and invasion by targeting KIAA1522[J].Biochem Biophys Res Commun, 2018, 504(1):277. doi: 10.1016/j.bbrc.2018.08.172 [6] METHEETRAIRUT C, ADAMS B D, NALLUR S, et al.cel-mir-237 and its homologue, hsa-miR-125b, modulate the cellular response to ionizing radiation[J].Oncogene, 2017, 36(4):512. doi: 10.1038/onc.2016.222 [7] 张丹, 徐慧琴, 汪会, 等.siRNA沉默己糖激酶-2基因对MDA-MB231细胞放疗敏感性的影响[J].安徽医科大学学报, 2017, 52(1):95. [8] 赵晓静, 马军, 袁翎, 等.食管鳞癌细胞系TE7放射照射后miRNAs及DNA修复相关因子的表达[J].郑州大学学报(医学版), 2017, 52(3):247. [9] MUELLER AK, LINDNER K, HUMMEL R, et al.MicroRNAs and their impact on radiotherapy for cancer[J].Radiat Res, 2016, 185(6):668. doi: 10.1667/RR14370.1 [10] SHⅡBA M, SHINOZUKA K, SAITO K, et al.MicroRNA-125b regulates proliferation and radioresistance of oral squamous cell carcinoma[J].Br J Cancer, 2013, 108(9):1817. doi: 10.1038/bjc.2013.175 [11] DING J, MIAO ZH, MENG LH, et al.Emerging cancer therapeutic opportunities target DNA-repair systems[J].Trends Pharmacol Sci, 2006, 27(6):338. doi: 10.1016/j.tips.2006.04.007 [12] BHATT AN, CHAUHAN A, KHANNA S, et al.Transient elevation of glycolysis confers radio-resistance by facilitating DNA repair in cells.[J].BMC Cancer, 2015, 15(1):335. doi: 10.1186/s12885-015-1368-9 [13] 冯馨园, 张婷, 崔戈, 等.CNRIP1启动子区去甲基化对结肠癌细胞糖酵解及增殖、迁移活性的影响[J].郑州大学学报(医学版), 2018, 53(1):71. [14] HUI L, ZHANG J, GUO X.MiR-125b-5p suppressed the glycolysis of laryngeal squamous cell carcinoma by down-regulating hexokinase-2[J].Biomed Pharmacother, 2018, 103:1194. doi: 10.1016/j.biopha.2018.04.098 [15] ANDERSON M, MARAYATI R, MOFFITT R, et al.Hexokinase 2 promotes tumor growth and metastasis by regulating lactate production in pancreatic cancer[J].Oncotarget, 2017, 8(34):56081. [16] VARTANIAN A, AGNIHOTRI S, WILSON MR, et al.Targeting hexokinase 2 enhances response to radio-chemotherapy in glioblastoma[J].Oncotarget, 2016, 7(43):69518. [17] LIU Y, MURRAY-STEWART T, JR CR, et al.Targeting hexokinase 2 inhibition promotes radiosensitization in HPV16 E7-induced cervical cancer and suppresses tumor growth[J].Intern J Oncol, 2017, 50(6):2011. doi: 10.3892/ijo.2017.3979 [18] ZHANG D.Downregulation of HK2 by lentiviral shRNA improve radiosensitivity of breast cancer[J].J Nucl Med, 2018, 59(1):1364. -




 下载:
下载: