-
胃癌是一种侵略能力较强的恶性肿瘤,其发病率在全球恶性肿瘤中居第4位,病死率居第2位[1]。并且我国进展期胃癌治疗效果欠佳,五年生存率较低,其原因主要与胃癌细胞的侵袭能力强和转移早的特点相关[2]。有研究已经识别出胃癌相关的特异性基因[3], 但准确检测胃癌或者预测胃癌生存率的确切生物学标志仍缺乏。Gremlin1蛋白为促血管生成因子,是骨形态发生蛋白(BMP)的拮抗剂,存在于隐窝上皮细胞中。在实体肿瘤中明确Gremlin1的表达机制可能发现治疗癌症的潜在靶点[4]。Gremlin1具有促进血管生成和肿瘤形成的独立作用[5],可能是通过作用于BMP信号通路来抑制癌细胞的增殖和侵袭,在多种肿瘤生物学过程中发挥关键作用,并且已经被证实表达于结肠分叶状腺瘤和结肠癌中[6-7]。其在结肠癌等中表达的研究已经非常成熟,但其在胃癌组织中的表达情况及结果分析在国内鲜见报道,国外相关研究亦少有。Gremlin1激活的确切机制、与肿瘤进展的关系以及其在肿瘤血管生成中的作用还需要进一步阐明。本研究分析Gremlin1在胃癌的不同临床病理学参数间的表达差异,探讨其在胃癌组织中的临床意义。现作报道。
-
收集2017年度在蚌埠医学院第一附属医院行胃癌根治术,病理诊断为胃癌但又无其他原发性肿瘤的非贲门癌蜡块120例,所有病人术前均未进行化疗, 均有完整的病理资料;对照组选择为同病例的癌旁正常组织。年龄34~81岁,男85例,女35例;未分化腺癌74例(包括低分化、差分化、印戒细胞癌、黏液腺癌、神经内分泌癌),分化腺癌46例(包括乳头状癌、管状腺癌);淋巴结浸润阳性者72例,无淋巴结浸润者48例;肿瘤分期Ⅰ/Ⅱ期共57例,Ⅲ/Ⅳ期共61例;肿瘤直径≥5 cm 75例,<5 cm的45例;8例为肠型胃癌,112例为原发型胃癌。
-
免疫组织化学染色采用SP法。抗体Gremlin1购自合肥睿捷生物科技有限公司(产品编号ab189267), 染色程序按试剂盒说明书进行,主要包括:石蜡切片脱蜡、水化,自来水冲洗;根据第一抗的要求,对组织进行相应的抗原修复,如有必要(组织含内源性过氧化物酶),切片上滴加过氧化物酶阻断试剂,室温下孵育10 min。PBS冲洗3次,每次3 min;除去PBS,切片上滴加第一抗体,室温下孵育60 min或4 ℃过夜,PBS冲洗3次,每次3 min;除去PBS,切片上滴加反应增强液,室温下孵育20 min,PBS冲洗3次,每次3 min;除去PBS, 切片上滴加酶抗小鼠/兔IgG聚合物,室温下孵育30 min,PBS冲洗3次,每次3 min;除去PBS,切片上滴加新鲜配置的DAB或AEC显色试剂显色;自来水冲洗终止染色,苏木精复染(如有必要可用1%盐酸乙醇分化),PBS返蓝,如果用DAB显色,则切片经梯度乙醇脱水,二甲苯透明,中性树胶封固,如果用AEC显色,则不能经乙醇脱水,直接用水性固封剂封固。
以PBS代替一抗作阴性对照。每例癌组织均有同病例的邻近非癌组织作为对照。结果判定Gremlin1以细胞质出现棕黄色颗粒为阳性。根据染色程度和染色细胞百分率进行评定和分析:不着色为0分,浅粉色或黄色为1分,粉色或棕黄色为2分,红色或黄褐色为3分;着色细胞占计数细胞的百分率<5%记0分,5%~25%记1分,26%~50%记2分,>50%记3分。在低倍镜下(×40)每张切片随机观察10个视野,所得结果取平均数,将染色程度与染色细胞百分率得分相乘,其乘积为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(2+),>6分为强阳性(3+)。
-
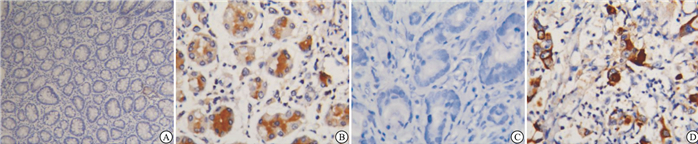
所有免疫染色切片均由我院2名资深的病理科医生独立进行评估。他们既不知道病例病理结果亦不知道Gremlin1的临床表达数据。Gremlin1在正常组织和癌组织中表达的参考图片见图 1~2。根据病理科医生评估的标准, 我们将免疫组织化学结果分为阴性(-/±)、阳性(+)、强阳性(2+/3+)。进一步分析其表达情况与临床病理学参数即性别、年龄、肿瘤大小、分级、分期、淋巴结浸润和肿瘤组织学类型的相关性。
-
采用χ2检验。
-
Gremlin1在正常组织中无表达(见图 3),在胃癌组织的细胞质中有表达(见图 4),其中阳性病例61例,阴性病例59例。不同性别、年龄、肿瘤大小、临床分期下Gremlin1表达差异无统计学意义(P>0.05),而不同淋巴结转移、肿瘤分级和组织来源的Gremlin1表达差异有统计学意义(P < 0.05)(见表 1)。
分组 阳性 阴性 χ2 P 年龄 <60岁 25 31 1.61 >0.05 >60岁 36 28 性别 男 47 37 3.71 >0.05 女 13 22 肿瘤大小 < 5 cm 38 37 0.00 >0.05 >5 cm 23 22 淋巴结浸润 阳性 30 42 6.05 <0.05 阴性 31 17 临床分期 Ⅰ/Ⅱ 33 24 2.17 >0.05 Ⅲ/Ⅳ 28 35 组织学特点 分化型 23 21 8.56 <0.01 未分化型 38 38 组织来源 肠型胃癌 1 7 — <0.05 胃型胃癌 60 52 表 1 Gremlin1与临床病理学参数的相关性(n)
-
Gremlin1促进肿瘤的进展主要通过刺激肿瘤血管的生成、抑制癌细胞周期和拮抗BMPs抑制肿瘤干细胞分化的方式来发挥作用[8]。近年来,Gremlin1在肢体发育、血液系统的的作用已被证实,如Gremlin1/BMPs通路不仅在关节软骨中广泛存在,还存在于造血干细胞的发育、生存中[8-9]。肿瘤干细胞(CSCs)可分泌大量的Gremlin1,使得肿瘤通过其分泌的Gremlin1产生自我保护机制来逃逸BMP的抑制作用[4]。Gremlin1通过抑制BMP的抗炎作用从而可能具有潜在的促炎作用[10],同时Gremlin1在具有强烈的脐周炎症反应的肿瘤中表达较高[11-12],这一点也证实了Gremlin1有促炎作用。HONG等[13]利用免疫组织化学证实了Gremlin1在食管癌表达水平为正常组织的2.5倍,敲除Gremlin1后,可以提高食管癌细胞体外增殖能力、生存能力和侵袭能力;再次将含有shGremlin1-MSCs条件培养基中培养食管癌细胞时,上述能力会减弱。这为Gremlin1沉默的食管癌的治疗提供了新的策略和潜在的临床应用理论。
Gremlin1也被发现与结肠癌的侵袭相关[5, 14],在正常结肠中,黏膜上部有高表达的BMPs,而基底部则有大量的Gremlin1和其他BMP拮抗剂,而BMP信号的中断会促进肠道息肉和癌症[15]。PELLI等[16]研究发现在结肠癌细胞中,Gremlin1在低TNM分期、低组织学分级、分叶组织、浸润边缘处的强炎症反应中表达强度明显增加。TNM分期越高、分化越差,Gremlin1表达表达越低,并且在淋巴结转移病人中的表达较低,与年龄、性别无关。提示Gremlin1可能在恶性肿瘤的早期阶段被激活,并且在肿瘤的进展过程中逐渐消失,可能是结肠癌的早期诊断指标或是预后良好的阶段性独立指标。
HONMA等[17]研究发现通过单变量和多变量分析显示Gremlin1是胃癌发生的独立预测因子,其表达与性别、年龄无关,而与肿瘤大小、分级、分期、淋巴结浸润、血管浸润呈负相关性,原发性胃癌中Gremlin1的更易表达,且Gremlin1表达阳性和阴性病例的5年生存率分别为86%和58%,Gremlin1阴性的胃癌病人的生存率明显较低。有关Gremlin1甲基化与恶性肿瘤的相关性及其与活跃血管生成的相关性的研究[18]提示Gremlin1在肾透明细胞癌发生和肿瘤血管生成中起重要作用,与肿瘤大小、级别、分期、血管生成和预后不良有关。
本研究发现Gremlin1在正常组织及肿瘤组织中均有表达,分布情况与正常胃上皮细胞相类似,这可能提示其表达与胃的正常功能相关。Gremlin1表达存在于癌细胞质中,其表达与性别、年龄、肿瘤大小、分期无关,而与肿瘤分级、淋巴结浸润呈负相关,原发性胃癌中Gremlin1更易表达。提示肿瘤分化程度越低、淋巴结浸润的病例Gremlin1表达程度较低,提示Gremlin1阴性与胃癌预后不良有关。Gremlin1阴性的病例恶性程度可能更高以及原发性胃癌更易出现阳性表达,这两点与HONMA等[17]研究结果一致,这也与大量研究论述BMP是肿瘤抑制因子,而作为其拮抗剂的Gremlin1是肿瘤促进因子等研究相一致。BLEUMING等[19-20]揭示了BMP信号在胃肿瘤发生中的作用,而BMP-7阳性的胃癌与分化良好的肿瘤组织学有关[21]。
其中本实验中肿瘤的临床分期和Gremlin1的关系与HONMA等[17]研究结果不一致,这可能与病例收集引起的误差有关。因为随着内镜诊断胃早癌技术的成熟,使得越来越多的病人能及早治疗,而使得中晚期的病人病例较以前的研究减少。还有研究[22]表明Gremlin1的高表达与肿瘤的体积大小有关,而肿瘤体积大是其恶性特征之一,本研究结果与之亦不一致,可能与病例数量不够大有关。Gremlin1可能在肿瘤进展中起重要作用,其表达情况与淋巴结转移、肿瘤分级呈负相关,即淋巴结阳性和分化程度较低的病人Gremlin1表达程度较低,而肿瘤转移是癌症病人高死亡率的原因之一[23],Gremlin1表达阴性的病例易发生淋巴结转移,从而可导致病人预后不良。然而可能由于我们的实验标本量不足,再加上未能收集到有关肿瘤血管浸润的病例,这是该实验的不足点。并且为了保证所选病例数据的完整性我们只选取了最近一年的病例,导致我们不能进一步分析胃癌病人术后的五年生存率与Gremlin1之间有无相关性。虽然实验已经完成,但后续我们会进行追踪随访,进一步分析二者之间的关系,希望为胃癌的诊治提供新的依据。
综上所述,Gremlin1可能在肿瘤生成中起重要作用,但其激活的确切机制及其与肿瘤进展的关系以及其在肿瘤血管生成中的作用还需要进一步阐明。欲将Gremlin1蛋白用于胃癌的诊断还需要更多的研究者进行更大样本量的临床研究。此外,还可以进一步探讨其在早期胃癌中的表达情况,以明确Gremlin1是否可以作为胃癌早期诊断的指标。
Gremlin1在胃癌组织中的表达及其作用分析
Analysis of the expression level of Gremlin1 and its role in gastric cancer tissue
-
摘要:
目的分析Gremlin1在胃癌的不同临床病理学参数及胃癌组织和癌旁正常组织中的表达差异,探讨其在胃癌组织中的临床意义。 方法选取胃癌根治术后的120例组织标本及其癌旁组织,采用免疫组织化学方法检测Gremlin1的表达及其分布情况,进行定性分析。 结果Gremlin1在部分正常组织中无表达,在胃癌组织的细胞质中有表达,其中阳性病例61例,阴性病例59例。不同性别、年龄、肿瘤大小、临床分期下Gremlin1表达差异无统计学意义(P>0.05),而不同淋巴结转移、肿瘤分级和组织来源的Gremlin1表达差异有统计学意义(P < 0.05~P < 0.01)。 结论Gremlin1在胃癌进展中起重要作用,提示胃癌预后不良。 Abstract:ObjectiveTo analyze the different clinicopathological parameters of Gremlin1 expression in gastric cancer and difference of Gremlin1 expression between the gastric cancer tissue and adjacent noncancerous tissue, and explore its clinical significance in gastric cancer tissue. MethodsThe expression level and distribution of Gremlin1 in 120 gastric cancer and adjacent tissue samples were detected using immunohistochemistry after radical gastrectomy for qualitative analysis. ResultsThe Gremlin1 expression in normal tissue was not found, and the expression of Gremlin1 in cytoplasm of gastric cancer tissue was identified.There were 61 positive cases and 59 negative cases.The differences of the expression levels of Gremlin1 in different gender, age, tumor size and clinical stage were not statistically significant(P>0.05), and the differences of the expression levels of Gremlin1 in different lymph node metastasis and tumor grading were statistically significant(P< 0.05 to P < 0.01). ConclusionsGremlin1 play an important role in the progression of gastric cancer, which indicates the poor prognosis of gastric cancer. -
Key words:
- gastric neoplasms /
- Gremlin1 /
- bone morphogenetic protein /
- immunohistochemistry
-
表 1 Gremlin1与临床病理学参数的相关性(n)
分组 阳性 阴性 χ2 P 年龄 <60岁 25 31 1.61 >0.05 >60岁 36 28 性别 男 47 37 3.71 >0.05 女 13 22 肿瘤大小 < 5 cm 38 37 0.00 >0.05 >5 cm 23 22 淋巴结浸润 阳性 30 42 6.05 <0.05 阴性 31 17 临床分期 Ⅰ/Ⅱ 33 24 2.17 >0.05 Ⅲ/Ⅳ 28 35 组织学特点 分化型 23 21 8.56 <0.01 未分化型 38 38 组织来源 肠型胃癌 1 7 — <0.05 胃型胃癌 60 52 -
[1] VAN CUTSEM E, SAGAERT X, TOPAL B, et al.Gastric cancer[J].Lancet, 2016, 388(26):54. [2] CHEN J, LIU X, JIAO H, et al.Prognostic and clinical significance of STAT3 and MMP9 in patients with gastric cancer:a meta-analysis of a Chinese cohort[J].Int J Clin Exp Med, 2015, 8(1):546. [3] OUE N, SENTANI K, SAKAMOTO N, et al.Clinicopathologic and molecular characteristics of gastric cancer showing gastric and intestinal mucin phenotype[J].Cancer Sci, 2015, 106(8):951. doi: 10.1111/cas.12706 [4] SEOANE J.Gremlins sabotage the mechanisms of cancer stem cell differentiation[J].Cancer Cell, 2014, 25:716. doi: 10.1016/j.ccr.2014.06.002 [5] KARAGIANNIS GS, MUSRAPN, SARAON P, et al.Bone morphogenetic protein antagonist gremlin-1 regulates colon cancer progression[J].Biol Chem, 2015, 396(2):163. doi: 10.1515/hsz-2014-0221 [6] LAURILA R, PARKKILA S, ISOLAJ, et al.The expression patterns of gremlin 1 and noggin in normal adult and tumor tissues[J].Int J Clin Exp Pathol, 2013, 6(7):1400. [7] DAVIS H, IRSHAD S, BANSAL M, et al.Aberrant epithelial GREM1 expression initiates colonic tumorigenesis from cells outside the stem cell niche[J].Nat Med, 2015, 21(1):62. doi: 10.1038/nm.3750 [8] SHEKELS LL, COLVIN WANSHURA LE, XIE Y, et al.The effects of Gremlin1 on human umbilical cord blood hematopoietic progenitors[J].Blood Cells Mol Dis, 2015, 54(1):103. doi: 10.1016/j.bcmd.2014.07.012 [9] YU XD, KAWAKAMI H, TAHARA N, et al.Expression of Noggin and Gremlin1 and its implications in fine-tuning BMP activities in mouse cartilage tissues[J].J Orthop Res, 2017, 35(8):1671. doi: 10.1002/jor.23463 [10] TAKABAYASHI H, SHINOHARA M, MAO M, et al.Anti-inflammatory activity of bone morphogenetic protein signaling pathways in stomachs of mice[J].Gastroenterology, 2014, 147(2):396. doi: 10.1053/j.gastro.2014.04.015 [11] VÄYRYNEN JP, TUOMISTO A, KLINTRUP K, et al.Detailed analysis of inflammatory cell infiltration in colorectal cancer[J].Br J Cancer, 2013, 109(7):1839. doi: 10.1038/bjc.2013.508 [12] ROXBURGH CS, MCMILLAN DC.The role of the in situ local inflammatory response in predicting recurrence and survival in patients with primary operable colorectal cancer[J].Cancer Treat Rev, 2012, 38(5):451. doi: 10.1016/j.ctrv.2011.09.001 [13] HONG D, LIU T, HUANG W, et al.Gremlin1 delivered by mesenchymal stromal cells promoted epithelial-mesenchymal transition in human esophageal squamous cell carcinoma[J].Cell Physiol Biochem, 2018, 47(5):1785. doi: 10.1159/000491060 [14] KARAGIANNIS GS, TREACY A, MESSENGER D, et al.Expression patterns of bone morphogenetic protein antagonists in colorectal cancer desmoplastic invasion fronts[J].Mol Oncol 2014, 8(7):1240. doi: 10.1016/j.molonc.2014.04.004 [15] KOSINSKI C, LI VS, CHAN AS, et al.Gene expression patterns of human colon tops and basal crypts and BMP antagonists as intestinal stem cell niche factors[J].Pro Natl Acad Sci USA, 2007, 104(39):15418. doi: 10.1073/pnas.0707210104 [16] PELLI A, VÄYRYNEN JP, KLINTRUP K, et al.Gremlin1 expression associates with serrated pathway and favourable prognosis in colorectal cancer[J].Histopathology, 2016, 69(5):831. doi: 10.1111/his.13006 [17] HONMA R, SAKAMOTO N, ISHIKAWA A, et al.Clinicopathological and Prognostic Significance of Epithelial Gremlin1 Expression in Gastric Cancer[J].Anticancer Res, 2018, 38(3):1419. [18] VAN VLODROP IJ, BALDEWIJNS MM, SMITS KM, et al.Prognostic Significance of Gremlin1(GREM1)Promoter CpG Island Hypermethylation in Clear Cell Renal Cell Carcinoma[J].Am J Pathol, 2010, 176(2):575. [19] BLEUMING SA, HE XC, KODACH LL, et al.Bone morphogenetic protein signaling suppresses tumorigenesis at gastric epithelial transition zones in mice[J].Cancer Res, 2007, 67(17):8149. doi: 10.1158/0008-5472.CAN-06-4659 [20] OSHIMA H, ITADANI H, KOTANI H, et al.Induction of prostaglandin E2 pathway promotes gastric hamartoma development with G1078 BMP signaling in gastaric epithelial cytodiffererentiation of bone morphogenetic protein signaling[J].Cancer Res, 2009, 69(7):2729. doi: 10.1158/0008-5472.CAN-08-4394 [21] AOKI M, ISHIGAMI S, UENOSONO Y, et al.Expression of BMP-7 in human gastric cancer and its clinical significance[J].Br J Cancer, 2011, 104(4):714. doi: 10.1038/sj.bjc.6606075 [22] SATO M, KAWANA K, FUJIMOTO A, et al.Clinical significance of Gremlin1 in cervical cancer and its effects on cancer stem cell maintenance[J].Oncol Rep, 2015, 35(1):391. [23] SHINYA O, SHIN'ICHI M, OSAMU K, et al.Recent advances from basic and clinical studies of esophageal squamous cell carcinoma[J].Gastroenterology, 2015, 149(7):1700. doi: 10.1053/j.gastro.2015.08.054 -




 下载:
下载: