-
乳腺癌作为常见肿瘤,多发于女性,已经严重威胁女性的身心健康。现阶段,乳腺癌在女性中的发病率呈逐步上升的趋势。作为乳腺癌的严重类型,三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)阴性的乳腺癌, 占所有乳腺癌的9%~16%, 好发于年轻女性(< 50岁者多见)[1-2]。TNBC具有高侵袭性、复发较早及高远处转移率的特点, 与此同时,TNBC的5年生存率和总生存率较低, 预后相对较差[3]。目前, TNBC主要有手术治疗、化学药物治疗、放射治疗等, 与其他类型乳腺癌相比并无特殊之处, 但是由于TNBC的分子靶点为阴性,所以对于TNBC病人来说,内分泌治疗与分子靶向治疗效果不理想。因此, TNBC研究的重点是寻找提高乳腺癌治疗效果方法和降低乳腺癌复发转移。肿瘤细胞化学治疗的药物耐药问题是多学科、多领域的共同难题。就现在的研究来说,已发现的经典的肿瘤细胞化学治疗的耐药机制主要是膜相关糖蛋白介导的化疗药物外排机制;相关自噬凋亡DNA修复异常机制以及肿瘤细胞凋亡通路表达异常相关机制等。上皮间质转化过程(epithelial-mesenchymal transition, EMT)是肿瘤细胞在一定的生理和病理情况下,恶性肿瘤细胞由上皮细胞源性向间质细胞源性发生的转化过程。肿瘤细胞的EMT被认为是肿瘤转移和侵袭过程中的重要原因。在对发生EMT的恶性肿瘤细胞的研究过程中发现,已发生EMT的细胞, 相较于未发生EMT的细胞,细胞间黏附能力降低, 恶性肿瘤细胞的侵袭和迁移能力和抵制凋亡的能力增强, 并可引起大量恶性肿瘤细胞的细胞外基质组分的产生。研究[4]提示, 在乳腺癌、结肠癌、宫颈癌等在内多种肿瘤侵袭转移过程中均观察到EMT现象的发生。细胞的自噬是一种广泛存在于真核生物的细胞程序性死亡机制,能够在细胞生长过程中维持细胞能量的平衡并且对养分胁迫产生应答反应。近年来,TNBC治疗中自噬的研究已成为热点。其主要的研究方向分为三个方向:(1)通过抑制乳腺癌肿瘤的自我自噬保护,进而加强乳腺癌细胞的化疗药物敏感性,抑制化疗药物耐药性;(2)通过抑制乳腺癌肿瘤的自我保护性自噬,进而提高乳腺癌细胞的放疗敏感性;(3)通过促进乳腺癌细胞的自我消灭性自噬,进而直接杀伤TNBC细胞。已有学者[5-7]证实,通过激活自噬从而直接杀伤TNBC细胞, 这种激活自噬的机制可以是小分子非编码RNA(ncRna)、兴奋子(activator)和化合物(如牛樟芝Antrodia salmonea)。化疗起了不可替代的作用,但是化疗耐药一直是影响TNBC治疗的重要因素,因此抑制化疗耐药也是众多学者研究的重点。已有学者[8-11]证实抑制自噬可以增强多种化疗药物的化疗敏感性。本文就TNBC与普通乳腺癌细胞在上皮间质化和自噬性上的差异作一探索,现作报道。
-
TNBC细胞系BT-549、非TNBC细胞系MCF-7购自中国科学院上海细胞研究所。用RPMI1640混合培养基[含10%胎牛血清(FBS)和100 U /mL青霉素、100 U/mL链霉素]于37℃、5% CO2培养箱中培养,细胞为贴壁生长,每3~4 d以0.25%胰蛋白酶消化传代。实验细胞均处于对数生长期。
-
从-80℃冰箱中取出目标细胞的冻存管,立即投入37℃的水浴箱中迅速解冻,直至冻存的细胞冻存液完全溶解,将细胞冻存悬液从冻存管转移到离心管内,在离心管中加入5 mL完全培养基,轻轻吹打混匀;将细胞悬液1000r/min离心5min,离心后移液器吸去上清液。向离心管中细胞沉淀中加入完全培养液5mL,轻轻吹打混匀,将细胞悬液转移到培养瓶内,放入恒温箱中放置过夜后,第2天换液。
-
光学显微镜下观察,如培养瓶中的细胞基本覆盖培养瓶瓶底时,吸除所有培养基;加入1mL胰蛋白酶(0.25%),消化2min;细胞变圆后加1 mL的完全培养基终止消化;使用移液器轻柔吹打细胞悬液,然后移液器将细胞悬液移植至离心管中,1000r/min离心5min;去除上清液,加2mL培养基,将细胞重新悬浮转移至培养瓶中继续培养。
-
显微镜下观察细胞,当细胞基本布满培养瓶瓶底后,加入1mL胰酶消化细胞,2min后,加入1mL完全培养基,轻柔吹打细胞后,将细胞悬液收集至离心管中,1000r/min离心5min,弃上清液。向离心管中加入3mL的冷冻保护液,轻轻吹打混匀,使细胞密度达1×106~1×107个/mL;而后以每管1~1.5 mL的量分装于冻存管内,拧紧管盖,封存冻存管,在冻存管上做好标记,梯度冻存。
-
取处于完全对数生长期的肿瘤细胞,先消化后,调整细胞数目,以600个/mL为宜。取6孔板,每孔加入1 mL细胞悬液,而后每个孔加入完全培养基2 mL。将6孔板放入37℃、5%CO2培养箱中培养14 d;镜下观察克隆体形成时终止培养。使用移液器弃去上层培养基,PBS清洗细胞2次后,加入甲醇固定,每孔1 mL,固定5 min,吸出甲醇固定液,每孔加入结晶紫染色剂适量,多次染色后,使用超纯水缓慢轻柔的洗去染色剂,放置于室温环境下干燥。显微镜下观察拍照计数。
-
首先制备Matrigel基质胶,将Matrigel基质胶放入4℃的冰箱过夜,使用Matrigel基质胶与不完全培养基按1:1配成Matrigel胶。在小室的上室加入30μL的已经稀释过的Matrigel胶,置于37℃的培养箱中过夜。使用不含血清的不完全培养基培养细胞过夜。胰蛋白酶消化细胞,不完全培养基重悬细胞,调节细胞数目至1×105个/mL。在Transwell小室上室中加入不完全培养基细胞悬液100μL,在Transwell下室中加入完全培养基300 μL,把transwell小室小心放入下室上,注意不要产生气泡。将24孔板放入37℃、5% CO2培养箱中培养过夜。侵袭完成后,用棉签小心擦除上层小室的基质胶和残留细胞。放入甲醛中固定10 min,小室倒置,放在室温环境中,自然风干。待风干完成后,放入结晶紫中染色。使用PBS轻柔清洗后,计数。
-
稳定培养BT-549和MCF-7细胞,待贴壁后吸除废旧1640培养基,加入预冷PBS洗2~3遍,吸尽PBS。按照40μL磷酸酶抑制剂+40μL蛋白酶抑制剂+40μL PMSF+4 mL RIPA裂解液配制总蛋白裂解液,加入培养板中,细胞刮片充分刮取细胞,转入1.5 mL EP管中。涡旋震荡10 s,静置10 min,此过程重复3次。14 000r/min,4℃离心15min,取上清为全蛋白提取物。按BCA试剂盒说明书检测蛋白浓度并配平。按比例加入5×上样缓冲液混匀,煮沸5 min。每加样孔加入20 μL待测样品,SDS-PAGE电泳,参照预染Marker的位置,确定电泳时间。电泳完成后将蛋白转置NC膜上。TBST摇床上洗膜3次,每次10 min。然后加入含10%脱脂奶粉的封闭液,摇床振荡1.5~2 h。封闭结束后,用TBST摇床上洗膜3次,每次10 min。按照说明比例稀释,一抗(E-cadherin、β-catenin、N-cadherin、Vimentin、GAPDH),并将NC膜放入其中,摇床振荡孵育过夜。第2天取出,室温振荡30 min。用TBST摇床上洗膜3次,每次10min。将NC膜置于兔抗和鼠抗(用10%脱脂奶粉封闭液稀释)中,室温摇床振荡反应1~2 h。二抗反应结束后,回收二抗。然后用TBST摇床上洗膜3次,每次10 min。将ECL化学发光试剂盒中的A、B两种液体按说明书比例混合,配置成曝光液备用。将NC膜从TBST中取出,将含有蛋白质的膜正面朝上,加入适量工作液。使用G:BOX chemiXR5成像,并用Gel-Pro32软件进行灰度分析。
-
收集样本,PBS洗涤1遍,置于EP管中。2.5%戊二醛,磷酸缓冲液配制固定2 h。依次使用乙醇脱水。纯包埋液,37 ℃,24 h。放入37℃烘箱内,过夜。LKB-1型超薄切片机切片50~60 nm,3%醋酸铀-枸橼酸铅双染色,透射电镜观察。拍片。
-
首先做好细胞涂片,放置室温中自然晾干。把晾干后的细胞涂片完全浸入4%的多聚甲醛固定液中过夜,使用PBS浸洗3 min,浸洗3次;每张切片滴加2滴3%H2O2-甲醇溶液,室温(15~25 ℃)封闭10 min。PBS浸洗3次。滴加即用型山羊血清50~100 μL, 室温孵育20 min,而后滴加已经经过1:100稀释的一抗100 μL,37 ℃条件下,湿盒孵育2 h后,使用PBS小心轻柔清洗涂片3次。滴加经过1:200稀释的二抗100 μL,室温,避光条件下细胞涂片孵育1 h;PBS浸洗3次。每张片子滴加配制DAPI染液100 μL,室温避光条件下放置5 min。使用荧光显微镜观察细胞中相关蛋白的表达情况,拍照保存。蛋白印迹实验同上。
-
采用t检验。
-
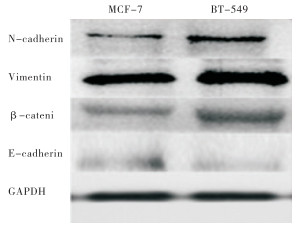
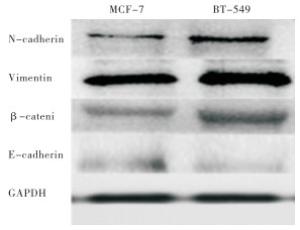
TNBC细胞组BT-549组克隆率(59.33±5.13)%,侵袭率(101.67±5.03)%,均高于非TNBC细胞组MCF-7组的(39.67±2.08)%、(78.33±6.03)%(t=0.004和0.007,P < 0.05)。TNBC组间质细胞标志物N-cadherin、Vimentin,β-catenin相对高表达, 非TNBC组上皮细胞标志物E-cadherin相对高表达(见图 1)。
-
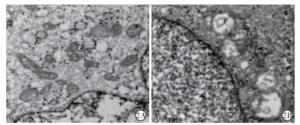
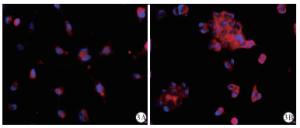
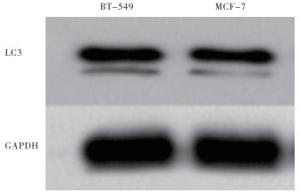
电镜下,BT-549胞质中除有线粒体轮廓外,其他细胞器少见,细胞胞质空泡化。MCF-7线粒体损伤明显,嵴消失空泡化。MCF-7细胞发生细胞线粒体自噬现象(见图 2)。TNBC组自噬微管相关蛋白1轻链3(LC3)免疫组化差异,平均光密度(MOD)较非TNBC组增大(见图 3)。TNBC组自噬标记蛋白LC3表达较多(见图 4)。
-
在女性已确诊的恶性肿瘤中,乳腺恶性肿瘤约占三分之一。常规的乳腺癌治疗包括手术、化学治疗、内分泌治疗等。与其他类型乳腺癌相比,TNBC的治疗方法并无特殊之处, 但是TNBC“三阴性”的本质导致其对乳腺癌内分泌治疗不敏感, 且曲妥珠单抗分子靶向治疗无效。截止目前, 针对TNBC研发的免疫治疗、分子靶向治疗等新兴的治疗方案正在紧张的研发过程中, 短期投入到临床并且广泛应用的可能性很小[12]。因此, 探索TNBC的本质并寻找提高乳腺恶性肿瘤治疗效果和降低乳腺癌复发转移成为TNBC领域的研究重点。已有学者[8-11]证实抑制自噬可以增强多种化疗药物的化疗敏感性。
本文结果显示,从细胞行为的角度,TNBC细胞较非TNBC细胞更易增殖,且侵袭性更强。EMT角度,TNBC组间质细胞标志物N-cadherin、Vimentin、β-catenin相对高表达, 非TNBC组上皮细胞标志物E-cadherin相对高表达,提示TNBC组发生较多EMT。从自噬角度,电镜观察可知非TNBC组线粒体损伤相较于TNBC组更明显,非TNBC组发生线粒体自噬。损伤线粒体利用自噬作用选择性清除受损的细胞器和相关的受损蛋白成分,以此维持细胞内环境稳定,该过程被称为线粒体自噬[13]。有学者[14]研究,线粒体自噬作为常见的选择性自噬的一种,其作用通路不与LC3通路直接重合,而是通过泛素信号与自噬货物受体视神经病变诱导蛋白(optineurin,OPTN)和自噬受体蛋白NDP52相连接。此过程自噬是细胞对外界环境改变的一种自我保护机制。免疫组化和蛋白表达显示TNBC组LC3表达较非TNBC组高表达,证实LC3在自噬和凋亡中的关键作用,并且通过调控Mcl-1、Bcl-2的耦合因子BAG3,调控自噬过程,从而提高了TNBC对5-氟尿嘧啶、阿霉素、多西紫杉醇等药物的敏感性[15]。此外,有学者[16]证实通过抑制Cyclin-D1和uPAR/整合素β1/Src信号转导抑制自噬相关基因(LC3和Beclin-1)可诱导细胞凋亡并抑制TNBC细胞。虽然已有学者[17]证实EMT经典通路wnt-β-catenin和LC3连接体系有所关联, 但是具体关联通路及与肿瘤增殖、侵袭等生物行为的相关程度暂时还未完全清楚。此外,乳腺癌中线粒体自噬与乳腺癌生物学行为和化疗耐药的关系尚未完全明确。综上所述,TNBC增殖性、侵袭性皆强于非TNB,上皮间质化程度和自噬化程度均较高。
三阴性乳腺癌的上皮间质转化及自噬特性差异的研究
Study on the difference between epithelial-mesenchymal transformation and autophagy in triple negative breast cancer
-
摘要:
目的探讨三阴性乳腺癌(TNBC)的上皮间质转化(EMT)及自噬特性的差异。 方法选取TNBC细胞株BT-549与非TNBC细胞株MCF-7,分别对比其EMT及自噬特性。通过细胞形态,平板克隆,Transwell侵袭实验,Western blotting实验测定其EMT的差异,通过电镜观察自噬体,免疫荧光实验,Western blotting实验测定其自噬特性。 结果TNBC增殖性和侵袭性强于非TNBC,TNBC组间质细胞标志物N-cadherin、Vimentin、β-catenin相对高表达,非TNBC组上皮细胞标志物E-cadherin相对高表达。电镜下,非TNBC细胞线粒体自噬,TNBC组自噬微管相关蛋白1轻链3相对高表达。 结论TNBC增殖性、侵袭性皆强于非TNBC,EMT及自噬化程度均较高。 Abstract:ObjectiveTo explore the difference between epithelial-mesenchymal transition(EMT) and autophagy properties in triple negative breast cancer. MethodsThe epithelial-mesenchymal transition(EMT) and autophagy characteristics were compared between three negative breast cancer(TNBC) cell line BT-549 and non-triple negative breast cancer(non-TNBC) cell line MCF-7.The EMT were investigated using the cell morphology, plate cloning, transwell invasion assay and western blot analysis.The autophagy characteristics were observed by electron microscopy, immunofluorescence assay and western blot analysis. ResultsThe proliferation and invasion in TNBC were stronger than that in non-TNBC.The N-cadherin, Vimentin and β-catenin of interstitial cell markers were relatively high expression in TNBC group, and the E-cadherin of epithelial cell markers was relatively high expression in non-TNBC group.Under electron microscope, the mitochondrial autophagy was detected in non-TNBC cells, and the autophagy microtubule associated protein 1 light chain 3 was relatively high expression in TNBC group. ConclusionsThe proliferation and invasion in TNBC are stronger than that in non-TNBC, and the EMT and degree of autophagy are high in TNBC. -
Key words:
- breast cancer /
- epithelial-mesenchymal transition /
- autophagy /
- triple negative
-
[1] Cancer Genome Atlas Network.Comprehensive molecular portraits of human breast tumours[J].Nature, 2012, 490(7418):61. doi: 10.1038/nature11412 [2] MONTAGNA E.Heterogeneity of triple-negative breast cancer:histologic subtyping to inform the outcome[J].Clin Breast Cancer, 2013, 13(1):31. [3] GUCALP A, TRAINA TA.Triple-negative breast cancer:adjuvant therapeutic options[J].Chemother Res Pract, 2011, 2011:696208. [4] Franco-Chuaire ML, Magda Carolina SC, Chuaire-Noack L.Epithelial-mesenchymal transition (EMT); principles and clinical impact in cancer therapy[J].Invest Clin, 2013.54(2):186. [5] LIANG O, LAN Z, FU L, et al.A small-molecule activator induces ULK1-modulating autophagy-associated cell death in triple negative breast cancer[J].Autophagy, 2017, 13(4):777. doi: 10.1080/15548627.2017.1283470 [6] BRAICU C, PILECZKI V, POP L, et al.Dual targeted therapy with p53 siRNA and Epigallocatechingallate in a triple negative breast cancer cell model[J].Plos One, 2015, 10(4):e0120936. doi: 10.1371/journal.pone.0120936 [7] CHANG CT, HSEU YC, THIYAGARAJAN V, et al.Antrodia salmonea, induces G 2, cell-cycle arrest in human triple-negative breast cancer (MDA-MB-231) cells and suppresses tumor growth in athymic nude mice[J].J Ethnopharmacol, 2017, 196:9. doi: 10.1016/j.jep.2016.12.018 [8] GARBAR C, MASCAUX C, GIUSTINIANI J, et al.Chemotherapy treatment induces an increase of autophagy in the luminal breast cancer cell MCF7, but not in the triple-negative MDA-MB231[J].Sci Rep, 2017, 7(1):7201. [9] LIU Z, HE K, MA Q, et al.Autophagy inhibitor facilitates gefitinib sensitivity in vitro and in vivo by activating mitochondrial apoptosis in triple negative breast cancer[J].Plos One, 2017, 12(5):e0177694. doi: 10.1371/journal.pone.0177694 [10] KOH DW, POWELL DP, BLAKE SD, et al.Enhanced cytotoxicity in triple-negative and estrogen receptor-positive breast adenocarcinoma cells due to inhibition of the transient receptor potential melastatin-2 channel[J].Oncol Rep, 2015, 34(3):1589. [11] FAN YX, DAI YZ, WANG XL, et al.MiR-18a upregulation enhances autophagy in triple negative cancer cells via inhibiting mTOR signaling pathway[J].Eur Rev Med Pharmacol Sci, 2016, 20(11):2194. [12] BERRADA NS, ANDRE DF.Treatment of triple-negative metastatic breast cancer:toward individualized targeted treatments or chemosensitization?[J].Ann Oncol, 2010, 21(Suppl 7):vii30. [13] WANG C, MAO C, LOU Y, et al.Monotropein promotes angiogenesis and inhibits oxidative stress-induced autophagy in endothelial progenitor cells to accelerate wound healing[J].J Cell Mol Med, 2017, 22(3):1583. [14] HAMACHER-BRADY A, BRADY NR.Mitophagy programs:mechanisms and physiological implications of mitochondrial targeting by autophagy[J].Cell Mol Life Sci, 2015, 73(4):775. [15] DAS CK, LINDER B, BONN F, et al.BAG3 overexpression and cytoprotective autophagy mediate apoptosis resistance in chemoresistant breast cancer cells[J].Neoplasia, 2018, 20(3):263. doi: 10.1016/j.neo.2018.01.001 [16] HAMURCU Z, DELIBAŞI N, GEÇENE S, et al.Targeting LC3 and Beclin-1 autophagy genes suppresses proliferation, survival, migration and invasion by inhibition of Cyclin-D1 and uPAR/Integrin β1/Src signaling in triple negative breast cancer cells[J].J Cancer Res Clin Oncol, 2018, 144(3):415. doi: 10.1007/s00432-017-2557-5 [17] WANG MC, WU AG, HUANG YZ, et al.Autophagic regulation of cell growth by altered expression of Beclin 1 in triple-negative breast cancer[J].Int J Clin Exp Med, 2014, 8(5):7049. -




 下载:
下载: