-
糖尿病视网膜病变是糖尿病最常见的微血管并发症之一,是发达国家和部分发展中国家工作人群致盲的重要原因。2000年,全球糖尿病病人达1.71亿,到2030年,全球糖尿病病人预计达到3.6亿。目前,中国糖尿病病人已达9 240万,居世界之首,而糖尿病视网膜病变患病率达37%[1]。因而,糖尿病视网膜病变机制的研究及其防治是全球眼科学和内分泌专业的学者共同关注的问题。
视网膜屏障功能受损,是糖尿病视网膜病变发生发展的重要病理基础。视网膜色素上皮(retinal pigment epithelium,RPE)细胞是视网膜外屏障的重要组成细胞,其通过细胞间及细胞与基质间的黏附构成的紧密连接在维持视网膜的内环境中发挥重要作用。由于RPE细胞的特殊位置,极易受到高血糖的影响[2-3]。syndecan-1是一种黏附分子,属于整联蛋白跨膜硫酸肝素蛋白多糖家族成员,可调控细胞的黏附、移行和增生,参与组织器官分化发育、血管形成、组织再生、组织损伤修复、炎症、脂质代谢等一系列病理生理过程[4-6]。syndecan-1分子可调控RPE细胞的黏附、增生和移行[7],并参与糖尿病视网膜病变的发生发展[8-9]。目前,国内外鲜见高糖对于RPE细胞syndecan-1表达影响的研究报道。本实验的目的是观察高糖对体外培养的人RPE细胞syndecan-1表达的影响。现作报道。
-
主要试剂:低糖DMEM培养基(含5.56 mmol/L葡萄糖)、高糖DMEM培养基(含25 mmol/L葡萄糖)、胎牛血清购自美国Hyclone公司,实时定量聚合酶链反应(PCR)试剂盒购自美国Pierce公司,胰蛋白酶购自美国Gibco公司,Trizol试剂购自美国Invitrogen公司,反转录试剂盒购自美国Promega公司,syndecan-1抗体购自美国santa cruz公司,β-actin抗体、辣根过氧化物酶标记的二抗、免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。syndecan-1和GAPDH的引物由上海生工生物公司合成。
-
ARPE-19细胞购自美国种质保藏中心,细胞的冻存与复苏、鉴定、培养方法见文献[10]。细胞消化后接种于细胞爬片和培养板中,加入低糖DMEM培养液,待细胞融合近70%时,换为高糖DMEM培养液,分别于培养0 h、4 h、12 h和24 h时收集细胞,行RNA和蛋白提取。
-
细胞爬片用95%乙醇固定20 min,一抗为鼠抗人syndecan-1单克隆抗体,二抗为生物素化羊抗鼠IgG。实验步骤按试剂盒说明书进行,采用免疫组织化学SABC法染色,DAB显色。同时设PBS替代一抗的空白对照。结果判断:以背景清晰、细胞质呈棕黄色为阳性,无棕黄色为阴性。
-
按Trizol试剂说明书提取细胞总RNA并测定浓度,反转录合成cDNA。按照说明书加入cDNA及混合物在PCR仪上进行扩增,每组设置3个复孔。引物序列为:syndecan-1上游5′-GGC TGT AGT CCT GCC AGA AG-3′,下游5′-GTC GTT GAG GCC TGA TGA GT-3′[4];GAPDH上游5′-CAG GAG GCA TTG CTG A TGAT-3′,下游5′-GAA GGC TGG GGC TCA TTT-3′。GAPDH作为内参,按照2-ΔΔCt计算syndecan-1 mRNA的相对表达量。
-
收集的细胞加入适量的细胞裂解液于冰上反应15 min,提取细胞总蛋白。二羧基二喹啉蛋白定量试剂盒检测蛋白浓度。取30 μg总蛋白样品液进行7.5%聚丙烯酰胺凝胶电泳,30 mA恒流转印4 h。5%牛血清蛋白溶液室温孵育1 h,syndecan-1抗体4 ℃过夜,含0.05%吐温的三乙醇胺缓冲液洗膜,辣根过氧化物酶标记的二抗室温孵育1 h,含0.05%吐温的三乙醇胺缓冲液洗膜,增强化学发光显影。
-
采用单因素方差分析。
-
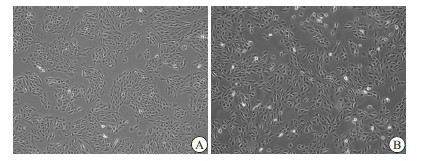
正常培养的人RPE细胞排列规则,单层生长,呈多角形,细胞质透明,细胞核呈圆形或卵圆形,核仁明显,边界清晰(见图 1A)。高糖刺激后,RPE细胞排列紊乱,细胞间隙增大、疏松,细胞体变长变大,脱落细胞多见(见图 1B)。
-
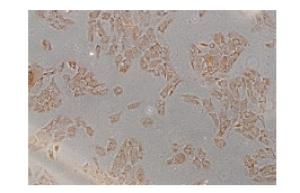
在未受高糖刺激的正常RPE细胞中,syndecan-1呈阳性表达,且定位于细胞质(见图 2)。
-
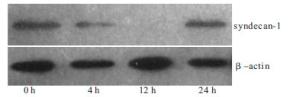
高糖刺激0 h、4 h、12 h和24 h,syndecan-1蛋白的表达水平分别为0.76±0.03、0.65±0.03、0.07±0.01、0.73±0.02;高糖刺激后,细胞syndecan-1表达开始下降,于刺激12 h时表达降至最低,于刺激24 h时syndecan-1的表达基本恢复至正常水平(F=644.31,P < 0.01)(见图 3)。
-
高糖刺激0 h、4 h、12 h和24 h,syndecan-1 mRNA的表达水平分别为0.73±0.03、0.55±0.05、0.06±0.01、0.67±0.07,高糖刺激4 h后,RPE细胞syndecan-1 mRNA的表达开始减弱,于12 h时表达降至最低,随后开始升高并于刺激24 h时基本恢复至正常水平(F=157.40,P < 0.01)。
-
RPE位于外层视网膜,依靠细胞间的紧密连接构成血视网膜屏障,在脉络膜和视网膜细胞之间转运水、电解质和营养物质等。由于RPE细胞可转运大量葡萄糖为视网膜神经感觉层提供能量,因而极易受到血糖波动的影响,发生病理和功能的改变[11]。研究[12-13]表明,RPE细胞是增生性糖尿病视网膜病变增殖膜中的细胞成分之一。尽管糖尿病视网膜病变的发病机制尚未完全阐明,但持续的高血糖和缺氧造成RPE细胞损伤和紧密连接的破坏、进而导致视网膜屏障的崩塌是糖尿病视网膜病变发生发展的重要因素[14]。
syndecan-1是syndecan家族的重要成员,覆盖于上皮细胞和内皮细胞的表面,调控细胞的分化、黏附和移行。我们前期的研究[7, 15-16]表明,syndecan-1参与RPE细胞的生理病理过程,参与糖尿病视网膜病变等眼病的发生发展[8, 9, 17-18]。本研究发现,高糖可下调RPE细胞syndecan-1的表达,这与前期的增生性糖尿病视网膜病变的视网膜增殖膜的研究结果一致。syndecan-1表达量的减少或缺失可使细胞间连接减弱,细胞形态或表型发生转变,可使上皮细胞发生间质转化,细胞的移行加速[19-20]。我们分析,高糖下调RPE细胞syndecan-1的表达可导致细胞发生间质转化,细胞形态转变,进而细胞间及细胞与基质间的黏附力减弱,从而导致了视网膜屏障的结构破坏及功能损毁;另一方面,RPE细胞间质变后,会迁移、增生、转化为成纤维细胞,进而参与视网膜增殖膜的形成。但本研究发现,高糖只是暂时减弱了RPE细胞syndecan-1的表达。可能因为体外25 mmol/L葡萄糖实验不能完全模拟糖尿病眼部的情况,因而后续需要更深入的系列研究来明确syndecan-1、RPE细胞及糖尿病视网膜病变的关系。
总之,我们的结果表明高糖可暂时下调体外培养的人RPE细胞syndecan-1的表达,但syndecan-1在其中的确切作用及其与其他因素之间的相互作用等都有待于进一步研究。通过这些机制的研究,将会对糖尿病视网膜病变的防治提供新的思路。
高糖对人视网膜色素上皮细胞syndecan-1表达的影响
Effect of high glucose on the expression level of syndecan-1 in human retinal pigment epithelial cells
-
摘要:
目的检测高糖对视网膜色素上皮(RPE)细胞syndecan-1表达的影响。 方法25 mmol/L高糖刺激人RPE细胞4 h、12 h和24 h,分别采用免疫组织化学和蛋白印迹法检测细胞syndecan-1蛋白的表达,采用实时定量聚合酶链反应检测syndecan-1 mRNA的表达。 结果高糖刺激后,RPE细胞排列紊乱,细胞体变长变大,脱落细胞多见。正常RPE细胞表达syndecan-1,且定位于细胞质。高糖刺激4 h,RPE细胞syndecan-1的蛋白和mRNA表达开始下降,12 h时表达降至最低,24 h时syndecan-1的表达基本回复至正常水平(P < 0.01)。 结论高糖可短暂下调RPE细胞syndecan-1蛋白和mRNA的表达。 -
关键词:
- 视网膜色素上皮细胞 /
- 高血糖 /
- syndecan-1
Abstract:ObjectiveTo detect the effects of high glucose on the expression level of syndecan-1 in human retinal pigment epithelial(RPE) cells. MethodsThe RPE cells were treated with 25 mmol/L glucose for 4 h, 12 h and 24 h, respectively.The protein and mRNA expression levels of syndecan-1 were detected using immunohistochemistry staining and Western blot, and quantitative real-time polymerase chain reaction(qPCR), respectively. ResultsAfter exposure to high glucose, the RPE cells were arranged in disorder, the cell bodies became longer and larger, the shedding cells were easily seen.The syndecan-1 expression was detected in normal RPE cells, and located in cytoplasm.After 4 h of treatment with high glucose, the expression levels of syndecan-1 protein and mRNA decreased, decreased to the minimum at 12 h, and basically returned to the normal level at 24 h(P < 0.01). ConclusionsHigh glucose can transiently down-regulate the syndecan-1 protein and mRNA expression in RPE cells. -
Key words:
- retinal pigment epithelial cell /
- high glucose /
- syndecan-1
-
[1] 王素常, 李甦雁.增生型糖尿病视网膜病变病人泪液分泌的研究[J].徐州医学院学报, 2017, 37(5):315. doi: 10.3969/j.issn.1000-2065.2017.05.008 [2] 韩小霞, 惠延年, 宋虎平, 等.曲安奈德对高糖培养人视网膜色素上皮细胞细胞间黏附分子-1表达的影响[J].国际眼科杂志, 2006, 6(3):596. doi: 10.3969/j.issn.1672-5123.2006.03.025 [3] 姚毅, 关明, 赵秀琴, 等.缺氧和高浓度葡萄糖对体外培养人视网膜色素上皮衍生因子表达的影响[J].中华医学杂志, 2003, 83(22):1989. doi: 10.3760/j:issn:0376-2491.2003.22.015 [4] WANG JB, ZHANG YJ, GUAN J, et al.Enhanced syndecan-1 expression on neutrophils in patients with type 2 diabetes mellitus[J].Acta Diabetol, 2012, 49(1):41. doi: 10.1007/s00592-011-0265-1 [5] WANG JB, ZHANG YJ, ZHANG Y, et al.Negative correlation between serum syndecan-1 and apolipoprotein A1 in patients with type 2 diabetes mellitus[J].Acta Diabetol, 2013, 50(2):111. doi: 10.1007/s00592-010-0216-2 [6] WANG JB, GUAN J, SHEN J, et al.Insulin increases shedding of syndecan-1 in the serum of patients with type 2 diabetes mellitus[J].Diabetes Res Clin Pract, 2009, 86(2):83. doi: 10.1016/j.diabres.2009.08.002 [7] 王静波, 惠延年, 韩泉洪, 等.细胞因子对人视网膜色素上皮细胞syndecan-1的影响[J].中华眼底病杂志, 2006, 22(2):113. doi: 10.3760/j.issn:1005-1015.2006.02.013 [8] 王静波, 宋宗明, 孙吉君.糖尿病视网膜病变病人玻璃体液中syndecan-1及上皮中性粒细胞活化肽78的表达[J].临床眼科杂志, 2013, 21(6):481. [9] 王静波, 余欢龙.syndecan-1在糖尿病视网膜中的表达[J].国际眼科杂, 2013, 13(4):660. [10] 王雨生, 严密, 扬扶华.视网膜色素上皮细胞培养技术及其应用[J].中华眼底病杂志, 1994, 10(2):124. [11] 韩小霞, 郭长梅, 惠延年, 等.曲安奈德对高糖培养RPE细胞ICAM-1和ILK表达的影响[J].眼科新进展, 2010, 30(12):1111. [12] 毕文娇, 李睿姝, 侯定善, 等.高糖对人视网膜色素上皮细胞神经钙黏连蛋白和纤维连接蛋白表达的影响[J].国际眼科杂志, 2014, 14(9):1578. [13] 许艺民, 冯云, 马志中.PDR、PVR增生膜组织超微结构及生长因子受体表达生物学特点的比较研究[J].眼科研究, 2005, 23(2):147. doi: 10.3760/cma.j.issn.2095-0160.2005.02.010 [14] 蔡莉, 易敬林.视网膜色素上皮细胞损伤机制研究进展[J].眼科新进展, 2012, 32(9):898. [15] 王静波, 惠延年, 韩泉洪, 等.细胞因子对人视网膜色素上皮细胞syndecan-1表达的影响[J].中华眼底病杂志, 2006, 22(2):113. doi: 10.3760/j.issn:1005-1015.2006.02.013 [16] 王静波, 惠延年, 马吉献, 等.syndecan-1在增生性玻璃体视网膜病变增生膜中的表达[J].眼科研究, 2004, 22:474. doi: 10.3760/cma.j.issn.2095-0160.2004.05.035 [17] WANG JB, TIAN CW, GUO CM, et al.Increased levels of soluble syndecan-1 in the subretinal fluid and the vitreous of eyes with rhegmatogenous retinal detachment[J].Curr Eye Res, 2008, 33(1):101. doi: 10.1080/02713680701809272 [18] 胡永亮, 王静波, 周历, 等.胰岛素对人视网膜微血管内皮细胞syndecan-1的表达及细胞通透性和增殖的影响[J].国际眼科杂志, 2018, 18(8):1381. [19] ALEXOPOULOU AN, MULTHAUPT HA, COUCHMAN JR.Syndecans in wound healing, inflammation and vascular biology[J].Int J Biochem Cell Biol, 2007, 39(3):505. doi: 10.1016/j.biocel.2006.10.014 [20] KATO M, SAUNDERS S, NGUYEN H, et al.Loss of cell surface syndecan-1 causes epithelial cells to transform into anchorage-independent mesenchyme-like cells[J].Mol Biol Cell, 1995, 6:559. doi: 10.1091/mbc.6.5.559 -




 下载:
下载: