-
染色体病是一种常见的遗传病, 它是由于机体内外环境因素导致的染色体数目异常或结构畸变[1]。染色体结构异常但表型正常的携带者后续临床表现可能包括流产、死胎、新生儿死亡、新生儿智力低下、胎儿畸形等, 且出现畸形儿或新生儿智力低下的可能性达到100%[2-4]。提高人口素质, 降低出生缺陷是我国的民生工程, 因此各个地区已经广泛开展了染色体分析技术, 其中外周血淋巴细胞染色体核型分析已成为优生优育、产前诊断、辅助生殖的常规检测项目; 同时也是研究染色体与临床疾病关系的重要手段[5-6]。由于外周血淋巴细胞染色体核型分析实验操作过程比较繁琐, 影响因素很多, 各实验室的染色体培养、制备效果也有所不同。如何稳定获得形态良好、长度适宜、分散较好、足量的中期分裂象染色体依然是遗传学实验室亟待解决的一个问题。本实验室通过对外周血淋巴细胞染色体培养这个环节进行改良, 取得了不错的效果。现将改良的培养方法作一报道。
-
选取2018年3月来本院进行遗传咨询并行外周血染色体核型分析的病人共40例, 每例病人均取肝素抗凝静脉血2份, 1份为改良组, 1份为传统方法对照组。
-
CO2培养箱为上海力申公司生产, 水浴箱为上海博讯公司产品, 低速离心机由安徽中科中佳生产, 超净工作台为苏州净化公司产品, CX41显微镜为Olympus公司产品, 淋巴细胞培养基和秋水仙素为广州达晖公司生产, 胰蛋白酶为美国Ampesco公司生产, 姬姆萨染液为深圳亿立方公司产品, 甲醇、冰醋酸、KCl、NaCl、KH2PO4、Na2HPO4等均为国产试剂。
-
改良组将肝素抗凝血2000r/min离心7min后, 用无菌滴管吸取上层的血浆和白细胞层, 然后再混匀取0.3mL加人淋巴细胞培养基中培养68~72h(注意无菌操作)。对照组肝素抗凝血0.5mL加入淋巴细胞培养基中培养68~72h。
-
收获前1.5h加20mg/L秋水仙素100μL, 将培养的细胞移入15mL刻度离心管中, 2000r/min离心7min后, 弃上清液, 加入已预温的5.587g/L氯化钾溶液7mL, 吹打均匀后置于37℃水浴箱中温育30min, 取出离心管加入新鲜配制的固定液(甲醇:冰乙酸=3:1)1mL[7], 轻轻混匀后放置室温5min(预固定)。2000r/min离心7min后, 弃上清液, 再加入固定液7mL, 固定10min后, 重复上述步骤再固定一次。离心后弃上清液, 再加入1.5~2mL的固定液, 调成合适浓度的细胞悬液, 以看不见明显混浊为宜。在温度25~28℃, 湿度50%~60%的条件下, 将细胞悬液滴在预冷的洁净的湿片上。将滴好的玻片放在烤箱70℃烘烤3h, 自然冷却至37℃。
-
将老化的玻片按常规G显带操作, 并参照国际染色体G显带标准对染色体进行分析。将0.01g胰酶加入到50mL pH 7.2的缓冲液中; 姬姆萨染液4mL加磷酸盐缓冲液至50mL; 0.9%氯化钠溶液备用(用于胰酶消化后清洗)。以上试剂均需预温至37℃备用。染色前需预染, 最佳时间为40s。
-
不合格标本:染色体长度较短, 染色体带纹不清, 但可以辨认出2号、4号、6号、12号、18号、20号、22号染色体特征性带型; 合格标本:可以清楚地辨认2号、4号、6号、12号、18号、20号、22号染色体特征性带纹, 其中染色体可分析且长度较理想的核型5%~25%;最佳标本:在合格标本上, 染色体可分析且长度理想的核型≥ 25%。
-
采用组内配对χ2检验。
-
改良组标本全部培养成功, 成功率为100%。对照组培养成功39例, 成功率为97.5%。改良组与对照组的培养成功率差异无统计学意义(P>0.05)。每份标本观察100个分裂象, 计算≥ 400条带分裂象所占的百分比, 结果显示, 改良组高于对照组(P < 0.01)(见表 1)。
分组 n 培养成功 ≥ 400条带 改良组 40 40(100.0) 1 980(49.5) 对照组 40 39(97.5) 1 300(32.5) P - >0.05* < 0.01* *示组内配对χ2检验 表 1 2组培养方法成功率与分裂象显带的比较[n; 百分率(%)]
-
改良组带型的合格率与最佳率均高于对照组(P < 0.05和P < 0.01) (见表 2)。
分组 n 最佳 合格 不合格 合格率/% 最佳率/分% 改良组 40 30 9 1 97.5 75.0 对照组 40 4 27 9 77.5 10.0 P - - - - < 0.05* < 0.01* *示组内配对χ2检验 表 2 2组染色体显带效果的比较
-
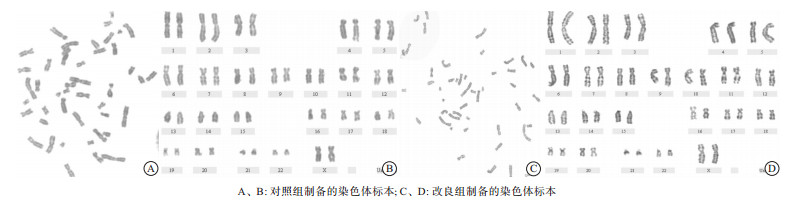
与对照组相比, 改良后的外周血染色体分散度好, 分裂相多, 长度更长, 带型清晰(见图 1)。改良后染色体长度更长, 分散度更好, 显示带型增多。
-
随着科学技术的发展, 人们对保健知识及优生优育意识的不断增强, 染色体分析技术在优生优育和遗传疾病的诊断得到了广泛的应用[8-9], 而制备出高质量的染色体核型则是细胞遗传学研究的基础。传统的外周血淋巴细胞培养是一个复杂、繁琐并且重复的过程, 它包括细胞培养、细胞低渗、细胞固定、细胞滴片、细胞老化和显带等步骤, 实验过程中若有一个操作环节出现失误, 就极有可能导致实验的失败, 所以在本实验中, 细胞培养环节至关重要。本文就是针对细胞培养环节进行了改良。参照其他实验室或文献提供的方法, 外周血淋巴细胞培养的时间一般为68~72h, 用肝素抗凝全血进行培养。本实验室采用血浆和白细胞层进行培养。结果显示:改良培养方法不仅成功率得到提高, 而且染色体长度、带型也得到了很大程度的改善。其中, 染色体长度、带型的改善可能是红细胞在生长过程中无氧酵解, 不断释放CO2并产酸, 使培养基pH发生变化, 影响了淋巴细胞的活性, 从而干扰其分裂。而本试验是去除了红细胞的干扰, 保留了血浆, 从而保证了淋巴细胞在分裂过程中有充足的营养, 所以改良后培养的染色体比较长。因而染色体越长则带纹越清晰, 分辨率越高, 从而获得了大量的400条带以上的分裂象。
总之, 通过处理外周血标本然后进行淋巴细胞染色体培养, 不仅得到了高质量的中期染色体核型, 还有助于后续的显带和核型分析, 从而提高诊断结果的准确性, 有较好的应用和推广价值。
改良外周血染色体培养效果的评价
Evaluation of the improved chromosome culture in peripheral blood
-
摘要:
目的探讨一种改良的外周血染色体培养方法的可行性。 方法将40例外周血细胞染色体同时用改良方法(改良组)和传统方法(对照组)培养进行比较。改良组将肝素抗凝血低速离心,无菌操作直接吸取上层的血浆和白细胞混匀,加入淋巴细胞培养液进行培养;常规组将肝素抗凝血直接加入淋巴细胞培养液混匀。将上述两种细胞混悬液分别置37℃体外培养68~72h收获染色体,G显带,评价2组染色体培养成功率、分裂象数量、图像质量与染色体长度,对结果进行统计学分析。 结果改良组≥ 400条带者(49.5%)高于对照组(32.5%)(P < 0.01);改良组带型的合格率与最佳率均高于对照组(P < 0.05和P < 0.01);改良后的外周血染色体分散度更好,分裂相更多,长度更长,带型更加清晰。 结论改良组因去除红细胞对染色体培养的影响,染色体染色效果及显带质量均明显提升。 Abstract:ObjectiveTo explore the feasibility of an improved chromosome culture method in peripheral blood. MethodsThe cell chromosomes in 40 peripheral blood specimens were cultured using the modified method(modified group) and traditional method(control group) at the same time.In the modified group, the heparin anticoagulant blood was centrifuged at low speed, and the upper layer of plasma and leukocytes were directly sucked up by aseptic operation, and then cultured in lymphocyte culture medium.In the control group, the heparin anticoagulant blood was directly cultured using lymphocyte culture medium.The cell suspensions of two groups were cultured in vitro at 37℃ for 68 to 72 h, the chromosomes were harvested, and G banding was displayed.The success rate of chromosome culture, number of mitotic figure, figure quality and chromosome length in two groups were evaluated, and the results of which were statistically analyzed. ResultsThe rate of ≥ 400 bands in modified group(49.5%) was higher than that in control group(32.5%) (P < 0.01).The qualified rate and best rate of belt type in modified group were higher than those in control group(P < 0.05 and P < 0.01).The better dispersion, more splitting phase, longer length and clearer band pattern of peripheral blood chromosomes in modified group were identified. ConclusionsBecause of removing the effects of red blood cells on chromosome culture, the chromosome staining and banding quality are obviously improved. -
Key words:
- peripheral blood /
- lymphocyte /
- chromosome culture /
- mitotic figure
-
表 1 2组培养方法成功率与分裂象显带的比较[n; 百分率(%)]
分组 n 培养成功 ≥ 400条带 改良组 40 40(100.0) 1 980(49.5) 对照组 40 39(97.5) 1 300(32.5) P - >0.05* < 0.01* *示组内配对χ2检验 表 2 2组染色体显带效果的比较
分组 n 最佳 合格 不合格 合格率/% 最佳率/分% 改良组 40 30 9 1 97.5 75.0 对照组 40 4 27 9 77.5 10.0 P - - - - < 0.05* < 0.01* *示组内配对χ2检验 -
[1] 陈继华.不孕、不良孕产史夫妇320例染色体核型检测分析[J].中国计划生育学杂志, 2015, 23(4):260. [2] 杨冬冬.500例有不良孕产史及不育不孕患者外周血染色体分析[J].医药前沿, 2016, 6(7):158. [3] 杨春凤, 张建平.复发性流产相关染色体异常问题[J].中国实用妇科与产科杂志, 2015, 31(9):876. [4] 薛继红, 慕明涛.40例智力低下儿外周血淋巴细胞染色体畸变及细胞微核检测与分析[J].山东医药, 2015, 55(15):86. [5] 潘成云, 许娜, 何柏林, 等.细胞遗传学检测在慢性髓性白血病中的临床意义[J].中华血液学杂志, 2017, 38(2):112. [6] 赵娜, 冯玲, 杨宇石, 等.乳腺和导管增生病变与17p染色体的遗传学不稳定关系[J].现代预防医学, 2017, 44(4):750. [7] 斯佩克特·戈德曼·莱因万德.生物学指南[M].黄培堂, 译.北京: 科学出版社, 2002: 1067. [8] 倪蓉, 梁健, 邱峰龙, 等.胚胎停育160对夫妇的染色体核型分析[J].中国临床研究, 2017, 30(2):242. [9] 蔡晓晖.7212对新婚夫妇外周血淋巴细胞染色体分析[J].中国优生与遗传杂志, 2015, 23(8):65. -





 下载:
下载: