-
支气管肺泡干细胞(bronchioalveolar stem cells,BASCSs)是一类位于终末细支气管和肺泡交界处的肺组织固有的干细胞,它对于支气管和肺泡的修复与再生具有十分重要的意义[1-2]。肺腺癌起源于BASCSs的恶性转化[3-6],而在特发性肺纤维化中,肺组织中的BASCSs数量下降[7]。BASCSs的研究对于揭示肺纤维化和肺癌的发病机制具有十分重要的意义[8-9]。本研究拟建立BASCSs的纯化与体外三维培养体系, 为进一步研究BASCSs的相关特性奠定实验基础。
-
仪器:CO2细胞培养箱(Thermo,美国);倒置相差显微镜(Olympus,日本);流式细胞仪(FACSCanto Ⅱ,美国BD公司)。试剂:DMEM/F12培养基(美国Gibco公司),DMEM(高糖)培养基、胎牛血清(FBS)(美国Gibco公司),Elastase (美国Worthington Biochemical公司),0.2 mmol/L EGTA-1×PBS、1×PBS、1×HBSS+、DNase (200 U/mL)、2.5 g/L胰酶-EDTA、Matrigel (美国BD公司),7-Aminoactinomycin D(7-AAD)、CD45-biotin、CD31-biotin、CD34-biotin、APC eFluor 780-streptavidin (美国eBioscience公司),Insulin/transferrin/selenium(ITS) (美国Invitrogen公司),Sca-1-AlexaFluor 647、EpCAM-PE-Cy7 (美国Biolegend公司),SB431542(美国Ascent Scientific LLC公司),小鼠肺成纤维细胞Mlg2908(美国ATCC),12孔Transwell小室(美国Becton公司)。实验动物:健康雄性C57BL6小鼠[斯贝福(北京)生物技术有限公司提供],体质量18~20 g,清洁级,实验过程按照《关于善待实验动物的指导性意见》处理实验动物[10]。
-
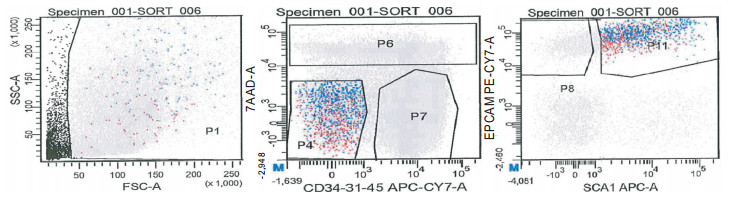
(1) 小鼠用100 g/L水合氯醛腹腔麻醉,75%乙醇消毒,在超净台中剪开腹腔,腹主动脉放血处死。剪开胸腔,注意保持肺脏完整。(2)剪开下腔静脉,向右心室内注射10 mL的1×PBS,以冲洗肺脏血管。(3)气管插管,以0.2 mmol/L EGTA-1×PBS 1 mL进行肺泡灌洗,重复4次。小心取出心脏和肺脏,注意保持肺脏完整。(4)经气管向肺内注入1 mL Elastase(4 U/mL),37℃孵育5 min。然后经气管向肺内注入0.5 mL Elastase(4 U/mL),37 ℃孵育5 min,重复4次(共注入肺脏3 mLElastase溶液)。(5)取出消化好的肺脏,剪取肺叶,置于无菌细胞培养皿中,用剪刀剪碎肺组织至2 mm3,再用手术刀片切碎。(6)加入5 mL浓度为200 U/mL的DNAseⅠ溶液,37 ℃孵育15 min。(7)加入4 ℃的1×HBSS+液10 mL,以吸管反复吹打组织块,使其尽量分散,然后过75μm细胞筛,收集细胞悬液,以20 mL 4 ℃的1×HBSS+液洗涤组织块,并用研磨棒轻研组织块,以获得更多细胞。(8)2500 r/min,4 ℃离心5 min,弃上清液,拍松细胞。(9)加入1 mL ddH2O,45 s左右加1 mL 2×HBSS+液,再加入4 ℃的1×HBSS+液20 mL。(10)2500 r/min,4 ℃离心5 min,弃上清液,拍松细胞。加入4 ℃的1×HBSS+液0.5 mL,以台盼蓝液进行细胞计数。调细胞浓度至1×107个/毫升。(11)向细胞悬液中加入下列抗体:CD45-biotin (稀释度1:200),CD31-biotin(稀释度2.5-100),CD34-biotin(稀释度6.5:100),Sca-1-AlexaFluor 647(稀释度1:200),EpCAM-PE-Cy7(稀释度1:200),4 ℃避光孵育45 min。(12)加入5 mL 4 ℃的1×HBSS+液2 mL,混匀,600 g,4 ℃离心5 min,弃上清液,拍松细胞。加4 ℃的1×HBSS+液0.5 mL。(13)向细胞悬液中加入APC eFluor 780-streptavidin 5 μL,4 ℃避光孵育30 min。(14)加入5 mL 4 ℃的1×HBSS+液2 mL,混匀,600 g,4 ℃离心5 min,弃上清液,拍松细胞。加4 ℃的1×HBSS+液1 mL。(15)加入7-AAD 150 μL,15 min后,用流式细胞仪检测并分选BASCSs(CD31-CD34- CD45-SCA-1+EpCAM+细胞)。分选后用流式细胞仪鉴定BASCSs纯度。
-
(1) 将小鼠肺成纤维细胞系Mlg2908,以DMEM(高糖)培养基+100 mL/L FBS,培养于37 ℃、50 mL/LCO2细胞培养箱中。(2)BASCSs基础培养基:DMEM/F12培养基,含100 mL/L FBS,10 mL/L ITS液,0.25 mg/mL amphotericin B,100 IU/mL penicillin,100 mg/mL streptomycin和10 mmol/L SB431542。(3)将Mlg2908细胞和分选得到的BASCSs按1×103:1×106的比例混匀,与等体积的Matrigel混匀,加入Transwell小室中,注意勿产生气泡。(4)将Transwell小室放入细胞培养板中,将培养板置于37 ℃、50 mL/L CO2细胞培养箱中5 min,使Matirgel凝固。(5)向培养板下孔中加入BASCSs基础培养基至液面达Matrigel上表面。(6)将上述培养体系置于37 ℃、50 mL/L CO2细胞培养箱中培养7 d,隔日换液。(7)第7天在倒置显微镜下拍照,并拼合照片。
-
通过Elastase酶消化肺组织,每只成年小鼠可得到有核细胞总数(1.6~1.8)×107个,流式细胞技术显示,CD31-CD34- CD45-SCA-1+EpCAM+细胞约占EpCAM+细胞的22 %(见图 1)。取部分分选得到的细胞经流式细胞技术再次鉴定,CD31-CD34- CD45- SCA-1+ EpCAM+细胞纯度大于90%(见图 2)。
-
BASCSs与成纤维细胞混合培养于Matrigel中,第4日,可见小圆形的克隆形成,周围围绕着成纤维细胞(见图 3);继续培养,克隆体积增大,但数量逐渐减少,至第8日,大部分克隆直径可达50 μm,形态各异,克隆与其他区域对比明显(见图 4)。
-
2005年由KIM等[6]首先在小鼠肺支气管肺泡连接区发现了BASCSs。BASCSs是维持Clara细胞和肺泡上皮细胞更新的基础。目前认为,BASCSs表达分泌珠蛋白家族成员1A1 (SCGB1A1)和肺泡表面活性蛋白C(SP-C),特异细胞表面标志是干细胞抗原(SCA-1)和上皮细胞黏附分子(EpCAM),其细胞表型为CD31-CD34- CD45-SCA-1+EpCAM+。
由于肺部结构复杂,且肺上皮细胞更新率较低,使得BASCSs的分离提取、鉴定与体外研究都面临着较大的困难。近年来,随着细胞培养技术的日益进步,已经能够在体外进行BASCSs的三维培养[18]。我们参考国外同行实验方法,在建立了小鼠BASCSs的分离、鉴定和三维培养方法的过程中,获得了一些心得体会。
-
文献中报道可用于分离BASCSs的消化方法主要有以下几种:collagenase dispase序贯消化[19],dispase、collagenase/dispase混合酶序贯消化[20]和Elastase分次注入消化[11]。我们比较了这三种消化方法,结果以Elastase分次注入消化获得的有核细胞数量最多,所以选用该消化法。
-
BASCSs处于终末细支气管和肺泡的交界处,而且数量较少,用常规的酶消化法难以制备。其分离的关键在于让酶能够充分作用于终末细支气管和肺泡的交界处。所以我们采用了分次肺脏酶灌注法。其操作的要点是:(1)获得完整肺脏,如果肺脏被膜有破损,酶液漏出,会导致分离到的BASCSs数量大大下降。为此,解剖肺脏时务必十分小心,特别注意不要让肋骨残端刺破肺脏被膜;(2)要尽量切碎组织,组织块越小越好,这样才能使更多的BASCSs分散到分离液中,但不能在细胞筛上研碎组织,吹打组织悬液时也要温和操作,否则细胞容易破碎;(3)所有操作尽量在冰上进行,尽可能缩短操作时间,以保证尽可能多的细胞存活。
-
细胞分离的过程中,不可避免地会混入红细胞。过多的红细胞混入会影响CD31、CD34、CD45抗体染色结果。所以,在染色前需要去除红细胞。文献中最常见的去除红细胞的办法是用红细胞裂解液[21]。另一种方法是利用红细胞对低渗液的敏感度高于有核细胞的特点,用双蒸水短暂处理细胞悬液,然后加入等体积的两倍浓度的培养基恢复渗透压。通过比较BASCSs的三维培养结果,两种方法差别不大,第二种方法操作更便捷,而且可以避免红细胞裂解液中的一些成分对BASCSs产生影响的可能。所以在实验中采用了第二种方法。
-
BASCSs在三维培养中会逐步分化,形成克隆。培养的时间可达15 d,但最佳观察时间在7 d左右。细胞培养操作要点如下:(1)三维培养的时间较长,一定要注意预防污染,特别是真菌污染,必要时可以添加真菌抑制剂;(2)在三维培养体系中,肺成纤维细胞生长速度远远高于BASCSs,所以一定要加入成纤维细胞抑制剂SB431542;(3)将细胞与Matrigel混合的操作务必在冰上,否则Matrigel容易凝固,堵塞吸头;(4)为使Matrigel上表面附近的克隆能够正常生长,可以向Matrigel表面滴1滴培养基。培养板下孔中的培养基液面可以略高于Matrigel上表面。
通过对相关文献的比较与实验,我们探索出一套适合小鼠BASCSs的分离、鉴定与三维培养的实验体系。最佳分离方法,即用Elastase分次注入消化,此法获得的有核细胞数量最多。分离要点为:肺脏须完整,不要让肋骨残端刺破肺脏被膜;尽量切碎组织,吹打组织悬液时也要温和操作;所有操作尽量在冰上进行,尽可能缩短操作时间;用双蒸水短暂处理细胞悬液,然后加入等体积的两倍浓度的培养基恢复渗透压,以去除多余的红细胞。鉴定方法:用流式细胞仪检测并分选,分选后用流式细胞仪鉴定BASCSs纯度。三维培养时,要注意预防污染,特别是真菌污染;要加入成纤维细胞抑制剂SB431542;务必在冰上将细胞与Matrigel混合;可使培养基浸润于Matrigel表面,以使其附近的克隆能够正常生长。该方法简单高效,能够为进一步研究BASCSs的相关特性奠定实验基础。
小鼠支气管肺泡干细胞的分离、鉴定与三维培养体系的构建
Isolation, identification and construction of three-dimensional culture system of mouse bronchoalveolar stem cells
-
摘要:
目的探讨C57BL6小鼠支气管肺泡干细胞(BASCSs)体外分离、鉴定及其三维培养体系的构建方法,为进一步研究BASCSs的相关特性奠定实验基础。 方法选用C57BL6成年雄鼠,完整分离肺组织,1×PBS灌洗后,经支气管分次灌注Elastase酶进行消化,以锐器切碎肺组织,加入DNA酶使细胞更好地分散开。用75 μm细胞筛去除未消化的组织块,所得细胞悬液以荧光标记的CD31、CD34、CD45、SCA-1、EpCAM抗体染色,流式细胞仪分选CD31-CD34-CD45-SCA-1+EpCAM+细胞,细胞与Mlg2908细胞(小鼠肺成纤维细胞株)按(1×103):(1×106)的比例混合,以Matrigel为基质构建三维培养体系。 结果通过Elastase酶消化肺组织,每只成年小鼠可得到有核细胞总数(1.6~1.8)×107个,流式细胞技术结果显示,CD34- CD45- SCA-1+ EpCAM+细胞约占EpCAM+细胞的22%;将支气管肺泡干细胞、Mlg2908细胞和Matrigel混合培养,4d后可见克隆形成。随着培养时间延长,克隆数量逐渐减少。8d后大部分克隆直径达50 μm,形态出现分化,克隆可维持至15d。 结论建立了一种简单、高效的分离、鉴定及三维培养小鼠BASCSs的方法。 Abstract:ObjectiveTo explore the method of isolation, identification and three-dimensional culture system of bronchioalveolar stem cells (BASCSs) from C57BL6 mouse in vitro, so as to lay an experimental foundation for further study of related characteristics of BASCs. MethodsThe lung tissue of adult male C57BL6 mice was completely isolated, lavaged by 1×PBS, digested by Elastase solution perfused through the trachea.The lung tissue was cut up with a sharp instrument, the cells were better dispersed using DNA enzymes, and the undigested tissue was removed with 75 μm sieve.The cells suspensions were stained using the fluorescent labeled CD31, CD34, CD45, SCA-1 and EpCAM antibody.The CD31-CD34-CD45-SCA-1+ EpCAM+ cells were sorted out using flow cytometry, and mixed with Mlg2908 cells (mouse lung fibroblast cell line) at the ratio of (1×103):(1×106) to construct a three-dimensional culture system based on the Matrigel as matrix. ResultsThe lung tissue was obstained by Elastase digesting, the 1.6×107 to 1.8×107 nucleated cells were obtained from a mouse.The results of flow cytometry showed that the CD34- CD45- SCA-1+ EpCAM+ cells accounted for about 22% of EpCAM+ cells.BASCSs, Mlg2908 cells and Matrigel were mixed and cultured.After 4 d, the clone was observed.With the extension of culture time, the number of clones decreased gradually.After 8 days, most of the clones were 50 μm in diameter, differentiated in morphology, and could sustain for 14 d. ConclusionsA simple and efficient method for isolation, identification and three-dimensional culture of mouse BASCSs is successfully established. -
Key words:
- bronchioalveolar stem cell /
- cell isolation /
- three-dimensional-culture of cell /
- mouse
-
[1] TANAKA K, FUJITA T, UMEZAWA H, et al.Therapeutic effect of lung mixed culture-derived epithelial cells on lung fibrosis[J].Lab Invest, 2014, 94(11):1247. [2] LAU AN, GOODWIN M, KIM CF, et al.Stem cells and regenerative medicine in lung biology and diseases[J].Mol Ther, 2012, 20(6):1116. [3] OTSUBO K, GOTO H, NISHIO M, et al.MOB1-YAP1/TAZ-NKX2.1 axiscontrols bronchioalveolar cell differentiation, adhesion and tumourformation[J].Oncogene, 2017, 36(29):4201. [4] MCCARTHY N.Enforced compliance[J].Nat Rev Cancer, 2012, 12(3):152. [5] 买尔旦·赛力木, 阿里旦·艾尔肯, 金钟, 等.人肺腺癌干细胞表型与预后的相关性[J].中国组织工程研究, 2015, 19(10):1523. [6] KIM CF, JACKSON EL, WOOLFENDEN AE, et al.Identification of bronchioalveolarstem cells in normal lung and lung cancer[J].Cell, 2005, 121(6):823. [7] TAN JL, LAU SN, LEAW B, et al.Amnion epithelial cell-derived exosomes restrict lung injury and enhance endogenous lung repair[J].Stem Cells Transl Med, 2018, 7(2):180. [8] LEE JH, BHANG D, BEEDE A, et al.Lung stem cell differentiation in mice directed by endothelial cells via a BMP4-NFATc1-Thrombospondin-1 axis[J].Cell, 2014, 156(3):440. [9] XUE L, LI Y, XIN S, et al.The role of TGFβ-HGF-Smad4 axis in regulating the proliferation of mouse airway progenitor cells[J].Mol Med REP, 2017, 16(6):8155. [10] ZHANG YP, HUANG ZM, YU LJ, et al.Protective effects of tetramethylpyrazine on glutamate-induced neurotoxicity in mice[J].J Behav Brain Sci, 2012, 2(3):326. [11] TEISANU RM, CHEN HY, MATSUMOTO1 K, et al.Functional analysis of two distinct bronchiolar progenitors during lung injury and repair[J].Am J Respir Cell Mol Biol, 2011, 44(6):794. [12] CHEN H, MATSUMOTO K, BROCKWAY BL, et al.Airway epithelial progenitors are region specific and show differential responses to bleomycin-induced lung injury[J].Stem Cells, 2012, 30(9):1948. [13] ZHENG D, SOH BS, YIN L, et al.Differentiation of club cells to alveolar epithelial cells in vitro[J].Sci Rep, 2017, 7:41661. [14] FENG L, JINXI H, JUN W, et al.Diversity of epithelial stem cell types in adult lung[J].Stem Cells Int, 2015, 2015:728307. [15] ZHANG SB, SUN X, WU Q, et al.Impaired capacity of fibroblasts to support airway epithelial progenitors in bronchiolitis obliterans syndrome[J].Chin Med J(Engl), 2016, 129(17):2040. [16] FARIN AM, MANZO ND, KIRSCH DG, et al.Low-and high-LET radiation drives clonal expansion of lung progenitor cells in vivo[J].Radiat Res, 2015, 183(1):124. [17] BARKAUSKAS CE, CRONCE MJ, RACKLEY CR, et al.Type 2 alveolar cells are stem cells in adult lung[J].J Clin Invest, 2013, 123(7):3025. [18] CHOI J, LICH E, LEE JH.Organogenesis of adult lung in a dish:differentiation, disease and therapy[J].Dev Biol, 2016, 420(2):278. [19] SUMMER R, KOTTON DN, SUN X, et al.Side population cells and Bcrp1 expression in lung[J].Am J Physiol Lung Cell Mol Physiol, 2003, 285(1):L97. [20] BORTNICK AE, FAVARI E, TAO JQ, et al.Identification andcharacterization of rodent ABCA1 in isolated typeⅡpneumocytes[J].Am J Physiol Lung Cell Mol Physiol, 2003, 285(4):L869. [21] 詹茜, 万雪颖, 程伟, 等.红细胞裂解液CD34+细胞相对计数的影响及其原因初步探讨[J].重庆医科大学学报, 2019, 44(9):1229. -





 下载:
下载: