-
脊柱手术是目前治疗脊椎相关疾病的主要方法之一,在部分病人中,需要进行脊柱间融合,脊柱融合的稳定性也直接决定了手术远期预后[1-4]。而脊柱融合过程中需要选择适合的植骨材料,临床研究显示植骨过程中加入骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)能够加强脊柱融合的效果并降低手术出血等指标,但近年较多研究提示脊柱手术中加入BMP-2也会增加不良反应发生率,主要包括颈椎前部水肿、移植物发生沉降、骨质溶解以及手术相关感染等,骨溶解可引起手术节段终板的损坏以及骨量的流失,最终导致手术效果差[5-9]。骨溶解被认为与破骨细胞异常活化有关,BMP-2在破骨细胞异常活化中的作用机制尚无统一意见。基于此,本研究旨在探讨破骨细胞活化诱导骨溶解的机制。
-
选择3~5周龄雄性的C57小鼠30只(购自北京维通利华实验动物技术有限公司),动物合格证号为:SCXK(京),20180019,饲养于我院动物实验中心,自主进食和水。其中20只小鼠按照随机数字法分组,对照组和实验组各10只,剩余10只用于提取巨噬细胞(bone marrow-derived macrophages,BMMs)。实验涉及的动物伦理问题已经我院伦理委员会批准。
-
脱钙骨基质及小鼠BMP-2蛋白购自武汉艾美捷科技有限公司,RANKL试剂盒购自上海晶抗生物工程有限公司,M-CSF试剂盒购自长沙达尔锋生物科技有限公司,PCR试剂盒购自上海赛默飞世尔科技(中国)有限公司,Smad1蛋白一抗、p65蛋白一抗及二抗、Western blotting检测试剂盒购自苏州宇恒生物科技有限公司,TRAP试剂盒、BCA蛋白试剂盒购自美国Sigma公司,酶标仪购自北京普天新桥技术有限公司,PCR仪购自深圳市瑞安康医疗器械有限公司,凝胶电泳分析系统购自英国CLEAVER公司,光学显微镜购自上海玉研科学仪器有限公司,微型CT仪购自江苏平生医疗科技有限公司。
-
所有小鼠均接受脊柱后外侧入路的横突间融合手术,实验组植入脱钙骨基质和BMP-2,对照组植入骨松质。方法参照韩兴龙[10]的方案,具体方法为:3%浓度的戊巴比妥以50 mg/kg体质量计算用量,采用腹腔注射麻醉,麻醉后小鼠俯卧位放置于操作手术台上,去L4、L5棘突部位行长约15 mm的正中切口,再沿棘突侧面行一个左侧旁正中切口,钝性分离L4~L5椎旁肌,清除附着软组织充分显露L4及L5的横突并去除骨皮质,直至横突渗血,将脱钙骨基质修型,使其能够顺利固定在L4与L5的横突间,实验组加入BMP-2,对照组无处置,覆盖软组织并进行缝合,闭合切口,手术由一位操作能力强的医生完成,术后给予抗生素预防感染。
-
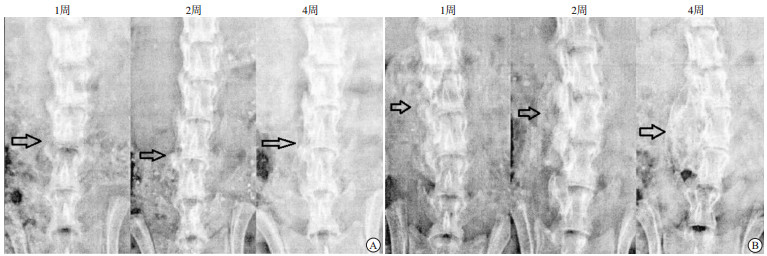
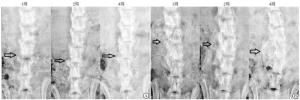
分别在手术后1周、2周、4周进行微型CT复查,观察椎间融合情况,留取图像资料,在CTAn软件中评估涉及的骨量、骨小梁厚度以及骨小梁间隙。
-
取10只C57小鼠采取颈椎脱臼法处死,剪开皮肤显露双下肢,剥离股骨及胫骨处上的其他组织,先从髋关节处分离下肢骨骼,注意保护好股骨头,并在膝关节处离断股骨和胫骨,清理干净,置于75%乙醇进行浸泡5 min,再置入含有双抗的PBS液中。用新剪刀剪开股骨及胫骨的一侧,用1 mL注射器吸取α-MEM培养基(含有双抗及10%PBS液)放置在另一侧,剪开另一侧股骨及胫骨的另一侧,推注混合液使其骨髓进入10 mL的培养皿中,并向培养皿中加入RANKL(50 ng/μL)及M-CSF(30 ng/mL),并在各个培养皿中加入不同浓度的BMP-2稀释液(0、30、60、90、120 ng/mL),用吸管吹打至均匀,放入培养箱中培养,培养条件为37 ℃、5%的CO2。培养5 d后全部换液继续培养,根据BMMs的细胞密度达到90%时接种至96孔板内,观察其破骨细胞情况待用。
-
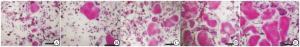
在冰箱中取出TRAP试剂盒恢复至室温,配置固定液,固定液成分为枸橼酸盐25 mL、丙酮65 mL及37%甲醛8 mL,按照操作说明配置TRAP显色液。取出BMMs诱导破骨细胞孔板,用PBS漂洗2次,孔内加入100 μL的细胞固定液,固定30 s后弃除,PBS漂洗2次。每孔内加入100 μL的TRAP染色液,37 ℃孵育1 h,弃除染色液,PBS漂洗2次。光镜下观察5个视野内的TRAP染色阳性细胞数及总面积。
-
待BMMs细胞诱导为破骨细胞后,应用RIPA裂解液进行细胞裂解,采用Trizol法进行细胞中总RNA的提取,并对RNA的纯度进行检测,提取20μg的总RNA,对提取的RNA反转录为cDNA,反转录操作参照反转录试剂盒的说明书要求。引物序列见表 1。PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环,循环完成后在72 ℃条件下继续延伸10 min。采用FS2000系统进行分析,并采用2-△△CT的方法计算BMP-2、Smad1及p65相对表达量。
引物名 引物序列 GAPDH 上游引物 5′-CAA GAG GTC CTG TCT TCA GAT GA-3′ 下游引物 5′-TCT GTT TCC GTT TCC TGG TTC-3′ BMP-2 上游引物 5′-GCA CCG TCA AGG CTG AGA AC-3′ 下游引物 5′-TGG TGA AGA CGC CAG TGG A-3′ Smad1 上游引物 5′-TAC GGA CGT CAG GTG CTC AGT TGC-3 下游引物 5′-CCA TGC TGT GAC GTC CTG CAG C-3′ p65 上游引物 5′-CTA TGG CAT GGT AGA CGG ATG CCA-3′ 下游引物 5′-CGG ATT CGG CAA GGT CTC AAT TGC-3′ 表 1 引物序列
-
取出BMMs诱导破骨细胞孔板,加入细胞裂解液在冰上进行裂解30 min,收集1.5 mL裂解后细胞溶液于离心管中,在预冷4 ℃的离心机中5 000 r/min离心5 min,取上清液,经95 ℃煮沸后,应用二喹啉甲酸法检测总蛋白浓度。提取40 μg的总蛋白,将其在120 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶中进行电泳分离,采用电转移法转移至聚偏氟乙烯膜上,在室温条件下用50 g/L的脱脂奶粉进行封闭2 h。加入稀释的Smad1蛋白一抗、p65蛋白一抗(1:1 000),在4 ℃条件下进行孵育备用。第2天用PBS液稀释洗涤孵育后的溶液,重复3次,然后加入稀释二抗(1:1 000稀释)孵育2 h,用PBS稀释液重复洗涤3次,然后用二氨基联苯胺显影液处理样本。采用Image J软件分析蛋白条带。
-
采用t检验、方差分析和q检验及相关分析。
-
2组小鼠接受脊柱后外侧入路的横突间融合手术后,实验组小鼠术后的脊柱融合情况强于对照组(见图 1)。2组小鼠术后1、2、4周骨小梁体积和骨小梁厚度均呈增高趋势,骨小梁间隙呈降低趋势(P<0.01)。实验组术后1、2、4周骨小梁体积高于对照组,实验组术后2、4周骨小梁间隙低于对照组(P<0.01),其余差异均无统计学意义(P>0.05)(见表 2)。
分组 n 1周 2周 4周 F P MS组内 骨小梁体积/mm3 对照组 10 0.030±0.006 0.056±0.003** 0.068±0.005**## 161.71 <0.01 0.000 实验组 10 0.071±0.004 0.121±0.019** 0.143±0.021**## 49.93 <0.01 0.000 t — 17.98 10.69 10.99 — — — P — <0.01 <0.01 <0.01 — — — 骨小梁厚度/mm 对照组 10 0.051±0.014 0.057±0.010 0.077±0.011**## 13.33 <0.01 0.000 实验组 10 0.049±0.011 0.053±0.002 0.074±0.009**## 26.26 <0.01 0.000 t — 0.36 1.24 0.67 — — — P — >0.05 >0.05 >0.05 — — — 骨小梁间隙/mm 对照组 10 0.093±0.013 0.074±0.012** 0.070±0.011** 10.44 <0.01 0.000 实验组 10 0.077±0.022 0.042±0.010** 0.032±0.007** 26.46 <0.01 0.000 t — 1.98 6.48 9.22 — — — P — >0.05 <0.01 <0.01 — — — q检验:与1周组比较** P<0.01;与2周组比较##P<0.01 表 2 脊柱融合术后骨小梁相关指标对比(x±s)
-
BMMs在不同浓度BMP-2、RANKL及M-CSF诱导5 d后破骨细胞结果见图 2。在BMP-2浓度为60、90及120 ng/mL时破骨细胞总数和总面积均高于BMP-2浓度为0、30 ng/mL时(P<0.01),而在BMP-2浓度为0与30 ng/mL时比较,差异无统计学意义(P>0.05),在BMP-2浓度为60、90及120 ng/mL时比较,差异无统计学意义(P>0.05)(见表 3)。
BMP-2浓度/ng/mL n 破骨细胞总数/个 破骨细胞总面积/(×103μm2) 0 10 76.65±6.39 2.67±0.65 30 10 79.18±7.39 2.89±0.77 60 10 113.43±9.10**## 6.15±0.89**## 90 10 105.92±8.85**## 5.72±0.78**## 120 10 110.27±8.77**## 5.52±0.68**## F — 47.12 48.43 P — <0.01 <0.01 MS组内 — 66.698 0.576 q检验:与0 ng/mL比较** P<0.01;与30 ng/mL比较##P<0.01 表 3 不同浓度BMP-2诱导下破骨细胞总数量及总面积(x±s)
-
BMP-2诱导破骨细胞BMP-2 mRNA表达的在0 ng/mL与30 ng/mL比较,差异无统计学意义(P>0.05),在其余浓度间比较差异具有统计学意义(P<0.01);Smad1 mRNA表达在不同浓度BMP-2诱导破骨细胞比较,差异均具有统计学意义(P<0.05~P<0.01);p65 mRNA表达在不同BMP-2浓度诱导破骨细胞对比差异均具有统计学意义(P<0.05~P<0.01)。两种mRNA进行线性分析,结果显示Smad1和p65呈显著正相关关系(r=0.215,P<0.05)(见表 4)。
BMP-2浓度/(ng/mL) n BMP-2 Smad1 p65 0 10 1.265±0.032 0.786±0.022 0.985±0.045 30 10 1.672±0.045 1.879±0.342* 3.768±0.937** 60 10 6.726±1.027**## 4.172±0.769**## 4.872±1.209**# 90 10 8.241±1.227**##▲▲ 6.384±1.673**##▲▲ 6.412±1.238**##▲▲ 120 10 9.452±1.544**##▲▲△△ 7.259±1.594**##▲▲ 8.195±1.463**##▲▲△△ F — 144.57 64.31 61.80 P — <0.01 <0.01 <0.01 MS组内 — 0.989 1.210 1.203 q检验:与0 ng/mL比较*P<0.05,** P<0.01;与30 ng/mL比较#P<0.05, ##P<0.01;与60 ng/mL组比较▲▲P<0.01;与90 ng/mL比较△△P<0.01 表 4 不同浓度BMP-2诱导破骨细胞Smad1及p65 mRNA表达比较(x±s)
-
在不同浓度BMP-2诱导破骨细胞后检测Smad1及p65蛋白的表达对比,结果显示在不同浓度BMP-2下Smad1、p65蛋白差异具有统计学意义(P<0.01)(见表 4)。对Smad1及p65蛋白相对表达量进行线性分析,结果显示Smad1及p65蛋白表达呈显著正相关关系(r=0.249,P<0.05)。
-
本研究对小鼠实施脊柱后外侧入路的横突间融合手术,结果显示两种方式均能获得良好的效果,而加用BMP-2融合效果更明显。应用CTAn软件评价融合术后骨小梁情况,结果显示,加用BMP-2小鼠在骨小梁体积及骨小梁间隙方面高于未添加小鼠,而在骨小梁厚度方面则无差异。综合分析其原因可能为:未添加BMP-2小鼠脊柱术后融合效果良好,排除了手术、脱钙骨基质带来的干扰,加用BMP-2后,可以有效增加诱导脊柱骨性融合,明显提高骨生长相关指标,BMP-2可能通过介导骨细胞生长促进脊柱融合。与朱卫国等[11-13]研究结果相近。
在体外实验中,提取骨髓来源的巨噬细胞,应用RANKL及M-CSF试剂对其进行诱导产生破骨细胞,结果显示诱导破骨细胞总数为(76.65±6.39)个,面积为(2.67±0.65)×103μm2,表明本次研究构建体外诱导破骨细胞模型成功,与既往研究结果相似。在加入60、90、120 ng/mL BMP-2培养发现破骨细胞总数及面积明显高于未添加和30 ng/mL,而BMP-2浓度在60、90、120 ng/mL比较无差异,在未添加和30 ng/mL之间也无差异。结果显示BMP-2可能参与了诱导破骨细胞活化的过程,并且随着浓度的持续增加,其破骨细胞活化未能一直增高,分析原因可能为BMP-2可能参与了破骨细胞诱导的过程,其诱导破骨细胞表达水平可能与细胞内相应的受体数量有关,当受体配体匹配饱和后,增加BMP-2浓度无法增加诱导破骨细胞活化能力。高浚淮等[14]研究对仿生壳聚糖载体包裹的BMP-2诱导间充质干细胞分化为成骨细胞进行观察,结果提示BMP-2能够促进成骨细胞的分化。PHAM等[15]研究显示增加BMP-2数量可以提高TWSG1过表达诱导的破骨细胞数量,本次研究结果与之一致。我们检测了体外实验诱导破骨细胞BMP-2 mRNA,在不同浓度BMP-2加入时其表达水平不同,说明外源性加入BMP-2对内源性表达有影响作用,但具体的作用还需进行探讨。对诱导破骨细胞后Smad1及p65 mRNA及蛋白的表达进行检测,结果显示,随着BMP-2浓度增加表达水平均有所提高,并且Smad1及p65 mRNA及蛋白表达具有相关性。我们推测在BMP-2诱导破骨细胞活化过程中,Smad1及p65可能参与了信号转导的过程。而缪雄[16]研究也证实了BMP-2通过激活Smad1及p65信号通路,进而促使破骨细胞活化致使骨溶解,支持本次研究结果。因此,我们总结了BMP-2在诱导小鼠破骨细胞活化的机制,具体为BMP-2激活Smad1,使Smad1磷酸化,进而激活p65磷酸化,促进磷酸化的p65转入细胞核内,促进破骨细胞活化。
在本次研究中,总结了小鼠脊柱手术模型实验中的注意事项:(1)构建动物模型时,将BMP-2注射入小鼠胫骨内,因小鼠胫骨较细,注射时避免针尖未完全注入骨髓腔或刺破骨内侧壁,在注射时注意回抽确认位置;(2)BMP-2慢病毒载体在注入小鼠胫骨内,其表达程度难以稳定,小鼠的免疫系统会消化清除部分BMP-2慢病毒载体,需要进行几次预实验对BMP-2表达的稳定性进行评估;(3)在选取动物时,因考虑实验经济成本等条件,本次选择小型动物,具有简便、可行性高等特点,未建立大型动物模型。
综上所述,BMP-2应用在小鼠脊柱手术模型中能够促进骨融合,BMP-2参与诱导破骨细胞活化的过程,诱导破骨细胞活化可能通过Smad1/p65信号通路。
骨形态发生蛋白2在小鼠模型中诱导破骨细胞活化的机制
Mechanism of the bone morphogenetic protein 2 inducing osteoclast activation in the mouse model
-
摘要:
目的探讨骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)在诱导小鼠破骨细胞活化的作用以及相关的机制。 方法选取20只小鼠,按照随机数字法分为对照组和实验组,每组10只,均接受小鼠脊柱后外侧入路的横突间融合手术,实验组植入骨片和BMP-2,对照组仅植入骨片,评估术后骨骼变化情况。在小鼠胫骨内提取骨髓来源的巨噬细胞(bone marrow-derived macrophages,BMMs),应用RANKL及M-CSF试剂诱导为破骨细胞,并在其中加入不同浓度的BMP-2,应用TRAP染色法检测破骨细胞情况,荧光定量聚合酶链反应(polymerase chain reaction,PCR)方法测定Smad1及p65基因,Western blotting法测定Smad1及p65蛋白表达情况。 结果微型CT仪影像检查显示,实验组小鼠术后的脊柱融合情况强于对照组。2组小鼠术后1、2、4周骨小梁体积和骨小梁厚度均呈增高趋势,骨小梁间隙呈降低趋势,差异均具有统计学意义(P < 0.01)。实验组术后1、2、4周骨小梁体积高于对照组,实验组术后2、4周骨小梁间隙低于对照组(P < 0.01)。在BMP-2浓度为60、90及120 ng/mL时破骨细胞总数和总面积均高于BMP-2浓度为0、30 ng/mL时(P < 0.01)。Smad1及p65 mRNA表达在不同浓度BMP-2诱导破骨细胞比较差异均具有统计学意义(P < 0.01),Smad1和p65 mRNA表达呈线性相关(P < 0.05)。 结论BMP-2能够促进小鼠脊柱手术模型的融合,BMP-2参与了破骨细胞活化的过程,可能通过Smad1/p65信号通路介导破骨细胞活化。 Abstract:ObjectiveTo investigate the role of bone morphogenetic protein 2 (BMP-2) in inducing the osteoclast activation in mice, and its related mechanisms. MethodsTwenty mice were randomly divided into the control group and experimental group (10 mice in each group), and treated with intertransverse fusion surgery through the posterolateral approach of the spine.The experimental group was implanted with bone fragments combined with BMP-2, the control group was only implanted with bone fragments, and the postoperative bone changes in two groups were evaluated.The bone marrow-derived macrophages (BMMs) were extracted from the tibia of the mice, induced into osteoclasts using RANKL and M-CSF reagents, and co-cultured with different concentrations of BMP-2.The osteoclasts, mRNA levels of Smad1 and p65 and protein levels of Smad1 and p65 were detected using TRAP staining, RT-PCR and Western blot, respectively. ResultsThe results of image examination of micro-CT showed that the spinal fusion in experimental group was stronger than that in control group.The trabecular bone volume and trabecular thickness in two groups showed an increasing trend after 1, 2 and 4 weeks of operation, and the trabecular bone gap showed a decreasing trend, and the difference of which was statistically significant (P < 0.05).The volume of trabecular bone in experimental group was higher than that in control group at 1, 2, and 4 weeks after operation, and the trabecular space in experimental group was lower than that in control group at 2 and 4 weeks after operation (P < 0.01).The total number and total area of osteoclasts at the 60 ng/mL, 90 ng/mL and 120 ng/mL of BMP-2 were higher than those at 0 ng/mL and 30 ng/mL of BMP-2 (P < 0.01).The differences of the expression levels of Smad1 and p65 mRNA in osteoclasts induced by different concentrations of BMP-2 were statistically significant (P < 0.01), and the expression level of Smad1 mRNA was linearly correlated with p65 (P < 0.01).The differences of the expression levels of Smad1 and p65 protein in osteoclasts induced by different concentrations of BMP-2 were statistically significant (P < 0.01), and the expression level of Smad1 protein was linearly correlated with p65 (P < 0.05). ConclusionsBMP-2 can promote the fusion of mouse spinal surgery model.BMP-2 is involved in the process of osteoclast activation, and may mediate osteoclast activation via Smad1/p65 signaling pathway. -
Key words:
- intertransverse fusion surgery /
- bone morphogenetic protein 2 /
- osteoclast /
- macrophages
-
表 1 引物序列
引物名 引物序列 GAPDH 上游引物 5′-CAA GAG GTC CTG TCT TCA GAT GA-3′ 下游引物 5′-TCT GTT TCC GTT TCC TGG TTC-3′ BMP-2 上游引物 5′-GCA CCG TCA AGG CTG AGA AC-3′ 下游引物 5′-TGG TGA AGA CGC CAG TGG A-3′ Smad1 上游引物 5′-TAC GGA CGT CAG GTG CTC AGT TGC-3 下游引物 5′-CCA TGC TGT GAC GTC CTG CAG C-3′ p65 上游引物 5′-CTA TGG CAT GGT AGA CGG ATG CCA-3′ 下游引物 5′-CGG ATT CGG CAA GGT CTC AAT TGC-3′ 表 2 脊柱融合术后骨小梁相关指标对比(x±s)
分组 n 1周 2周 4周 F P MS组内 骨小梁体积/mm3 对照组 10 0.030±0.006 0.056±0.003** 0.068±0.005**## 161.71 <0.01 0.000 实验组 10 0.071±0.004 0.121±0.019** 0.143±0.021**## 49.93 <0.01 0.000 t — 17.98 10.69 10.99 — — — P — <0.01 <0.01 <0.01 — — — 骨小梁厚度/mm 对照组 10 0.051±0.014 0.057±0.010 0.077±0.011**## 13.33 <0.01 0.000 实验组 10 0.049±0.011 0.053±0.002 0.074±0.009**## 26.26 <0.01 0.000 t — 0.36 1.24 0.67 — — — P — >0.05 >0.05 >0.05 — — — 骨小梁间隙/mm 对照组 10 0.093±0.013 0.074±0.012** 0.070±0.011** 10.44 <0.01 0.000 实验组 10 0.077±0.022 0.042±0.010** 0.032±0.007** 26.46 <0.01 0.000 t — 1.98 6.48 9.22 — — — P — >0.05 <0.01 <0.01 — — — q检验:与1周组比较** P<0.01;与2周组比较##P<0.01 表 3 不同浓度BMP-2诱导下破骨细胞总数量及总面积(x±s)
BMP-2浓度/ng/mL n 破骨细胞总数/个 破骨细胞总面积/(×103μm2) 0 10 76.65±6.39 2.67±0.65 30 10 79.18±7.39 2.89±0.77 60 10 113.43±9.10**## 6.15±0.89**## 90 10 105.92±8.85**## 5.72±0.78**## 120 10 110.27±8.77**## 5.52±0.68**## F — 47.12 48.43 P — <0.01 <0.01 MS组内 — 66.698 0.576 q检验:与0 ng/mL比较** P<0.01;与30 ng/mL比较##P<0.01 表 4 不同浓度BMP-2诱导破骨细胞Smad1及p65 mRNA表达比较(x±s)
BMP-2浓度/(ng/mL) n BMP-2 Smad1 p65 0 10 1.265±0.032 0.786±0.022 0.985±0.045 30 10 1.672±0.045 1.879±0.342* 3.768±0.937** 60 10 6.726±1.027**## 4.172±0.769**## 4.872±1.209**# 90 10 8.241±1.227**##▲▲ 6.384±1.673**##▲▲ 6.412±1.238**##▲▲ 120 10 9.452±1.544**##▲▲△△ 7.259±1.594**##▲▲ 8.195±1.463**##▲▲△△ F — 144.57 64.31 61.80 P — <0.01 <0.01 <0.01 MS组内 — 0.989 1.210 1.203 q检验:与0 ng/mL比较*P<0.05,** P<0.01;与30 ng/mL比较#P<0.05, ##P<0.01;与60 ng/mL组比较▲▲P<0.01;与90 ng/mL比较△△P<0.01 -
[1] 鲁亚杰, 李明辉, 龙作尧, 等.国人脊柱原发肿瘤流行病学特征的Meta分析[J].中国脊柱脊髓杂志, 2018, 28(1):62. [2] 赵明, 魏艳红.自体富血小板血浆联合骨髓基质干细胞复合改建脱细胞真皮基质修复兔关节软骨的可行性研究[J].蚌埠医学院学报, 2016, 41(8):981. [3] 张禄锴, 李风波, 马剑雄, 等.破骨细胞分化通路的研究进展[J].生物医学工程与临床, 2017, 21(3):124. [4] 韩仲兵, 张长春, 叶雨辰, 等.淫羊藿对兔腰椎问盘退变模型软骨组织中BMP-2、BMP-4表达水平的影响[J].蚌埠医学院学报, 2019, 44(7):850. [5] JAMES AW, LACHAUD G, SHEN J, et al.A review of the clinical side effects of bone morphogenetic protein-2[J].Tissue Eng Part B Rev, 2016, 22(4):284. [6] 张连平, 高文飞, 杜兵强.蠲痹健膝方联合关节镜手术对膝骨关节炎的疗效[J].蚌埠医学院学报, 2019, 44(2):202. [7] KIM HK, ARUWAJOYE O, DU J, et al.Local administration of bone morphogenetic protein-2 and bisphosphonate during non-weight-bearing treatment of ischemic osteonecrosis of the femoral head:an experimental investigation in immature pigs[J].J Bone Joint Surg Am, 2014, 96(18):1515. [8] LIU T, WU G, ZHENG Y, et al.Cell-mediated BMP-2 release from a novel dual-drug delivery system promotes bone formation[J].Clin Oral Implants Res, 2015, 25(12):1412. [9] KWON TK, SONG JM, KIM IR, et al.Effect of recombinant human bone morphogenetic protein-2 on bisphosphonate-treated osteoblasts[J].J Korean Assoc Oral Maxillofac Surg, 2014, 40(6):291. [10] 韩兴龙.胶原支架负载CBD-BMP-2促进大鼠后外侧脊柱横突的融合[D].苏州: 苏州大学, 2014. [11] 朱卫国.脱钙骨基质结合低剂量CBD-BMP-2促进大鼠脊柱融合疗效的实验研究及脊柱畸形手术治疗的临床研究[D].南京: 南京大学, 2018. [12] SUN SX, GUO HH, ZHANG J, et al.BMP-2 and titanium particles synergistically activateosteoclast formation[J].Braz J Med Biol Res, 2014, 47(6):461. [13] BOUGIOUKLI S, JAIN A, SUGIYAMA O, et al.Combination therapy with BMP-2 and a systemic RANKL inhibitor enhances bone healing in a mouse critical-sized femoral defect[J].Bone, 2015, 84(23):93. [14] 高浚淮, 邱素均, 殷杰, 等.NAC-PCCs载骨形态发生蛋白2基因纳米微球促大鼠骨髓间充质干细胞成骨分化[J].中国临床解剖学杂志, 2018, 36(2):187. [15] PHAM L, BEYER K, JENSEN ED, et al.Bone morphogenetic protein 2 signaling in osteoclasts is negatively regulated by the BMP antagonist, twisted gastrulation.[J].J Cell Biochem, 2015, 112(3):793. [16] 缪雄.BMP-2激活Smad1及p65促进破骨细胞活化致骨溶解的机制研究[D].上海: 海军军医大学, 2018. -




 下载:
下载: