-
青光眼是全球第一大不可逆性致盲眼病,而原发性青光眼是其主要的类型之一[1]。眼压升高被认为是导致青光眼发生发展的主要危险因素[2]。目前原发性青光眼的发病机制尚不明确,大部分研究表明是由于青光眼病人小梁网组织及其周围环境异常所致,使小梁网细胞外基质蛋白(extracellular matrixc, ECM),例如纤维连接蛋白(fibronectin,FN)、Ⅳ型胶原蛋白(collagen-Ⅳ, COL-Ⅳ)、层粘连蛋白(laminin, LN)等之间的产生与降解关系被打破[3],造成ECM异常累积导致其纤维化,引起房水外流受阻,病理性眼压升高,而眼压增高继而将导致视网膜上的节细胞发生凋亡与死亡,最终导致病人不可逆性失明[4-6]。研究[7]表明,myocilin是第一个被确认与原发性开角型青光眼相关的基因,且在小梁网和睫状体等眼部组织中大量存在。据报道[8],4%的青光眼病人存在myocilin基因的变异,突变的myocilin不能分泌到房水当中,从而积聚在小梁网的内质网中,造成内质网应激反应,造成眼压升高。在Tg-MYOCy437h小鼠中,小梁网的内质网也发生应激反应,慢性和持续性内质网应激与Tg-MYOCy437h小鼠小梁网细胞的死亡和眼压升高有关[7]。而且myocilin的表达同时也受糖皮质激素的调控,所以又被称为小梁网诱导性糖皮质激素反应蛋白[9],相邻组织或细胞不受这一调控反应[10]。由于直接在人眼组织中观察小梁网组织的生理特性和生物学功能十分困难,因此体外成功培养小梁网细胞尤为重要。另外,小梁网组织靠近虹膜、角膜等组织[11],且目前IOVS等眼科影响力较高的杂志对人小梁网细胞鉴定的要求越来越严格,既往报道关于人小梁网细胞的鉴定方法已不能完全满足审稿人的要求。本文将利用小梁网的特性,介绍一种小梁网细胞培养与鉴定的新方法,为更好地满足审稿人对于人小梁网细胞的鉴定提供依据。
-
人小梁网细胞取材来源于眼球破裂伤病人的眼球以及角膜移植后剩余的角膜环,破裂伤的眼球一般在摘除后24 h之内取材,但由于角膜移植手术一般于角膜捐献4 d后进行手术,手术后24 h之内进行取材。
-
破裂伤眼球取材:在细胞房的超净工作台中放入正置显微镜,将眼球置于显微镜操作台上。在无菌条件下,用手术剪沿着角巩膜缘后3~5 mm处环形将眼球剪开,将眼球后节、晶状体、虹膜等弃去,保留角膜环。在显微镜下寻找到自透明角膜终点向外0.5 mm左右,是突起的睫状突,两者之间的网状具有色素的组织是小梁网组织,用显微镊将其镊起,然后环形撕取整个小梁网组织。角膜移植手术后角膜环取材:将角膜环置于显微镜下后,其余步骤同上。
-
将取下的小梁网组织在pH值为7.2的无菌PBS溶液(美国ThermoFisher Scientific公司)中漂洗3次后,剪成1.5 mm×1.5 mm组织块,种于10 cm皿中(美国Costar公司),在组织块上滴加一滴小梁网细胞培养液[含有10%胎牛血清、1%双抗、1%谷氨酰胺的DMEM液体(美国ThermoFisher Scientific公司)],放入37℃、CO2体积分数为5%的培养箱(美国ThermoFisher Scientific公司)中,待其贴壁,4h后加入10mL小梁网培养液继续培养。1周后进行第1次换液,之后每周换液2次,换液前置于显微镜下观察。
-
当细胞生长融合至80%或者组织块附近细胞密度过大时,需进行细胞传代。首先将原先旧的培养液去除,用pH值为7.2的无菌PBS溶液清洗3次,加入1.5mL 0.25%的胰蛋白酶(美国ThermoFisher Scientific公司)进行消化,消化时仍置于培养箱中。等待2~3min后,将培养皿置于显微镜下观察,待细胞形态开始收缩变圆时加入3倍胰蛋白酶体积的小梁网细胞培养液终止消化,并轻轻吹打整个液体,使其充分融合。然后将液体移入15mL离心管中,800r/min离心4min。最后将保留离心管中的细胞沉淀,用1 mL的小梁网培养液进行重悬,按照1:3的比例进行传代,在每个小梁网细胞的培养皿中加入培养液使最终培养液的体积为10mL。
-
将长出的小梁网细胞的培养皿置于显微镜下对小梁网的形态进行观察。将培养至第3代的人小梁网细胞按照前述方法进行消化,铺种于96孔板,采用细胞计数Kit-8 (CCK8, 美国MedChemExpress公司)方法对小梁网细胞的增殖速度进行检测。
-
将培养至第3代的人小梁网细胞按照前述方法消化下来,分别铺种于6孔板、24孔板(在板中放置爬片)中加入培养液后置于培养箱中培养,待其生长融合至80%后进行细胞鉴定。用浓度为10-7 mol/L地塞米松(DEX)对铺种于6孔板中的人小梁网细胞进行处理,10d后PCR、WB检测myocilin表达水平的变化。利用细胞免疫荧光技术(ICC法)对铺种于24孔板中爬片上的小梁网细胞进行水通道蛋白-1(aquaporin 1, AQP1)、FN、COL-Ⅳ、LN染色。
-
采用CCK8法评价人小梁网细胞的活性。按照103个/孔小梁网细胞置于96孔板中,然后加入CCK8试剂。细胞在37 ℃下继续孵育4 h。采用microplate reader测量450 nm处的吸光度值来表示细胞活性。
-
将人小梁网细胞铺种于24孔板(板中放置爬片)中。待其长满后,弃去培养液,PBS溶液清洗3次,4%多聚甲醛固定30 min,PBS溶液清洗3次,每次5min,加入封闭液,室温封闭1 h,最后加入一抗,4 ℃过夜,第2天回收一抗,加入PBS溶液清洗3次,再向其中加入二抗,温孵育1 h。PBS溶液洗涤细胞后,用含有4′,6-二氨基-2-苯基吲哚(DAPI)试剂(美国英潍捷基公司)进行封片。免疫染色抗体,一抗:兔多克隆AQP1抗体(1:200,美国Abcam公司)、兔多克隆FN抗体(1:200,美国Abcam公司)、兔多克隆COL-Ⅳ抗体(1:100,Abcam)、兔多克隆LN抗体(1:200,美国Abcam公司)。二抗:羊抗兔alexa-488(1:200,美国英潍捷基公司)。
-
待细胞处理完毕后,吸出旧的培养液,加入PBS溶液清洗3次,再向每孔加入1 mL Trizol试剂(美国ThermoFisher Scientific公司),按照试剂盒(美国Takara公司)说明进行RNA的提取。最后在核酸定量仪中测量其浓度,按照反转录试剂盒说明,将RNA最终反转录为1 μg cDNA进行后续实验。按照荧光定量PCR的要求配置总管,每个3个复孔。每孔包含5 μL Mix、2 μL DEPC水、1 μL cDNA、1 μL引物正义链及1 μL cDNA引物反义链。
-
待细胞处理完毕后,弃去旧的培养液,加入PBS溶液清洗3次,再向每孔加入200 μL蛋白裂解液,按照试剂盒(美国ThermoFisher Scientific公司)说明进行细胞总蛋白的提取,再根据BCA法对蛋白进行定量。取20 μg蛋白与5 μL上样缓冲液进行混匀,再放在95~100 ℃的金属浴中加热5 min后,开始电泳,80 V、30 min,120 V、40 min后再进行根据蛋白大小进行转膜,结束后将PVDF膜泡在5%BSA中封闭2 h,一抗4 ℃孵育过夜,次日用TBST溶液洗3次,每次10 min,二抗室温孵育2 h,TBST溶液洗3次,每次10 min。在膜上滴加ECL发光液孵育1 min后,放入扫膜机器中扫膜,最后利用imagej软件进行灰度值分析。
-
采用t检验、方差分析和q检验。
-
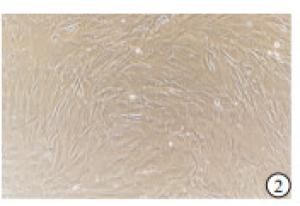
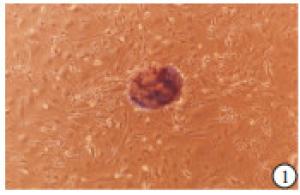
显微镜下观察:小梁网组织块贴壁培养1~2周后,开始有细胞从组织块旁向外长出,并逐渐增多(见图 1),细胞形态呈椭圆形、梭形等,类似于成纤维细胞,细胞核呈椭圆形或者圆形,含有大量的细胞质,并含有少量色素颗粒(见图 2)。细胞生长较慢,一般7~10 d细胞发生融合,传代后细胞生长速度与细胞密度有关。CCK8法检测结果显示:传代后小梁网细胞在第1~4天生长较快,第5~7天生长速度有所减慢,但依然显著高于第4天(P < 0.01)(见表 1)。
分组 n 细胞生存率/% F P MS组内 第1天 4 99.97±2.77 第4天 4 188.45±3.42** 1 147.65 < 0.01 11.045 第7天 4 204.50±3.71**## q检验:与第1天比较** P < 0.01;与第4天比较## P < 0.01 表 1 CCK8法检测小梁网细胞增殖情况(x±s)
-
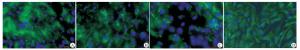
培养至第三代的人小梁网细胞FN、COL-Ⅳ、LN及AQP1染色均呈阳性(见图 3)。
-
与对照组相比,DEX可使人小梁网细胞中myocilin mRNA水平升高(P < 0.01)(见表 2)。DEX (100 μmol/L)刺激人小梁网细胞10 d后,与对照组相比,myocilin的蛋白表达明显增加(P < 0.01)(见表3)。
分组 n myocilin mRNA myocilin蛋白 对照组 3 1.03±0.52 1.01±0.17 DEX组 3 4.98±0.77 1.75±0.20 t — 7.36 4.88 P — < 0.01 < 0.01 表 2 小梁网细胞中myocilin mRNA及myocilin蛋白水平的表达情况(x±s)
-
人小梁网细胞的原代培养主要分为组织块贴壁法和组织块消化法。通过本实验室多株人小梁网细胞培育成功的经验来看,如果材料取自于新鲜眼球采用组织块贴壁法培养细胞成功率较高,如果材料来源于放置数天后再行角膜移植术后的角膜环,采用组织块消化法较为妥当。在培养原代细胞期间,尽量避免移动培养皿,以防止组织脱离培养皿底,造成组织块游离,最终大大降低细胞长出率。
本研究中,人小梁网细胞细胞免疫荧光染色显示FN、COL-Ⅳ、LN、AQP1染色均呈阳性。角膜内皮细胞与巩膜成纤维细胞等无分泌FN、LN的功能,但这可以作为鉴别小梁网细胞的一个重要特征[12]。目前尚未有人小梁网细胞特异性标志物可用来作为鉴定标准,但另有报道[13]可以利用AQP1蛋白作为区分标志物。人小梁网细胞表达AQP1,将小梁网细胞与其附近的组织细胞进行区分。
本研究还采用了一种具有更大意义的鉴定方法。Myocilin是第一个被确认与原发性开角型青光眼相关的基因,>4%的原发性开角型青光眼病人存在myocilin基因的变异。小梁网组织可分泌myocilin,而且受糖皮质激素的调控,所以又被称为小梁网诱导性糖皮质激素反应蛋白,相邻组织或细胞不受这一调控反应[14],故本研究同时利用小梁网这一特性对其进行鉴别。
人小梁网细胞的培养是研究青光眼发病机制和针对发病机制寻找有效治疗药物的关键基础,而成功且严谨地对所培养出的人小梁网细胞进行鉴定更是关键所在。
人眼组织小梁网细胞的体外培养及鉴定的新方法
A new method of culture and identification of human eye trabecular meshwork cells in vitro
-
摘要:
目的探讨人原代小梁网细胞的体外培养,以及利用其特性建立一种鉴定小梁网细胞的新方法。 方法从眼球破裂伤病人的眼球以及角膜移植后剩余的角膜环分离出小梁网组织,利用组织块贴壁法以及消化法对人原代小梁网细胞进行体外培养。倒置显微镜下观察细胞生长状态并利用CCK8法检测其生长速率。利用细胞免疫荧光技术对所培养的细胞进行纤维连接蛋白、Ⅳ型胶原蛋白、层黏连蛋白、水通道蛋白-1等蛋白的染色鉴定。并利用100 nmol/L地塞米松对所培养的细胞诱导10 d,通过荧光定量PCR和western blotting方法检测myocilin的表达水平以确定所培养的细胞是否为小梁网细胞。 结果小梁网组织块贴壁培养1~2周后,开始有细胞从组织块旁向外长出,并逐渐增多。传代后小梁网细胞在第1~4天生长较快,第5~7天生长速度有所减慢,但依然显著高于第4天(P < 0.01)。所培养的细胞纤维连接蛋白、Ⅳ型胶原蛋白、层黏连蛋白、水通道蛋白-1的免疫荧光染色均呈阳性。地塞米松诱导后,与对照组相比,小梁网细胞中myocilin mRNA和蛋白表达水平均明显上升(P < 0.01)。 结论本实验中所培养的细胞通过对其特点进行检测,确定所培养的细胞为人原代小梁网细胞。 Abstract:ObjectiveTo explore the culture of human eye trabecular meshwork cells in vitro, and establish a new method of identifying cells according to its characters. MethodsThe trabecular meshwork tissue was isolated from the eyeballs of patients with ocular rupture injury, and corneal ring left after corneal transplantation, and the human primary trabecular meshwork cells were cultured in vitro using tissue block adherence and digestion methods.The cell growth was observed under an inverted microscope, and the growth rate was measured using CCK8.The fiber connection protein, type Ⅳ collagen protein, layer adhesion protein and water channel protein-1 were identified using cell immunofluorescence staining.The cultured cells were induced using 100 nml/L of dexamethasone for 10 d, and the mRNA and protein expression levels of myocilin were detected using fluorescence quantitative PCR and western blotting, respectively. ResultsAfter culturing for 1 to 2 weeks, the cells began to grow out from the side of the trabecular meshwork, and gradually increased.After passaging, the trabecular meshwork cells grew faster on 1-4 days, and slower on 5-7 days, which still significantly higher than that on day 4(P < 0.01).The staining of fibronectin, collagen-Ⅳ, laminin and aquaporin 1 in cultured cells were positive using immunofluorescence.After dexamethasone inducing, the myocilin mRNA and protein expression levels in trabecular meshwork cells significantly increased compared with the control group(P < 0.01). ConclusionsThe primary trabecular meshwork cells can be identified by detecting their characteristics. -
Key words:
- primary glaucoma /
- trabecular meshwork /
- primary cell /
- culture /
- identification
-
表 1 CCK8法检测小梁网细胞增殖情况(x±s)
分组 n 细胞生存率/% F P MS组内 第1天 4 99.97±2.77 第4天 4 188.45±3.42** 1 147.65 < 0.01 11.045 第7天 4 204.50±3.71**## q检验:与第1天比较** P < 0.01;与第4天比较## P < 0.01 表 2 小梁网细胞中myocilin mRNA及myocilin蛋白水平的表达情况(x±s)
分组 n myocilin mRNA myocilin蛋白 对照组 3 1.03±0.52 1.01±0.17 DEX组 3 4.98±0.77 1.75±0.20 t — 7.36 4.88 P — < 0.01 < 0.01 -
[1] WEINREB RN, KHAW PT.Primary open-angle glaucoma[J].Lancet, 2004, 363(9422):1711. doi: 10.1016/S0140-6736(04)16257-0 [2] CAPRIOLI J, COLEMAN AL.Intraocular pressure fluctuation a risk factor for visual field progression at low intraocular pressures in the advanced glaucoma intervention study[J].Ophthalmology, 2008, 115(7):1123. doi: 10.1016/j.ophtha.2007.10.031 [3] VRANKA JA, KELLEY MJ, ACOTT TS, et al.Extracellular matrix in the trabecular meshwork:intraocular pressure regulation and dysregulation in glaucoma[J].Exp Eye Res, 2015, 133:112. doi: 10.1016/j.exer.2014.07.014 [4] QUIGLEY AH, BROMAN AT.The number of people with glaucoma worldwide in 2010 and 2020[J].Br J Ophthalmol, 2006, 90(3):262. [5] NEMESURE B, HONKANEN R, HENNIS A, et al.Incident open-angle glaucoma and intraocular pressure[J].Ophthalmology, 2007, 114(10):1810. doi: 10.1016/j.ophtha.2007.04.003 [6] THAM YC, LI X, WONG TY, et al.Global prevalence of glaucoma and projections of glaucoma burden through 2040 a systematic review and meta-analysis[J].Ophthalmology, 2014, 121(11):2081. doi: 10.1016/j.ophtha.2014.05.013 [7] ZODE GS, KUEHN MH, NISHIMYRA DY, et al.Reduction of ER stress via a chemical chaperone prevents disease phenotypes in a mouse model of primary open angle glaucoma[J].J Clin Invest, 2011, 121(9):3542. doi: 10.1172/JCI58183 [8] STONE EM, FINGERT JH, ALWARD WL, et al.Identification of a Gene That Causes Primary Open Angle Glaucoma[J].Science, 1997, 275(5300):668. doi: 10.1126/science.275.5300.668 [9] ZODE GS, SHARMA AB, LIN X, et al.Ocular-specific ER stress reduction rescues glaucoma in murine glucocorticoid-induced glaucoma[J].J Clin Invest, 2014, 124(5):1956. doi: 10.1172/JCI69774 [10] POLANSKY JR, FAUSS DJ, ZIMMERMAN CC.Regulation of TIGR/MYOC gene expression in human trabecular meshwork cells[J].Eye(Lond), 2000, 14(Pt 3B):503. [11] RHEE DJ, TAMM ER, RUSSELL P.Donor corneoscleral buttons:a new source of trabecular meshwork for research[J].Exp Eye Res, 2003, 77(6):749 doi: 10.1016/j.exer.2003.07.008 [12] TRIPATHI BJ, TRIPATHI RC, CHEN J, et al.Trabecular cell expression of fibronectin and MMP-3 is modulated by aqueous humor growth factors[J].Exp Eye Res, 2004, 78(3):653. doi: 10.1016/j.exer.2003.09.011 [13] PERKUMAS KM, STAMER WD.Protein markers and differentiation in culture for Schlemm's canal endothelial cells[J].Exp Eye Res, 2012, 96(1):82. doi: 10.1016/j.exer.2011.12.017 [14] RESCH ZT, HANN CR, COOK KA, et al.Aqueous humor rapidly stimulates myocilin secretion from human trabecular meshwork cells[J].Exp Eye Res, 2010, 91(6):901. doi: 10.1016/j.exer.2010.09.017 -




 下载:
下载: