-
增生性瘢痕(hypertrophic scar, HS)是皮肤软组织创(烧)伤愈合修复过程中出现的过度纤维化疾病[1]。普通HS的术后发病率可达40%~70%,而烧伤愈合所致的HS更高至91%[2]。临床上,HS过度增生的突出表现为损伤区域局部组织较正常皮肤凸出明显,创面愈合过程中细胞外基质过度堆积致组织变硬增厚,常引发病人疼痛、瘙痒等不适感觉,其中累及关节等部位的HS还会导致病人功能方面的障碍,严重影响病人容貌和生活质量,给家庭及社会带来繁重负担[3]。目前,由于HS发病机制尚未完全明确,临床治疗中也缺乏针对性举措,因而HS治疗一直是国内外美容整形外科及基础医学关注和研究的热点与难点问题。研究[4]证实,HS病变发生与发展过程中的主要效应细胞是增生性瘢痕成纤维细胞(hypertrophic scar fibroblasts, HSFs),其中导致HS过度增生和持续存在的细胞学基础是HSFs增殖和凋亡之间的不平衡[5],因而着眼于抑制HSFs增殖和/或促进HSFs凋亡进而降低HS增生可以成为基础研究中抑制HS形成的一个重要突破口。
内抑素(endostatin)是O′REILLY等[6]于小鼠血管内皮瘤细胞的培养上清液中得到的一种蛋白质,后期研究[7]证实内抑素可通过抑制部分肿瘤细胞(血管内皮细胞及非小细胞肺癌细胞等)增殖和迁移并诱导其凋亡来发挥抗肿瘤效应。我们课题组的前期实验研究[8-10]发现,重组人内抑素(recombinant human endostatin, rhEndostatin, 100 μg/mL)可通过下调Bcl-2、NF-κB、c-jun和c-fos等基因表达来抑制兔耳HSF增殖,并诱导其凋亡发挥抗兔耳HS增生作用。研究[11]证实,Ca2+可作为细胞内第二信使,主要参与细胞凋亡早期初始阶段包括启动Caspases-3上游的激活与细胞色素C释放,而细胞内Ca2+浓度([Ca2+]i)超载也可作为细胞凋亡起始的重要步骤。本研究拟在课题组前期已完成实验的基础上进一步观察rhEndostatin(100 μg/mL)对HSF胞内[Ca2+]i的影响,通过探讨rhEndostatin促进HSF凋亡的部分机制,为临床寻找HS药物治疗新靶点提供一定的实验依据与理论基础。
-
普通级成年新西兰大耳兔6只,购自于安徽医科大学实验动物中心[动物合格证号:SCXK(皖) 2013-001],雌雄不限,体质量2.0~2.5 kg,单笼单只,在实验室适宜温湿度条件下(24 ℃,饮水自取)进行适应性喂养1周后用于HS模型制备。
-
rhEndostatin,先声麦得津(山东)生物有限公司,批号:201609040;0.25%胰蛋白酶,美国Sigma公司产品;Hanks液和D-Hanks液,杭州四季青生物材料研究所,分装冻存置于-20 ℃冰箱;胎牛血清,沃卡威(北京)生物技术有限公司,批号:04-001-1ACS;DMEM (Dulbecco′s Modified Eagle Medium)培养基,美国Gibco公司(细胞使用培养液内含15%胎牛血清,100 μg/mL链霉素,100 U/mL青霉素和2 mmol/L谷氨酰胺,同时保证培养液pH值保持在7.2,再进行过滤除菌后分装于已灭菌20 mL EP管内,-20 ℃冰箱内保存备用);Fluo-4/AM与PluronicF-127,美国Biotium公司。
-
OLYMPUS CX21、Nikon Eclipse80i倒置相差显微镜,日本尼康光学仪器有限公司;全自动高效低速冷冻离心机,美国贝克曼生物公司,型号:Allegra 25R;超净工作台,苏洁医疗器械(苏州)有限公司,型号:SJ-CJ-1FD;流式细胞仪(FCM), Beckman Coulter公司(美国),型号:FACSCantoTM Ⅱ;恒温细胞培养箱,三腾仪器(上海)有限公司,型号:MTC-500;激光扫描共聚焦显微镜(Confocal laser scanning microscopy, CLSM),德国莱卡公司, 型号:Leica SP5;全自动酶标仪,法国巴斯德公司,型号:LP400型。
-
兔耳HSFs的培养与鉴定参照本实验室建立的方法进行[9]。取6只新西兰大耳兔用于制备HS模型。本实验中手术创面1.5 cm×1.5 cm,其中每耳4个创面(每创面间隔约1 cm),共计48个。手术创面出现上皮化于术后3周左右,HS形成于术后第28天。术后第47天取瘢痕组织,培养及鉴定HSFs。本次实验检测细胞采用传2代培养HSFs。
-
实验中选用传1代指数生长期HSF,采用0.25%胰蛋白酶进行消化后再使用DMEM培养液制成含5×108/L HSFs的单细胞悬液,随之将该含有HSFs的细胞悬液置于有盖玻片的6孔细胞培养板中,在37 ℃、5% CO2恒温细胞培养箱中继续培养负载有HSFs的6孔培养板6~12 h,随后使用PBS冲洗3遍;再滴加Fluo-4/AM与F-127的混合工作液(其中Fluo-4/AM终浓度为5 μmol/L);于37 ℃避光温育60 min;再用PBS漂洗去盖玻片上残余荧光染色剂,最后将盖玻片置于PBS中继续温育10 min。本实验中采用CLSM动态监测rhEndostatin对HSFs胞内[Ca2+]i的影响。
-
将载有HSFs的细胞盖玻片放置到有灌流装置的细胞槽之中,随后再加入l mL有Ca2+液(即Hanks液),选取荧光显色清晰的细胞图层及加样层面摄片。首先连续40 s用Hanks液平稳灌流HSFs以稳定细胞状态后,以HSFs胞质内Ca2+基础荧光强度(fluorescence intensity, FI)作为对照,再依次以rhEndostatin(Hanks缓冲液配制,终浓度为100 μg/mL)及Hanks缓冲液连续平稳灌流细胞各50 s,与此同时选择适当的CLSM参数(CLSM的检测条件:激发波长488 nm,检测波长520 nm)对处理组细胞进行动态扫描。实验过程中首先测定刺激前(静息状态下)HSFs胞内[Ca2+]i变化,连续进行扫描140 s,每2 s 1次,然后进行动态观察HSF胞质内Ca2+ FI变化,整个实验操作过程中注意维持恒温状态(即保持在24 ℃左右)以保证实验的可重复性。使用CLSM Leica-Image分析程序对所摄图层进行定量数据分析处理。每组实验至少重复3次以上。
-
将上述步骤1.6.1中的Hanks缓冲液换为D-Hanks液, 其他剩余具体的CLSM检测步骤同1.6.1。
-
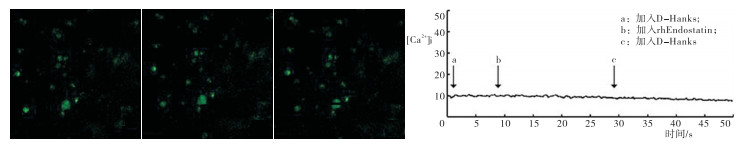
当HSFs处于无Ca2+液(即D-Hanks缓冲液)中时,HSFs胞质中Ca2+ FI在rhEndostatin(100 μg/mL)作用的前、中、后各时段均无显著变化。同时折线图数据分析结果与荧光图相一致,显示在给予药物处理前中后各时间点FI变化曲线接近平坦(见图 1)。
-
当HSFs处于有钙液(即Hanks缓冲液)时,rhEndostatin(100 μg/mL)作用可使HSF胞内Ca2+ FI渐增,且HSFs胞质内FI在rhEndostatin加入10 s后即可达最大,然后随时间推移减弱;且在停止加药后,FI强度继续降低。同时折线图数值分析结果与荧光图相一致,显示当rhEndostatin连续作用HSFs约10 s左右,即可见HSFs胞内Ca2+ FI值迅速增加并且达峰顶,随后FI值下降;在停止加入rhEndostatin处理后,HSFs胞内Ca2+ FI值继续下降,在停药约50 s后,HSFs胞内Ca2+ FI值尚未恢复到rhEndostatin作用前的基线水平(见图 2)。
-
细胞凋亡是机体自身维持内环境稳定的一种自主、程序性的过程,受体内多种因素的调节。经研究[12]证实,细胞Ca2+是一种广泛存在于真核细胞内且最为重要的第二信使之一,参与调控多种细胞的生命活动过程,其中胞质内[Ca2+]i升高被广泛认为是促进细胞自主凋亡的一个重要因素。细胞内钙以两种形式存在,分别为结合钙和离子钙(Ca2+),而其中离子钙又可分为胞外Ca2+和胞内Ca2+。相关研究[13]发现,细胞外[Ca2+]i可达10-3 mol/L,而胞内[Ca2+]i仅为10-7 mol/L,因而细胞内外钙之间存在着近乎万倍的浓度差,但正是这种胞内外[Ca2+]i的微小改变在细胞信号传递过程中发挥着至关重要的作用,调节着机体的生理和代谢过程。传统使用的监测手段难以对这种细胞内精细Ca2+信号进行分析,本实验所使用的Fluo-4/AM是一种高度特异性的荧光Ca2+探针,该探针为单波长荧光探针,可在488 nm波长激发光激发后产生荧光,从而直接测量出细胞内[Ca2+]i变化,且其荧光强度与[Ca2+]i成正比,其平均FI变化也反映[Ca2+]i的动态变化情况。
一系列的实验研究[14-16]表明,细胞质内Ca2+浓度的极微变化即可调节细胞的多种生命活动,例如胞质内局部或全部游离[Ca2+]i变化可调控细胞收缩、基因表达及细胞死亡等,其中,持续高浓度[Ca2+]i刺激可促进细胞凋亡。一方面,胞内Ca2+依赖酶激活依赖于高浓度Ca2+刺激,例如Ca2+/Mg2+依赖性核酸内切酶激活,可使核染色质DNA降解成单个寡核苷酸小体,最终促使细胞发生凋亡[17];另一方面[18],在细胞凋亡的早期即可出现线粒体Ca2+摄入过量,伴随线粒体通透孔(permeability transition pore, PTP)的开放,而PTP的开放可允许相对分子质量>1 500 000的分子通过细胞膜,同时使胞内活性氧增多,并伴随线粒体基质的膨胀破裂并释放出膜间促凋亡蛋白, 最终引起细胞凋亡。有研究[19]证实,细胞内[Ca2+]i增高主要依靠胞外Ca2+内流和胞内Ca2+库中Ca2+动员释放。ZHANG等[20]发现多溴二苯醚诱发神经母细胞瘤SH-SY5Y细胞[Ca2+]i升高依赖于胞外Ca2+内流;而PAREKH等[15]研究也证实,热、低渗和4α-PDD刺激升高关节炎大鼠滑膜细胞中的[Ca2+]i主要是通过活化胞外Ca2+内流实现。本实验研究发现,rhEndostatin(100 μg/mL)可引起有Ca2+液中HSFs [Ca2+]i升高, 可分为瞬时峰值升高相和缓慢持久升高相二个时相;而对无Ca2+液中的HSFs [Ca2+]i无影响,提示rhEndostatin未能诱发HSFs胞内Ca2+库的释放, 即HSFs胞内[Ca2+]i升高是由于rhEndostatin促进胞外Ca2+内流所致。
细胞内持续性胞质Ca2+水平升高主要与细胞膜上Ca2+通道开放所致的Ca2+内流有关[19]。成纤维细胞膜上的Ca2+通道主要有电压门控通道、激动剂-受体门控通道及钙泵等[21]。有研究[22]认为,Ca2+离开细胞质恢复到静息水平主要在于细胞膜上的钙主动转运系统,即钙泵。在本实验中,有钙液(Hanks缓冲液)中加入rhEndostatin(100 μg/mL) 10 s后,HSFs胞质内[Ca2+]i即可急剧增加并达峰值,随之下降,停止加入rhEndostatin后,其胞内[Ca2+]i水平继续缓慢下降,在停药约50 s后,HSFs胞质内[Ca2+]i尚未回复到加药前的基线水平,提示rhEndostatin(100 μg/mL)可引起HSFs胞质内[Ca2+]i增加,同时HSFs依靠胞膜上的钙泵将内流至胞质内的Ca2+移至胞外,即rhEndostatin开始作用时,HSFs细胞膜仍保持完整,其Ca2+通道尚未破坏,表明rhEndostatin引起的HSFs[Ca2+]i增加早于其所诱导的细胞凋亡事件。
早期有研究[23-24]发现,Ca2+信号作用于细胞凋亡晚期执行阶段的DNA裂解,然而,Ca2+信号最重要的功能是参与细胞凋亡早期初始阶段,其中包括Caspases-3上游的激活和细胞色素C的释放。因此依据本实验结果,rhEndostatin(100 μg/mL)诱导HSFs凋亡的一个早期事件可能是钙稳态失衡,即HSFs胞内Ca2+超载可能是rhEndostatin促进HSFs凋亡的一个重要始动环节。
综上所述,rhEndostatin可促进HSFs胞外Ca2+内流,从而引起HSFs胞内Ca2+超载,同时该过程可通过激活凋亡相关活化因子来促进HSFs凋亡,该研究为临床上HS药物治疗提供了新方向,具有重要的理论及实践意义。
重组人内抑素对兔耳增生性瘢痕成纤维细胞内钙离子浓度的影响
Effect of recombinant human endostatin on the intracellular Ca2+ concentration in hypertrophic scar fibroblasts in a rabbit ear model
-
摘要:
目的通过探讨重组人内抑素(rhEndostatin)促进兔耳增生性瘢痕成纤维细胞(HSFs)凋亡的部分机制,为临床上药物治疗增生性瘢痕(HS)提供实验依据。 方法取新西兰大耳兔6只制备瘢痕模型。以HSFs为研究对象,应用激光共聚焦显微镜(CLSM)结合Fluo-4/AM(Ca2+荧光指示剂)检测在Hanks与D-Hanks液中(有、无细胞外钙)rhEndostatin(100 μg/mL)对HSFs胞内Ca2+浓度([Ca2+]i)的影响。 结果当细胞外液为Hanks液时,rhEndostatin(100 μg/mL)可使HSF胞质内[Ca2+]i水平持续增加,当持续10 s给予rhEndostatin处理后,HSFs胞内[Ca2+]i可迅速增加达峰顶再缓慢下降,在停止药物处理后,HSFs胞内[Ca2+]i继续下降,停止处理约50 s后,胞内[Ca2+]i尚未至基线水平;而当细胞处于D-Hanks液中时,rhEndostatin对HSFs胞质内[Ca2+]i无明显影响。 结论rhEndostatin可通过干扰HSFs胞内钙离子稳态,推动胞外Ca2+内流导致胞内钙超载来诱导HSFs凋亡。 Abstract:ObjectiveTo investigate the mechanism of recombinant human endostatin(rhEndostatin) promoting the apoptosis of hypertrophic scar fibroblast(HSFs) in rabbit ear, and provide the experimental basis for clinical drug treatment of hypertrophic scar(HS). MethodsThe HS model was prepared in 6 healthy New Zealand white albino rabbits.The effects of rhEndostatin(100 μg/mL) on the intracellular Ca2+ concentration([Ca2+] i) of HSFs in Hanks and D-Hanks fluids(with and without extracellular calcium) were detected using laser confocal microscopy(CLSM) combined with Fluo-4 /AM(Ca2+ fluorescence indicator). ResultsWhen the extracellular fluid was the Hanks fluid, the rhEndostatin could cause the HSFs [Ca2+]i increasing, and the levels of [Ca2+]i reached to peak after 10 s of treatment, then slowly decreased with time.After stopping the drug treatment, the levels of [Ca2+]i continued to slow down, and the level of HSFs [Ca2+]i did not return to baseline after 50 s of rhEndostatin withdrawal.HSFs [Ca2+]i was not affected by rhEndostatin when the cells were incubated with D-Hanks buffer. ConclusionsRhEndostatin can induce the HSFs apoptosis by interfering with intracellular Ca2+ homeostasis and promoting extracellular Ca2+ influx to cause intracellular calcium overload. -
Key words:
- hypertrophic scar /
- endostatin /
- Ca2+ /
- confocal laser scanning microscopy /
- rabbit
-
[1] RABELLO FB, SOUZA CD, FARINA JUNIOR JA.Update on hypertrophic scar treatment[J].Clinics (Sao Paulo, Brazil), 2014, 69(8):565. doi: 10.6061/clinics/2014(08)11 [2] LEE DW, KU SK, CHO HJ, et al.Effects of Noscarna on hypertrophic scarring in the rabbit ear model:histopathological aspects[J].Arch Pharm Res, 2012, 35(11):1999. doi: 10.1007/s12272-012-1117-4 [3] CAMERON AM, TURNER CT, ADAMS DH, et al.Flightless Ⅰ is a key regulator of the fibroproliferative process in hypertrophic scarring and a target for a novel antiscarring therapy[J].Brit J Dermatol, 2016, 174(4):786. [4] HUANG LP, WANG GQ, JIA ZS, et al.Paclitaxel reduces formation of hypertrophic scars in the rabbit ear model[J].Ther Clin Risk Mana, 2015, 11:1089. [5] ZHANG YF, ZHOU SZ, CHENG XY, et al.Baicalein attenuates hypertrophic scar formation via inhibition of the transforming growth factor-beta/Smad2/3 signalling pathway[J].Brit J Dermatol, 2016, 174(1):120. [6] O'REILLY MS, BOHEM T, SHING Y, et al.Endostatin:an endogenous inhibitor of angiogenesis and tumor growth[J].Cell, 1997, 88(2):277. doi: 10.1016/S0092-8674(00)81848-6 [7] CUI R, OHASHI R, TAKAHASHI F, et al.Signal transduction mediated by endostatin directly modulates cellular function of lung cancer cells in vitro[J].Cancer Sci, 2007, 98(6):830. doi: 10.1111/j.1349-7006.2007.00459.x [8] 张晓明.重组人内抑素对兔耳创面瘢痕组织血管内皮生长因子、转化生长因子-β1和碱性成纤维细胞生长因子表达的影响[J].解剖学报, 2015, 46(1):101. [9] GONG YF, ZHANG XM, LIU F, et al.Inhibitory effect of recombinant human endostatin on the proliferation of hypertrophic scar fibroblasts in a rabbit ear model[J].Eur J Pharmacol, 2016, 791:647. doi: 10.1016/j.ejphar.2016.09.034 [10] GONG YF, ZHANG XM, YU J, et al.Effect of recombinant human endostatin on hypertrophic scar fibroblast apoptosis in a rabbit ear model[J].Biomed Pharmacother, 2017, 91:680. doi: 10.1016/j.biopha.2017.04.116 [11] 刘景生.细胞信息与调控[M].2版, 北京:中国协和医科大学出版社, 2004:310. [12] XU L, XIE Q, QI L, et al.Bcl-2 overexpression reduces cisplatin cytotoxicity by decreasing ER-mitochondrial Ca2+ signaling in SKOV3 cells[J].Oncol Rep, 2017, 39(3):985. [13] FLOREA AM, BUSSELBERG D.Anti-cancer drugs interfere with intracellular calcium signaling[J].Neurotoxicology, 2009, 30(5):803. doi: 10.1016/j.neuro.2009.04.014 [14] HAAK LL, GRIMALDI M, SMAILISS, et al.Mitochondria regulate Ca2+ wave initiation and inositol trisphosphate signal transduction in oligodendrocyte progenitors[J].J Neurochem, 2002, 80(3):405. doi: 10.1046/j.0022-3042.2001.00727.x [15] PAREKH AB, PENNER R.Store depletion and calcium influx[J].Physiol Rev, 1997, 77(4):901. [16] YIU AJ, IBEH CL, ROY SK, et al.Melamine induces Ca2+-sensing receptor activation and elicits apoptosis in proximal tubular cells[J].Am J Physiol Cell Physiol, 2017, 31(1):C27. [17] ANSARI N, HADI- ALIJANVAND H, SABBAGHIAN M, et al.Interaction of 2-APB, dantrolene, and TDMT with IP3R and RyR modulates ER stress-induced programmed cell death Ⅰ and Ⅱ in neuron-like PC12 cells:an experimental and computational investigation[J].J Biomol Struct Dyn, 2014, 32(8):1211. doi: 10.1080/07391102.2013.812520 [18] KUHR FK, SMITH KA, SONG MY, et al.New mechanisms of pulmonary arterial hypertension:role of Ca2+ signaling[J].Am J Physiol Heart Circ Physiol, 2012, 302(8):H1546. doi: 10.1152/ajpheart.00944.2011 [19] 孙文武, 胡芬, 杨文修.热和低渗刺激活化胞外Ca2+内流机制升高大鼠滑膜细胞[Ca2+]i[J].科学通报, 2007, 52(23):2752. doi: 10.3321/j.issn:0023-074x.2007.23.010 [20] ZHANG S, CHEN Y, WU X, et al.The pivotal role of Ca2+ homeostasis in PBDE-47-induced neuronal apoptosis[J].Mol Neurobiol, 2016, 53(10):7078. doi: 10.1007/s12035-015-9573-8 [21] LAZZARI C, PEGGION C, STELLA R, et al.Cellular prion protein is implicated in the regulation of local Ca2+ movements in cerebellar granule neurons[J].J Neurochem, 2011, 116(5):881. doi: 10.1111/j.1471-4159.2010.07015.x [22] SATO E, WILLIAMS MR, SANFORD JA, et al.The parathyroid hormone family member TIP39 interacts with sarco/endoplasmic reticulum Ca2+-ATPase activity by influencing calcium homoeostasis[J].Exp Dermatol, 2017, 26(9):792. doi: 10.1111/exd.13294 [23] OUCHI J, RYU SY, JHUN BS, et al.Mitochondrial ion channels/transporters as sensors and regulators of cellular redox signaling[J].Antioxid Redox Signal, 2014, 21(6):987. doi: 10.1089/ars.2013.5681 [24] 郭静, 蒲咏梅, 张东才.钙离子信号与细胞凋亡[J].生物物理学报, 2005, 21():1. doi: 10.3321/j.issn:1000-6737.2005.01.001 -





 下载:
下载: