-
乳腺癌是女性最常见的恶性肿瘤之一,严重危害女性健康和生命[1-2],向临床提供安全、有效的抗肿瘤药物是当今医药工作者的使命。热休克蛋白90(heat shock protein, Hsp90)在肿瘤细胞中的表达比正常细胞高2~10倍,并可调控众多信号蛋白的构象成熟和稳定性,在肿瘤细胞生长、分化、凋亡等方面发挥重要作用,已成为抗肿瘤药物研究的重要靶点之一[3-5]。格尔德霉素(geldanamycin, GA)是第一个鉴定出的Hsp90抑制剂,虽然其抗肿瘤活性很强,但是由于具有肝毒性强、水溶性差等缺点,严重限制了临床上的应用[6-7]。糖基化修饰是提高化合物水溶性的最常用方法之一,不仅可以增加化合物的水溶性和稳定性,丰富结构多样性,并可改善药物在体内的药代动力学性质,有利于药物的药效发挥[8]。最近,本课题组通过体外酶法糖基化反应制备了若干个GA衍生物糖基化产物,但是对低毒性的非苯醌GA衍生物17-demethoxy-reblastatin(17-DR)糖基化产物的准确结构及其抗肿瘤活性未进行研究报道[9-10]。因此,本研究中将通过体外酶法糖基化法制备新型非苯醌GA糖基化衍生物,并利用ESI-MS和NMR波谱解析鉴定其结构,同时探讨和阐明新型非苯醌GA糖基化衍生物对Hsp90活性、人乳腺癌MCF-7细胞增殖、凋亡的影响,为今后的持续研究提供科学依据。
-
17-DR分子式为C28H42N2O7,由本课题组从Streptomyces hygroscopicus JCM- 4427菌株中提取分离得到,并经NMR数据分析并与文献[11]比较确认。DMEM培养基和胰酶购于Gibco公司;胎牛血清购于浙江四季青公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)、UDP-glucose(UDP-Glc)购自Sigma-Aldrich公司;碘化丙啶(PI)购买于BD Bioscience公司;乙腈(色谱纯)购自Thermo Fisher公司;Akt抗体购于Cell signaling公司;Akt抗体购自Proteintech公司;Bcl抗体Hsp90α抗体购于Stressgen公司;其他常用试剂均为国产分析级。
-
人乳腺癌MCF-7细胞购于中科院上海细胞库。MCF-7细胞培养于DMEM培养基,加入10%胎牛血清、1×105 IU/L青霉素、100 mg/L链霉素,置于37℃、饱和湿度、5% CO2培养箱中培养,并用0.25%胰酶消化后传代培养。
-
根据前期研究基础[9-10, 12],本研究中采用的体外酶法糖基化反应条件为:100 mL的Tris-HCl反应缓冲液(100 mmol/L, pH 8.0),其中包括1 mmol/L的MgCl2,50 μg/L的YjiC蛋白(糖基转移酶),1 mmol/L的UDP-Glc,1 mmol/L的底物(17-DR),在30℃反应14 h。待反应结束后,于100℃沸水中煮沸10 min停止反应,并进行分析与精制。取适量的糖基化反应产物经高效液相色谱仪(Waters 2535Q,美国Waters公司)分析色谱条件为SunFireTM C18(4.6 mm×150 mm)色谱柱,梯度洗脱(0~20 min,20%~100%乙腈;20~30 min,100%乙腈),流速为1 mL/min。糖基化反应液经Waters 2535Q半制备高效液相色谱进行精制,其色谱条件为SunFireTM C18(10 mm×250 mm)色谱柱,流动相(溶剂A为乙腈;溶剂B为水),等度洗脱(0~30 min,10%溶剂A),流速为3 mL/min,检测波长为254 nm,获得化合物1(11.5 mg)。
-
将2 μmol/L的酵母Hsp90-his融合蛋白置于96孔板中,每孔加入不同浓度的化合物及Tris-HCl反应缓冲液(100 mmol/L的Tris-HCl;20 mmol/L的KCl;6 mmol/L的MgCl2;pH 7.4),混均匀后置37℃反应2.5 h。待反应结束后每孔加入80 μL的malachite green-molybda溶液显色,并用酶标仪620 nm检测吸光度(A),并计算出各化合物抑制Hsp90 ATPase活性的IC50值。以上实验重复3次[11, 13]。
-
将处于对数生长期的MCF-7细胞接种于96孔板中,每孔细胞数量为6×103,并置于37℃、饱和湿度、5% CO2培养箱中培养过夜。待细胞贴壁后,分别加入不同浓度的17-DR(0、2.5、5、10、20、40、80、100 μmol/L)和化合物1(0、5、10、25、50、100、200、400 μmol/L)后24、48、72 h后终止培养。每孔加入15 μL的MTT溶液在37℃孵育4 h,除去培养液,并加入DMSO 100 μL孵育10 min,用酶标仪在490 nm波长下检测每孔的A值,并计算细胞存活率。以上实验重复3次。
-
将处于对数生长的MCF-7细胞按每孔1×105的密度接种于6孔板贴壁过夜后,按不同浓度化合物1(0、50、100、200 μmol/L)处理24 h后收集细胞,洗涤。用适量0.9%氯化钠溶液重悬细胞,加入30 μg/mL PI染色15 min,洗涤,再经300 μL 0.9%氯化钠溶液重悬细胞,上流式细胞仪(Becton Dickinson C6)进行检测。检测具有亚G1期DNA含量的细胞比例,代表凋亡细胞数,计算总数6000个细胞。
-
将MCF-7细胞接种于6孔细胞培养板3×105/孔,培养24 h后给予不同浓度的化合物1(0、50、100、200 μmol/L)。冰PBS清洗后,滤纸吸干液体后加入细胞裂解液,每孔200 μL,置冰上30 min,刮下细胞,转移至1.5 mL离心管内置于-80℃冻存,经3次反复冻融后用BCA蛋白定量法测各组蛋白浓度,调蛋白浓度后加上样缓冲液,煮沸5 min变性。每组取蛋白40 μg,经SDS-PAGE后转移至PVDF膜,封闭过夜后,置相关蛋白的一抗(Akt、Bcl-2、Hsp90α)、二抗,ECL发光试剂盒发光、显影、定影,Bio-Rad凝胶成像系统获取图像。
-
采用方差分析和q检验。
-
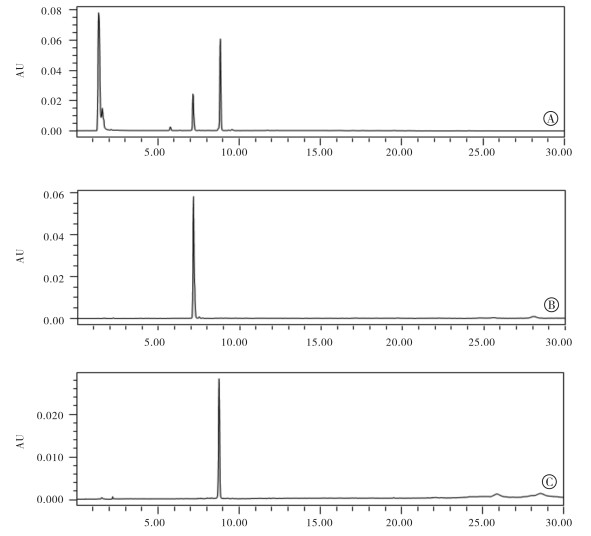
HPLC分析结果(见图 1)显示,非苯醌GA衍生物17-DR的体外酶法糖基化反应液中可观察到其糖基化产物峰的存在。17-DR峰(底物)的保留时间(tR)为8.8 min,与此对应的糖基化产物峰tR为7.2 min。
-
化合物1为白色粉末,其分子式为C34H52N2O12,ESI-MS [M-H]-m/z 679;1H-NMR(700 MHz, DMSO-d6)数据为:δH 9.45(-NH, s), 7.0(1H, brd, H-19), 6.54 (1H, s, H-17), 6.49 (1H, s, H-21), 5.80 (1H, brs, H-3), 5.27 (1H, d, J=9.1 Hz), 4.85 (1H, d, J=7.7 Hz, H-7), 4.74 (1H, d, J=7.0 Hz, H-1′), 3.69 (1H, d, J=10.5 Hz, H-6′), 3.50 (1H, dd, J=5.6, 10.5 Hz, H-6′), 3.32 (3H, s, 6-OCH3), 3.22 (3H, s, 12-OCH3), 3.20 (1H, m, H-11), 3.18-3.25 (overlap, H-6, H-3′, H-4′, and H-5′), 3.0 (2H, m, H-12 and H-2′), 2.34-2.60 (overlap, H-13 and H-15), 2.33 (1H, m, H-10), 2.14 (2H, m, H-4), 1.75 (1H, m, H-14), 1.71 (3H, s, H-22), 1.39 (3H, s, H-23), 1.23 (2H, m, H-5), 0.90 (3H, d, J=6.3 Hz, H-24), 0.78 (3H, d, J=5.6 Hz, H-25);13C-NMR (175 MHz, DMSO-d6)数据为:δC 170.7(C-1), 157.6 (C-18), 156.1(7-OCONH2), 141.5 (C-16), 139.9 (C-20), 134.7 (C-3), 133.3 (C-9), 131.9 (C-2), 129.8 (C-8), 117.0 (C-21), 112.9 (C-17), 106.7 (C-19), 100.7 (C-1′), 80.7 (C-7, C-12, and C-2′), 79.4 (C-6), 77.1 (C-5′), 76.7 (C-3′), 73.2 (C-11), 69.6 (C-4′), 60.6 (C-6′), 58.3 (6-OCH3), 56.4 (12-OCH3), 42.7 (C-13 and C-15), 33.9 (C-10), 30.9 (C-14), 29.7 (C-5), 23.4 (C-4), 19.1 (C-25), 16.3 (C-24), 13.1 (C-22), 11.8 (C-23)。化合物1除了具有17-DR类似的波谱特征之外,还具有1分子葡萄糖单元信号[δH 4.74 (H-1′), 3.0 (H-2′), 3.18-3.25 (H-3′, H-4′, H-5′), 3.69 (H-6′), 3.50 (H-6′), 和δC 100.7 (C-1′), 80.7 (C-2′), 76.7 (C-3′), 69.6 (C-4′), 77.1 (C-5′), 60.6 (C-6′)][11]。进一步,根据HMBC确认了化合物1中的糖分子、甲氧基、7-氨基甲酰基等主要官能团的连接位置(H-1′/C-18, 6-OCH3/C-6, 12-OCH3/C-12, H-7/C-6, 7-OCONH2, C-8等)(见图 2)。因此,新化合物1的结构鉴定为17-demethoxy-reblastatin-18-O-β-D-glucopyranoside。
-
本研究通过体外酶法糖基化反应制备了化合物1,并发现化合物1具有较强的特异性地抑制酵母Hsp90蛋白ATPase活性。结果显示,化合物1显著地抑制Hsp90活性,其IC50值为8.98 μmol/L,而经典的Hsp90抑制剂GA的IC50值为3.06 μmol/L (见表 1)。
分组 IC50/ (μmol/L) F P MS组内 化合物1 8.98±0.56 — — — 17-DR 1.82±0.13** 347.78 < 0.01 0.126 GA 3.06±0.22△△ 859.83 < 0.01 0.244 q检验:与化合物1比较**P < 0.01;与17-DR比较△△P < 0.01 表 1 化合物1抑制Hsp90 ATPase活性(ni=3;x±s)
-
结果表明,化合物1具有一定的抑制乳腺癌MCF-7细胞增殖的作用,并呈现时间与浓度依赖性,作用于MCF-7细胞72 h的IC50值为81.84 μmol/L (见图 3)。
-
PI染色/流式细胞术结果显示,化合物1具有一定的诱导MCF-7细胞凋亡的能力,并呈现浓度依赖性,不同浓度化合物1(50、100、200 μmol/L)其诱导肿瘤细胞凋亡率分别为5.4%、6.1%、14.3%,用200 μmol/L的化合物1处理细胞组诱导细胞凋亡与阴性对照组2.4%比较差异有统计学意义(P < 0.05) (见图 4)。
-
结果显示,Hsp90顾客蛋白Akt和Bcl-2随着化合物浓度的增加,其表达逐渐下调,呈现浓度依赖关系,而对Hsp90蛋白表达基本不产生影响(见图 5)。与阴性对照组相比,不同浓度的化合物1诱导Akt和Bcl-2蛋白下调率分别为5%、20%、51%和10%、29%、51%(见表 2)。
化合物/(μmol/L) Akt Bcl-2 Hsp90 0 1.00±0.02 1.00±0.15 1.00±0.11 50 0.95±0.03 0.90±0.01 0.86±0.04* 100 0.80±0.03* 0.71±0.05* 0.88±0.03* 200 0.49±0.07** 0.49±0.04** 0.87±0.04* F 25.20 15.81 7.09 P < 0.01 < 0.01 < 0.05 MS组内 0.005 0.008 0.010 与0 μmol/L组比较**P < 0.01或*P < 0.05 表 2 Akt、Bcl-2和Hsp90蛋白表达灰度值的定量分析结果(ni=3;x±s)
-
伴侣蛋白Hsp90在肿瘤的发生、发展及转移中起重要作用,Hsp90的顾客蛋白包括酪氨酸激酶受体(EGFR、Her-2)、亚稳信号蛋白(Akt、Raf-1)、突变信号蛋白(v-Src、p53)、转绿因子(HIF-1α)等,这些顾客蛋白均是当前抗肿瘤药物发现与开发的靶点[14]。目前已有多个Hsp90抑制剂进入了治疗乳腺癌临床试验阶段,并表现出良好的应用前景,如17-AAG、PF-4942947、PU-71等。GA作为Hsp90抑制剂的典型代表,具有很强的抗癌活性,但由于其水溶性差、肝毒性强等缺点,使其在临床应用上受到了限制[7]。寻求水溶性更好、不良反应更低的GA衍生物成为了GA系列抗癌新药研发的主要方向之一。因此,本研究以低肝毒性的17-DR为底物,通过体外酶法糖基化反应进行结构修饰,制备出了水溶性的新型非苯醌GA糖基化衍生物(1),为今后的GA系列抗肿瘤药物研究提供物质基础。
天然药物具有结构独特、多样、低毒性等优点,亦是新药研发中先导化合物的重要来源之一。然而,某些天然产物因水溶性低、稳定性差等原因,极大地限制了其临床应用。研究[8, 15]表明,糖基化结构修饰可增强化合物的稳定性,提高水溶性和靶向性,并改善活性和药代动力学性质。体外酶法糖基化法不仅操作简单、方便,有效地控制反应条件,并且可以精确地检测反应产物。本研究中使用的来源于Bacillus licheniformis DSM-13的糖基转移酶,具有广泛的底物选择特异性,可通过酚羟基或醇羟基将糖供体(NDP-sugar)上的糖分子连接至不同结构的底物[9-10, 12, 16]。本研究为鉴定化合物1的化学结构,利用1D-NMR和2D-NMR解析确定了基本骨架、糖分子与苷元,其他主要官能团(甲氧基、氨甲酰基等)的连接位置。特别是通过糖分子端基质子信号的耦合常数(J=7.0 Hz),确认了化合物1的葡萄糖苷键以β构型存在。
化合物1以Hsp90为靶点,同时作用于多条信号通路,比作用于单一信号通路的药物在抗肿瘤活性方面可具有一定的优势。化合物1作为GA衍生物,我们推测其可通过和ATP竞争性地与Hsp90的N-末端结合,继而通过泛素化蛋白酶途径降解其顾客蛋白。生物活性结果显示,化合物1抑制Hsp90 ATPase活性、MCF-7细胞增殖的作用,虽然活性强度与底物比较有所下降,这与GA系列糖基化修饰可降低体外活性的一些报道相吻合[17]。同时,化合物1具有诱导MCF-7细胞凋亡的作用,其可能机制是通过下调Hsp90顾客蛋白Akt和Bcl-2相关。有趣的是,不同浓度的化合物1对肿瘤细胞内Hsp90蛋白表达均没有影响,表明其抑制Hsp90活性只是抑制Hsp90 ATPase活性来抑制Hsp90伴侣功能,与以往的文献[13, 18]报道一致。
综上所述,化合物1作为新型结构的非苯醌GA糖基化衍生物,具有抑制Hsp90活性、抗增殖及诱导凋亡的作用,有一定的应用前景。然而,本研究只探讨了化合物1的体外抗乳腺癌作用,体内抗乳腺癌作用及其机制尚有待进一步于深入研究。
新型格尔德霉素葡萄糖苷的制备及其诱导人乳腺癌MCF-7细胞凋亡的作用
Preparation of a novel geldanamycin glucoside and its induction effects on the apoptosis of human breast cancer MCF-7 cells
-
摘要:
目的对非苯醌格尔德霉素进行酶法糖基化修饰,并探讨其糖基化产物对乳腺癌细胞增殖、凋亡的影响。 方法利用体外酶法糖基化反应制备新型非苯醌格尔德霉素糖基化产物,并经质谱和核磁共振解析鉴定其结构。采用孔雀绿-钼酸铵显色反应、MTT法、PI单染/流式细胞术检测化合物的体外抗肿瘤活性。免疫印迹法检测化合物对Akt、Bcl-2及热休克蛋白90(Hsp90)表达的影响。 结果新型非苯醌格尔德霉素糖基化产物鉴别为17-demethoxy-reblastatin-18-O-β-D-glucopyranoside(1)。化合物1具有显著抑制Hsp90 ATPase活性,其IC50值为8.98 μmol/L。化合物1对人乳腺癌MCF-7细胞表现出一定的抑制增殖、诱导凋亡的作用,且呈现浓度依赖性。免疫印迹法结果显示,随着化合物1浓度的增加,诱导Akt和Bcl-2蛋白的降解越明显,而对Hsp90蛋白的表达没有影响。 结论新型Hsp90抑制剂化合物1具有抑制MCF-7细胞增殖、诱导凋亡能力,其机制可能是通过抑制Hsp90 ATPase活性以及诱导降解Hsp90顾客蛋白Akt和Bcl-2有关。 Abstract:ObjectiveTo explore the effects of the enzymatic glycosylation product modified by enzymatically non-benzoquinone geldanamycin(GA) on the proliferation and apoptosis of breast cancer cells. MethodsA new non-benzoquinone GA glucoside was prepared using enzymatic glycosylation in vitro.The product was characterized by ESI-MS and nuclear magnetic resonance(NMR) analysis.The anti-cancer activities of the compound were evaluated using malachite green-molybda colour reaction, MTT assay and flow cytometry with PI staining in vitro.The effects of the compound on expression levels of Akt, Bcl-2 and heat shock protein 90(Hsp90) were detected using Western blot. ResultsThe structure of novel non-benzoquinone GA glucoside was characterized as 17-demethoxy-reblastatin-18-O-β-D-glucopyranoside(1).Compound 1 could significantly inhibit the activity of Hsp90 ATPase, the IC50 value of which was 8.98 μmol/L.Compound 1 could inhibit the proliferation, and induce apoptosis in MCF-7 cells of human breast cancer in a concentration-dependent manner.The results of Western blot showed that, with the increasing of compound 1 concentration, the induced degradation of Akt and bcl-2 protein was more obvious, while the expression of Hsp90 protein was not affected. ConclusionsThe new Hsp90 inhibitor, compound 1, can inhibit the proliferation, and induce apoptosis of MCF-7 cells, the mechanism of which may be by inhibiting the activity of Hsp90 ATPase, and inducing the degradation of Hsp90 client protein Akt and Bcl-2. -
Key words:
- breast neoplasms /
- geldanamycin /
- heat shock protein 90 /
- glycosylation /
- apoptosis
-
表 1 化合物1抑制Hsp90 ATPase活性(ni=3;x±s)
分组 IC50/ (μmol/L) F P MS组内 化合物1 8.98±0.56 — — — 17-DR 1.82±0.13** 347.78 < 0.01 0.126 GA 3.06±0.22△△ 859.83 < 0.01 0.244 q检验:与化合物1比较**P < 0.01;与17-DR比较△△P < 0.01 表 2 Akt、Bcl-2和Hsp90蛋白表达灰度值的定量分析结果(ni=3;x±s)
化合物/(μmol/L) Akt Bcl-2 Hsp90 0 1.00±0.02 1.00±0.15 1.00±0.11 50 0.95±0.03 0.90±0.01 0.86±0.04* 100 0.80±0.03* 0.71±0.05* 0.88±0.03* 200 0.49±0.07** 0.49±0.04** 0.87±0.04* F 25.20 15.81 7.09 P < 0.01 < 0.01 < 0.05 MS组内 0.005 0.008 0.010 与0 μmol/L组比较**P < 0.01或*P < 0.05 -
[1] SIEGEL RL, MILLER KD, JEMAL A.Cancer statistics[J].CA Cancer J Clin, 2016, 66(1):7. doi: 10.3322/caac.21332 [2] 程秀, 陈超, 蒋志文, 等.氯喹增强乳腺癌细胞对他莫昔芬化疗敏感性的作用研究[J].蚌埠医学院学报, 2017, 42(6):705. [3] WANG Y, KOAY YC, MCALPINE SR.How selective are heat shock protein 90(Hsp90) inhibitors for cancer cells over normal cells?[J].Chem Med Chem, 2017, 12(5):353. doi: 10.1002/cmdc.201600595 [4] WHITESELL L, LINDQUIST SL.Hsp90 and the chaperoning of cancer[J].Nat Rev Cancer, 2005, 5(10):761. doi: 10.1038/nrc1716 [5] SHRESTHA L, BOLAENDER A, PATEL HJ, et al.Heat shock protein (HSP) drug discovery and development:targeting heat shock proteins in disease[J].Curr Top Med Chem, 2016, 16(25):2753. doi: 10.2174/1568026616666160413141911 [6] WHITESELL L, MIMNAUGH EG, COSTA BD, et al.Inhibition of heat shock protein Hsp90-pp60v-src heteroprotein complex formation by benzoquinone ansamycins:Essential role for stress proteins in oncogenic transformation[J].Proc Natl Acad Sci USA, 1994, 91(18):8324. doi: 10.1073/pnas.91.18.8324 [7] SUPKO JG, HICKMAN RL, GREVER MR, et al.Preclinical pharmacologic evaluation of geldanamycin as an anticancer agent[J].Cancer Chemoth Pharm, 1995, 36(4):305. doi: 10.1007/BF00689048 [8] 栗增, 王江, 周宇, 等.先导化合物结构优化与策略(三):通过化学修饰改善水溶性[J].药学学报, 2014, 49(9):1238. [9] WU CZ, JANG JH, WOO M, et al.Enzymatic glycosylation of nonbenzoquinone geldanamycin analogs via Bacillus UDP-glycosyltransferase[J].Appl Environ Microbiol, 2012, 78(21):7680. doi: 10.1128/AEM.02004-12 [10] HUO Q, LI HM, LEE JK, et al.Biosynthesis of novel glucosides geldanamycin analogs by enzymatic synthesis[J].J Microbiol Biotechnol, 2016, 26(1):56. [11] WU CZ, JANG JH, AHN JS, et al.New geldanamycin analogs from Streptomyces hygrouscopicus[J].J Microbiol Biotechnol, 2012, 22(11):1478. doi: 10.4014/jmb.1206.06026 [12] 李红梅, 李静, 靳伟, 等.新木脂素的酶法糖基化及抗肿瘤活性[J].南方医科大学学报, 2015, 35(11):1570. doi: 10.3969/j.issn.1673-4254.2015.11.10 [13] 李红梅, 聂丽娟, 霍强, 等.Hsp90抑制剂槚如酸对乳腺癌MDA-MB-231细胞增殖、侵袭、迁移的影响[J].南方医科大学学报, 2015, 35(3):355. doi: 10.3969/j.issn.1673-4254.2015.03.08 [14] ZHANG H, BURROWS F.Targeting multiple signal transduction pathways through inhibiton of Hsp90[J].J Mol Med, 2004, 82(8):488. [15] CAO J, CUI S, LI SW, et al.Targeted cancer therapy with a 2-deoxyglucose based Adriamycin complex[J].Cancer Res, 2013, 73(4):1362. [16] PANDY PP, GURUNG RB, PARAJULI P, et al.Assessing acceptor substrate promiscuity of YjiC-mediated glycosylation toward flavonoids[J].Carbohy Res, 2014, 393:26. doi: 10.1016/j.carres.2014.03.011 [17] CHENG H, CAO XH, XIAN M, et al.Synthesis and enzyme specific activation of carbohydrate geldanamycin conjugates with potent anticancer activity[J].J Med Chem, 2005, 48(2):645. [18] GHADBAN T, JESSEN A, REEH M, et al.In vitro study comparing the efficacy of the water-soluble Hsp90 inhibitors, 17-AEPGA and 17-DMAG, with that of the non-water-soluble Hsp90 inhibitor, 17-AAG, in breast cancer cell lines[J].Int J Mol Med, 2016, 38(4):1296. doi: 10.3892/ijmm.2016.2696 -




 下载:
下载: