-
尖锐湿疣作为人乳头状瘤病毒(HPV)感染所致的皮肤黏膜增殖性疾病,主要发生在生殖器部位,严重威胁人类健康,尤其是高危型HPV引起的尖锐湿疣,会导致病人皮损角质形成细胞的过度增殖,极大增加了进展为基底细胞癌或皮肤鳞癌的风险[1-2]。研究[3]表明,尖锐湿疣是一个多基因调控的复杂的发生及进展过程。微小RNA(micro RNA,miR)作为广泛存在于生物体内的高度保守短小RNA,在细胞增殖、分化、凋亡、免疫反应等多种生物学功能中发挥重要作用[4]。有研究[5]指出,尖锐湿疣病人皮损组织中miR-31表达异常,可能参与了其发生、进展过程。本研究拟利用反义寡核苷酸技术(antisense oligonueleotide,ASO)特异性抑制miR-31表达,观察其对人角质形成细胞系HaCaT细胞增殖、凋亡的影响,以期为临床实践提供基础资料。
-
人角质形成细胞系HaCaT细胞购自江苏凯基生物公司,RPMI-1640培养液(含10%胎牛血清)购自美国Gibico公司,青链霉素混合液购自碧云天生物公司,LipofectamineTM2000转染试剂购自美国Invitrogen公司,miR-31基因序列、miR-31 ASO和对照ASO、内参引物均由生工生物工程(上海)股份有限公司设计合成,Trizol总RNA提取试剂盒购自美国Invitrogen公司,逆转录试剂盒及PCR试剂盒购自宝生物公司,四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)均购自美国Sigma公司,Annexin V-FITC/PI凋亡检测试剂盒购自上海高创化学科技有限公司,Transwell小室和基底胶均购自美国Corning公司,BCA蛋白检测试剂盒购自碧云天生物研究所,兔抗Rho相关结构域BTB蛋白质1(RhoBTB1)抗体购自江莱生物公司,ABI实时荧光定量PCR仪购自美国ABI公司,全自动酶标仪购自美国Bio-Rad公司,流式细胞仪购自美国BD公司。
-
将HaCaT细胞培养于RPMI-1640培养液(含10%胎牛血清)中,于37℃、5%CO2条件下恒温培养。细胞处理前24 h,将细胞接种于6孔板中,于细胞汇合度达到60%左右时,利用LipofectamineTM2000转染试剂盒对不同组细胞分别进行转染。ASO组:转染miR-31 ASO,序列:5′-AGCUAUGCCAGCAUCUUGCCU-3′;对照ASO组:转染对照ASO,序列:5′-UUCUCCGAACGUGUCACGUTT-3′;空白对照组:转染空白质粒。
-
取转染后培养48 h细胞,用细胞裂解液进行裂解后,用Trizol总RNA提取试剂盒提取细胞中总RNA,利用紫外分光光度计检测样品纯度,取A260/A280≥1.80的合格样本完成后续实验。利用逆转录试剂盒将总RNA逆转录为单链cDNA,以模板链cDNA作为模板,利用PCR试剂盒进行PCR操作。miR-31及内参引物分别为,miR-31引物:上游5′-CATCTTCAAAAGCGGACACTCT-3′,下游5′-ACAATACATAGCAGGACAGGAAG-3′;U6引物:上游5′-TGCGGGTGCTCGCTTCGGCAGC-3′,下游5′-CCAGTGCAGGGTCCGAGGT-3′。PCR反应条件:94 ℃ 60 s,92 ℃ 45 s,56 ℃ 30 s,74 ℃ 30 s,36个循环。每个样品均设置3个平行反应复孔。以U6为参照,用2-△△Ct法获得不同组细胞中miR-31相对表达量。
-
将各组转染后处于对数生长期细胞接种于96孔板,细胞数约为5×103/孔,分别于培养0、24、48、72、96 h时,每孔加入MTT液20 μL,继续培养4 h,去除孔中培养液后,将DMSO加入,室温条件下振荡8 min,用全自动酶标仪取490 nm波长处,对各孔吸光度(A)值进行测量,以A值代表细胞增殖能力。
-
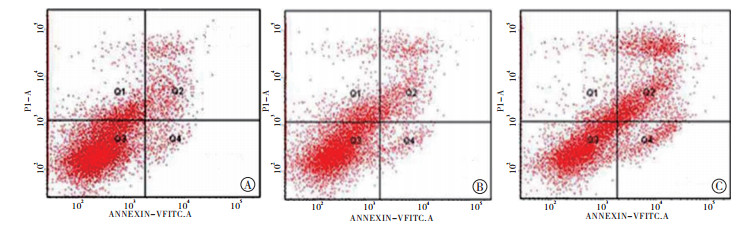
取各组转染后培养48 h细胞,用胰蛋白酶对细胞进行消化后收集细胞,用PBS液洗涤3次,于2000 r/min离心5 min,收集细胞,加入缓冲液重新悬浮,使细胞浓度调整为1×105个/mL,取细胞悬液100μL,放置于流式管中,分别将Annexin V-FITC和PI加入,于避光条件下,振动摇匀10 min,利用流式细胞仪对细胞凋亡情况进行检测。
-
取转染后48 h细胞,胰酶消化后收集细胞,用预冷PBS液洗涤,加入70%乙醇固定,于4 ℃下过夜孵育。加入RNaseA,于37 ℃条件下孵育40 min,取出后放置于冰上以终止RNaseA作用,将PI加入,于4 ℃条件下避光反应30 min,用流式细胞仪检测细胞周期变化。
-
取各组转染后培养48 h细胞,加入细胞裂解液裂解,用总蛋白提取试剂盒对总蛋白进行提取,并用BCA蛋白检测试剂盒进行检测。取总蛋白,用SDS-PAGE进行凝胶电泳,电转移至硝酸纤维素膜上,用5%脱脂奶粉进行封闭60 min,用PBST进行洗膜。滴加兔抗RhoBTB1抗体(1: 1 000稀释),4 ℃下过夜孵育。PBST洗膜3次,将山羊抗兔二抗IgG加入,孵育120 min,PBST洗膜3次,ECL电化学发光反应后,拍照并用Image J图像分析软件进行分析,以GAPDH为内参,获得目的蛋白相对表达量。
-
采用方差分析和q检验。
-
ASO组细胞中miR-31表达量为(0.37±0.09),明显低于对照ASO组(0.91±0.11)和空白对照组(0.89±0.13)(P < 0.01),而对照ASO组和空白对照组差异无统计学意义(P>0.05)。
-
ASO组细胞在24、48、72、96 h时A值均低于对照ASO组和空白对照组(P < 0.05~P < 0.01),而对照ASO组和空白对照组细胞不同时点A值差异均无统计学意义(P>0.05)。3组细胞随着时间推移,A值均较之前有所逐渐增加(P < 0.01)(见表 1)。
分组 n 0h 24h 48h 72h 96h F P MS组内 AOS组 6 0.21±0.04 0.27±0.05 0.41±0.08△# 0.49±0.17△△# 0.70±0.13△△##++-- 19.97 < 0.01 0.011 对照AOS组 6 0.25±0.05 0.43±0.09**△△ 0.56±0.06**△△# 0.73±0.15*△△##++ 0.84±0.08*△△##++ 38.33 < 0.01 0.008 空白对照组 6 0.20±0.03 0.46±0.10**△△ 0.59±0.08**△△# 0.68±0.08*△△## 0.88±0.05*△△##++-- 75.65 < 0.01 0.005 F — 2.52 9.12 10.21 4.99 6.23 — — — P — >0.05 < 0.01 < 0.01 < 0.05 < 0.05 — — — MS组内 — 0.002 0.007 0.006 0.019 0.009 — — — q检验:与AOS组比较*P < 0.05,**P < 0.01;与0h比较△P < 0.05,△△P < 0.01;与24h比较#P < 0.05,##P < 0.01;与48h比较+P < 0.05,++P < 0.01;与72h比较-P < 0.05,--P < 0.01 表 1 不同转染组在不同时点细胞增殖情况比较(A值;x±s)
-
3组细胞凋亡率差异有统计学意义(P < 0.01),ASO组细胞凋亡率明显高于对照ASO组和空白对照组(P < 0.01),而对照ASO组和空白对照组细胞凋亡率差异无统计学意义(P>0.05)(见表 2、图 1)。
分组 n 细胞凋亡率/% AOS组 6 38.2±2.7 对照AOS组 6 23.5±3.1** 空白对照组 6 24.7±3.5** F — 41.14 P — < 0.01 MS组内 — 9.717 q检验:与AOS组比较**P < 0.01 表 2 不同转染组细胞凋亡情况比较(x±s)
-
ASO组G0/G1期细胞比例明显高于对照ASO组和空白对照组,而S期和G2期细胞比例明显低于对照ASO组和空白对照组(P < 0.01)(见表 3、图 2)。
分组 n G0/G1期 S期 G2期 ASO组 6 68.6±2.5 20.4±1.8 11.0±1.3 对照ASO组 6 42.7±2.2** 35.2±1.5** 22.1±1.9** 空白对照组 6 43.3±2.9** 34.8±2.1** 21.9±1.5** F — 201.73 129.26 96.18 P — < 0.01 < 0.01 < 0.01 MS组内 — 4.500 3.300 2.517 q检验:与AOS组比较**P < 0.01 表 3 不同转染组细胞周期的变化(x±s;%)
-
Western blotting检测结果显示,ASO组细胞中RhoBTB1蛋白表达量明显高于对照ASO组和空白对照组,差异均有统计学意义(P < 0.01),而对照ASO组和空白对照组细胞中RhoBTB1蛋白表达量差异无统计学意义(P>0.05)(见表 4、图 3)。
分组 n RhoBTB1蛋白表达量 AOS组 6 1.19±0.16 对照AOS组 6 0.72±0.12** 空白对照组 6 0.75±0.13** F — 21.90 P — < 0.01 MS组内 — 0.019 q检验:与AOS组比较**P < 0.01 表 4 不同转染组细胞中RhoBTB1蛋白表达比较(x±s)
-
尖锐湿疣的发生是涉及多因素、多基因参与的复杂过程,引起尖锐湿疣的HPV感染与生殖器部位恶性肿瘤的发生密切相关[6],尖锐湿疣病人皮损处角质形成细胞的过度增殖增加癌变的风险[7]。miR作为一种高度保守的短小RNA,在细胞增殖、分化、凋亡等过程中发挥重要作用,且参与了恶性肿瘤发生及进展过程[8]。研究表明,miR-31在结肠癌[9]、胃癌[10]等恶性肿瘤中呈高表达,亦有研究[5]指出,miR-31在尖锐湿疣病人皮损中呈高表达。为进一步探讨miR-31对HaCaT细胞增殖和凋亡的影响,本研究利用ASO技术特异性抑制miR-31表达,结果显示,ASO组细胞中miR-31表达量明显低于对照ASO组和空白对照组,说明HaCaT细胞中miR-31被特异性抑制。
本研究显示,ASO组细胞在24、48、72、96 h时A值均低于对照ASO组和空白对照组,说明在特异性抑制miR-31表达后,细胞增殖被显著抑制,提示miR-31可能参与了HaCaT细胞增殖过程,在HaCaT细胞大量增殖过程中发挥重要作用。本研究还显示,ASO组细胞凋亡率明显高于对照ASO组和空白对照组,说明特异性抑制miR-31可明显抑制细胞凋亡的发生,进一步对细胞周期分析发现,ASO组G0/G1期细胞比例明显高于对照ASO组和空白对照组,而S期和G2期细胞比例明显低于对照ASO组和空白对照组,说明抑制miR-31表达可阻止细胞从G1期向S期进展,从而影响HaCaT细胞增殖过程,同时加速细胞凋亡的发生。RhoBTB1基因位于人染色体10q21.3区域,是RhoBTB亚家族重要成员,在细胞转录、细胞骨架调控、离子通道装配、蛋白泛素化等过程中发挥重要作用[11],被认为是一种肿瘤抑制因子,在恶性肿瘤组织中呈低表达[12],多项研究[13-14]表明,RhoBTB1是miR-31作用靶点。本研究显示,ASO组细胞中RhoBTB1蛋白表达量明显高于对照ASO组和空白对照组,说明特异性抑制miR-31可促进RhoBTB1蛋白表达,推测miR-31可能通过调控RhoBTB1蛋白表达而实现对HaCaT细胞增殖和凋亡的影响。
综上所述,miR-31可能参与了人角质形成细胞系HaCaT细胞增殖、凋亡过程,可能通过调控RhoBTB1蛋白表达而实现这一生物学过程,但具体作用机制尚待进一步研究明确。
抑制miR-31表达对人角质形成细胞增殖、凋亡的影响研究
Effect of inhibiting the miR-31 expression on the proliferation and apoptosis of human keratinocyte cells
-
摘要:
目的探讨miR-31对人角质形成细胞系HaCaT细胞增殖和凋亡的影响以及可能机制。 方法培养HaCaT细胞,利用瞬时转染的方法,对不同组细胞进行转染。反义寡核苷酸技术(ASO)组:转染微小RNA(miR)-31 ASO;对照ASO组:转染对照ASO;空白对照组:转染空白质粒。MTT法检测不同转染组细胞增殖情况,Annexin V-FITC/PI双染色检测不同转染组细胞凋亡情况,PI单染色法检测不同转染组细胞周期,Western blotting检测不同转染组细胞中Rho相关结构域BTB蛋白质1(RhoBTB1)蛋白表达。 结果ASO组细胞中miR-31表达量明显低于对照ASO组和空白对照组(P < 0.01);ASO组细胞在24、48、72、96 h时吸光度值均低于对照ASO组和空白对照组(P < 0.05~P < 0.01),且3组细胞随着时间推移,吸光度值均较之前逐渐增加(P < 0.01);ASO组细胞凋亡率、G0/G1期细胞比例、RhoBTB1蛋白表达量明显高于对照ASO组和空白对照组(P < 0.01);而S期和G2期细胞比例明显低于对照ASO组和空白对照组(P < 0.01)。 结论miR-31可能参与了人角质形成细胞系HaCaT细胞增殖、凋亡过程,可能通过调控RhoBTB1蛋白表达而实现这一生物学过程。 Abstract:ObjectiveTo investigate the effects of inhibiting the miR-31 expression on the proliferation and apoptosis of human keratinocyte cells, and its mechanism. MethodsThe HaCaT cells were cultured, and transfected using transient transfection method.These cells were divided into the antisense oligonueleotide(ASO) group(treatment with miR-31 ASO), control ASO group(treatment with control ASO) and blank control group(treatment with blank plasmid).The cell proliferation, apoptosis, cell cycle and Rho related domain BTB protein 1(RhoBTB1) expression in three groups were detected using MTT assay, Annexin V-FITC/PI double staining, PI single staining and Western blotting, respectively. ResultsThe expression level of miR-31 in ASO group were significantly lower than that in ASO control group and blank control group(P < 0.01).The absorbance values in ASO group at 24 h, 48 h, 72 h and 96 h were significantry lower than that in ASO control group and blank control group(P < 0.05 to P < 0.01), and the absorbance values in three groups gradually increased as time went on(P < 0.01).The apoptotic rate, proportion of G0/G1 phase cells and expression level of RhoBTB1 protein in ASO group were significantly higher than those in ASO control group and blank control group(P < 0.01), while the proportion of S/G2 phase cells in ASO group were significantly lower than those in ASO control group and blank control group(P < 0.01). ConclusionsmiR-31 may be involved in the proliferation and apoptosis of human keratinocyte cell lines HaCaT cells, which may achieve this biological process by regulating the expression of RhoBTB1 protein. -
Key words:
- microRNA /
- human keratinocyte /
- antisense oligonucleotide /
- proliferation /
- apoptosis
-
表 1 不同转染组在不同时点细胞增殖情况比较(A值;x±s)
分组 n 0h 24h 48h 72h 96h F P MS组内 AOS组 6 0.21±0.04 0.27±0.05 0.41±0.08△# 0.49±0.17△△# 0.70±0.13△△##++-- 19.97 < 0.01 0.011 对照AOS组 6 0.25±0.05 0.43±0.09**△△ 0.56±0.06**△△# 0.73±0.15*△△##++ 0.84±0.08*△△##++ 38.33 < 0.01 0.008 空白对照组 6 0.20±0.03 0.46±0.10**△△ 0.59±0.08**△△# 0.68±0.08*△△## 0.88±0.05*△△##++-- 75.65 < 0.01 0.005 F — 2.52 9.12 10.21 4.99 6.23 — — — P — >0.05 < 0.01 < 0.01 < 0.05 < 0.05 — — — MS组内 — 0.002 0.007 0.006 0.019 0.009 — — — q检验:与AOS组比较*P < 0.05,**P < 0.01;与0h比较△P < 0.05,△△P < 0.01;与24h比较#P < 0.05,##P < 0.01;与48h比较+P < 0.05,++P < 0.01;与72h比较-P < 0.05,--P < 0.01 表 2 不同转染组细胞凋亡情况比较(x±s)
分组 n 细胞凋亡率/% AOS组 6 38.2±2.7 对照AOS组 6 23.5±3.1** 空白对照组 6 24.7±3.5** F — 41.14 P — < 0.01 MS组内 — 9.717 q检验:与AOS组比较**P < 0.01 表 3 不同转染组细胞周期的变化(x±s;%)
分组 n G0/G1期 S期 G2期 ASO组 6 68.6±2.5 20.4±1.8 11.0±1.3 对照ASO组 6 42.7±2.2** 35.2±1.5** 22.1±1.9** 空白对照组 6 43.3±2.9** 34.8±2.1** 21.9±1.5** F — 201.73 129.26 96.18 P — < 0.01 < 0.01 < 0.01 MS组内 — 4.500 3.300 2.517 q检验:与AOS组比较**P < 0.01 表 4 不同转染组细胞中RhoBTB1蛋白表达比较(x±s)
分组 n RhoBTB1蛋白表达量 AOS组 6 1.19±0.16 对照AOS组 6 0.72±0.12** 空白对照组 6 0.75±0.13** F — 21.90 P — < 0.01 MS组内 — 0.019 q检验:与AOS组比较**P < 0.01 -
[1] MARIANI L, VICI P, SULIGOI B, et al.Early direct and indirect impact of quadrivalent HPV (4HPV) vaccine on genital warts:A systematic review[J].Adv Ther, 2015, 32(1):10. [2] DOCHEZ C, BOGERS JJ, VERHELST R, et al.HPV vaccines to prevent cervical cancer and genital warts:an update[J].Vaccine, 2014, 32(14):1595. doi: 10.1016/j.vaccine.2013.10.081 [3] LUO ZY, CHEN Q, YANG H, et al.The prevalence and genotype of human papillomavirus from patients with genital warts in eastern Guangdong province[J].Asian Pac J Cancer Prev, 2015, 16(14):5675. doi: 10.7314/APJCP.2015.16.14.5675 [4] CAI Y, YU X, HU S, et al.A brief review on the mechanisms of miRNA regulation[J].Gen Pro Bio, 2009, 7(4):147. doi: 10.1016/S1672-0229(08)60044-3 [5] 郑擎, 张妤, 蒋筱凌, 等.microRNA-31在尖锐湿疣病人皮损中的表达及其临床意义[J].现代实用医学, 2013, 25(2):179. doi: 10.3969/j.issn.1671-0800.2013.02.035 [6] AKEEL RA.Identification of HPV integration and genomic patterns delineating the clinical landscape of cervical cancer[J].Asian Pac J Cancer Prev, 2015, 16(18):8041. [7] LESZCZYSZYN J, ŁEBSKI I, ŁYSENKO L, et al.Anal warts (condylomata acuminata)-current issues and treatment modalities[J].Adv Clin Exp Med, 2014, 23(2):307. [8] WANG N, XIA S, CHEN K, et al.Genetic alteration regulated by microRNAs in biliary tract cancers[J].Crit Rev Oncol Hematol, 2015, 96(2):262. [9] LI T, LUO W, LIU K, et al.miR-31 promotes proliferation of colon cancer cells by targeting E2F2[J].Biotechnol Lett, 2015, 37(3):523. [10] 李丹波, 徐细明.miR-27 b通过c-MET抑制胃癌细胞的生长、增殖及侵袭转移[J].现代肿瘤医学, 2015, 23(1):26. doi: 10.3969/j.issn.1672-4992.2015.01.08 [11] BERTHOLD J, SCHENKOVA K, RIVERO F.Rho GTPases of the RhoBTB subfamily and tumorigenesis[J].Acta Pharmacol Sin, 2008, 29(3):285. doi: 10.1111/j.1745-7254.2008.00773.x [12] 段仁全, 李红军, 谢京典, 等.Rho相关结构域BTB蛋白质1基因在胃癌组织中的表达及其临床意义[J].中华实验外科杂志, 2015, 32(11):2827. doi: 10.3760/cma.j.issn.1001-9030.2015.11.062 [13] 曹丹, 胡波, 黄封博, 等.抑制miR-31表达对胰腺癌Pane-1细胞系迁移和侵袭的影响及可能机制[J].江苏大学学报(医学版), 2015, 25(2):137. [14] XU RS, WU XD, ZHANG SQ, et al.The tumor suppressor gene RhoBTB1 is a novel target of miR-31 in human colon cancer[J].Int J Oncol, 2013, 42(2):676. -





 下载:
下载: