-
结核病是全球范围内普遍关注的疾病和健康问题,据最新的世界防治结核病日统计数据显示,结核病已成为最致命的传染疾病,全世界范围内每年新增结核病病人约800万,自2016年以来因该病死亡病人约170万[1-2]。近年来,受传播途径未得到有效遏制、结核菌抗体产生等原因导致发病率有回升态势,准确、快速诊断结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染,明确其耐药情况对病人病情控制意义重大。Xpert MTB/RIF法和基因芯片法是近年来出现的以核酸为靶标的分子生物学诊断方法,两种方法均具有检测时间短的优点,但存在费用较高及假阳性等不足。LEE等[3-4]国内外学者均证实这两种方法在鉴别MTB及其耐药性中具有很高的特异度和敏感度。但分子生物学检测与改良罗氏培养法、比例法等检测方法在MTB鉴别、耐药性分析中是否存在明显优势目前尚无明确定论,本文对几种检测方法的优劣性进行比较。
-
MTB标准菌株H37Rν(ATCC27294)、已知耐药谱的MTB临床分离株均由国家结核病防控中心实验室提供。
-
晶芯Ⓡ结核分枝杆菌菌种鉴定、耐药性基因检测试剂盒购于北京博奥生物有限公司;Xpert MTB/RIF分子检测试剂盒购于美国Cepheid公司;比例法药敏培养基、中性罗氏培养基均为自制。SorvallTM LYNX高速离心机和GeneXpert实时荧光检测仪(美国Thermo Fisher Scientific公司);博奥生物LuxScan 10K-B微阵列芯片扫描仪、恒温杂交箱(北京博奥生物有限公司);Bioer TC-XP PCR扩增仪(杭州博日科技公司);TwinCubator杂交仪(法国Mérieux公司)。
-
分别从生物样本库中取标准菌株H37Rν、敏感、耐链霉素菌株、耐多药(multi-drug resistance,MDR)的MTB冻存菌液接种于中性培养基中,在37 ℃恒温培养箱中培养4周。
-
使用无菌接种环分别刮取培养基斜面上的MDR、耐链霉素、敏感和标准菌株H37Rν,尽量刮取多处的菌落置于含有玻璃珠的磨菌瓶中,拧紧瓶盖并在涡旋振荡器上混旋30~60 s,加入密封的PBS缓冲液,使其浑浊度和标准麦氏管一致,获得1 mg/mL的菌液(即1个麦氏浊度)。再将菌液稀释1倍(近似浓度为3×108 cfu/mL)、102倍(3×106 cfu/mL)、104倍(3×104 cfu/mL)、106倍(3×102 cfu/mL)、108倍(3×100 cfu/mL),不含菌落的PBS(菌浓度=0)为阴性对照组,然后进行以下实验,每组实验均重复4次。
-
严格参照《结核病诊断细菌学检验规程》[5]中的标准和步骤开展比例法药敏实验和改良罗氏培养检测。(1)比例法:将标准菌株H37Rν、敏感等4类MTB的5个浓度梯度菌悬液,使用22SWG标准接种环蘸取1环(0.01 mL)菌液,分别接种到硝基苯甲酸培养基(PNB)和噻吩-2-羧酸肼培养基(TCH)表面,菌液尽量均匀分在在培养基斜面,使用恒温培养箱培养5周,每间隔3 d记录每个培养基中菌落生长情况,详细记录时间。(2)改良罗氏培养法,除TCH更换为中性罗氏培养基外,其他同比例法。
-
样品制备:经处理好的上述4种菌类样品置于核酸提取仪中提取核酸,将其进行PCR扩增;获得的基因扩增产物置于基因检测试剂盒进行芯片反应,再将杂交芯片洗干;将其置于芯片扫描仪中对基因耐药性进行判读。
-
取1 mL上述4种菌类样本,按1:2的体积比加入约2 mL样品处理液,充分振荡20 s,室温放置15 min,抽取2 mL处理好的样品进行检测。
-
Xpert MTB/RIF法检测周期最短(1.6~2 h),基因芯片法次之(6~8 h),改良罗氏培养法和比例法检测周期相近(分别为35~40 d和32~45 d)。
-
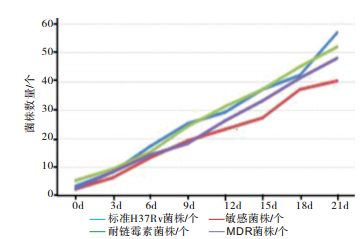
4种菌在3×102 cfu/mL或以上浓度菌悬液在中性罗氏菌培养基、TCH均有菌落生长,但中性罗氏培养基菌落数量明显多于TCH,说明罗氏培养基最低检出限为3×102 cfu/mL。中性罗氏培养基菌落数量与稀释浓度的增加呈增多趋势(见表 1),其与培养时间的关系见图 1。
浓度/
(cfu/mL)标准H37Rν 敏感 耐链霉素 MDR 中性 PNB TCH 中性 PNB TCH 中性 PNB TCH 中性 PNB TCH 0 - - - - - - - - - - - - 3×100 - - - - - - - - - - - - 3×102 45 - + 42 - + 40 - + 41 - + 3×104 34 - + 32 - + 36 - + 35 - + 3×106 30 - + 28 - + 31 - + 30 - + 3×108 23 - + 25 - + 25 - + 22 - + 表 1 改良罗氏培养检测MTB菌落数(cfu)
-
3×104 cfu/mL浓度以下未检测出MTB,≥3×104 cfu/mL菌浓度基因芯片均检出MTB,并且可检出异烟肼(INH)、利福平(RFP)的耐药性(见表 2)。
浓度/
(cfu/mL)H37Rν 敏感 耐链霉素 MDR MTB RFP INH MTB RFP INH MTB RFP INH MTB RFP INH 0 — — — — — — — — — — — — 3×100 — — — — — — — — — — — — 3×102 — — — — — — — — — — — — 3×104 Y N N Y N N Y N N Y y y 3×106 Y N N Y N N Y N N Y y y 3×108 Y N N Y N N Y N N Y y y Y示可鉴别出MTB;y示耐INH和RFP;N示不耐INH、RFP 表 2 基因芯片法对MTB及其耐药性检测结果
-
该方法能依据Ct值确定样本带菌数量,在3×102、3×104、3×106、3×108 cfu/mL浓度菌含量的检测结果依次为“极低”“低”“中”“中”。该结果与相应浓度菌悬液含菌数量完全一致。在3×102 cfu浓度时Xpert MTB/RIF法检测RFP耐药性时有假阳性现象(见表 3)。
浓度/(cfu/mL) H37Rν 敏感 耐链霉素 MDR MTB RFP MTB RFP MTB RFP MTB RFP 0 — — — — — — — — 3×100 — — — — — — — — 3×102 极低 不明确 极低 N 极低 Y 极低 Y 3×104 低 N 低 N 低 N 低 Y 3×106 中 N 中 N 中 N 中 Y 3×108 中 N 中 N 中 N 中 Y N示不耐RFP;Y示有耐药性 表 3 Xpert MTB/RIF法鉴别MTB和RFP耐药性结果
-
结核病是由MTB引起的一种常见传染病,自上世纪90年代以来,多重耐药性结核病在全世界范围内多次爆发,引起了人们的普遍关注[6-8]。结核病具有治疗周期长、治愈难度大且死亡率高的特点,目前已成为全世界公共卫生难题。在结核病的治疗中明确MTB的耐药情况可提升用药的准确性,近几年国内外大量学者[9-10]从遗传学领域尝试阐明MTB耐药性产生的机制,取得了突破性进展。分子生物学技术是近年来用来检测鉴别MTB及其耐药性的主要手段,DNA直接测序法、DNA微阵列芯片法、Xpert MTB/RIF法等都是基于基因型的检测手段,具有检测时间短、操作简单等优势,而培养法和药敏实验平均检测周期在34 d左右,在时效性方面不能满足临床需求。
本文比较了基因芯片法、Xpert MTB/RIF法两种分子生物学方法和改良罗氏培养法、比例法两种传统培养法在鉴别MTB和RFP、INH耐药性情况。在检测周期方面,Xpert MTB/RIF法耗时最短,基因芯片法次之,改良罗氏培养法和比例法最长,时间跨度在5~8周[11]。在MTB鉴别方面,Xpert MTB/RIF法和改良罗氏培养法的MTB最低检出限均为3×102 cfu/mL,较基因芯片法(3×104 cfu/mL)更优,提示Xpert MTB/RIF法对MTB检测的敏感度高于基因芯片法。MTB耐药性检测是结核病病人治疗前的重要步骤,也是指导医师临床用药的关键。虽然Xpert MTB/RIF法较改良罗氏培养法能更快获得结果,较其他分子生物学技术检出限更宽,但国外有学者[12]发现其在结核病常用药RFP耐药性检测中有假阳性情况,其假阳性率高达33.3%。张瑞雪[13]对结核性脑膜炎病人进行GeneXpert MTB/RIF耐药性检测中发现1例假阳性情况。本研究中Xpert MTB/RIF法在3×102 cfu/mL时RFP耐药性检测中也有假阳性情况,而浓度在3×104 cfu/mL及以上RFP耐药性无假阳性出现。提示当MTB含量在3×104 cfu/mL以下时其鉴别和耐药性检测结果没有可信度,必须结合其他检测手段综合判断,从而为临床治疗提供指导。Xpert MTB/RIF法的缺点是无法检测INH的耐药性,这与黄少君[14-15]等研究结果吻合。
分子生物学技术在MTB鉴别和耐药性检测方面有明显的优势,相信随着分子生物学技术的不断成熟其在结核病诊治方面会取得关键性突破。本研究中,相较于传统的培养法和比例法,基因芯片法有检出限窄的劣势,在RFP等常用抗结核菌耐药性检测方面Xpert MTB/RIF法存在假阳性的情况,但是分子生物学技术检测周期较短,能够为危重结核病病人治疗提供指导。
分子生物学方法在结核分枝杆菌及其耐药性检测中的价值
Value of molecular biology method in detection of Mycobacterium tuberculosis and its drug resistance
-
摘要:
目的探讨分子生物学方法在结核分枝杆菌(Mycobacterium tuberculosis,MTB)及其耐药性检测中的价值。 方法以MTB标准菌株H37Rν作为对照,以单耐药及耐多药的MTB行梯度浓度稀释后作为检测样本,分析Xpert MTB/RIF法、基因芯片法、改良罗氏培养法、比例法检测MTB的准确性、最低检出限及检测周期等。 结果改良罗氏培养法和Xpert MTB/RIF法检测MTB下限均为3×102 cfu/mL,基因芯片法检出下限为3×104 cfu/mL;Xpert MTB/RIF法在3×102 cfu/mL时检测利福平耐药性存在假阳性现象,无法检测异烟肼的耐药性;Xpert MTB/RIF法检测周期≤2 h,而基因芯片法≤8 h,比例法和改良罗氏培养法检测周期在5~8周。 结论在MTB及其耐药性检测中分子生物学方法的检测周期优势明显,在最低检出限和准确性方面各有优势,因此,临床诊断中综合考虑病人的经济水平和病情危重程度,选择合适的检测方法。 -
关键词:
- 结核分枝杆菌 /
- Xpert MTB/RIF法 /
- 基因芯片法 /
- 耐药性
Abstract:ObjectiveTo explore the value of molecular biology method in the detection of Mycobacterium tuberculosis (MTB) and its drug resistance. MethodsThe accuracy, minimum detection limit and detection period of Xpert MTB/RIF assay, gene chip assay, modified Roche culture assay and proportion assay in detecting MTB were analyzed using standard MTB strain H37Rr as control, and single-drug resistant and multi-drug resistant MTB diluted gradiently as the test sample. ResultsThe minimum detection limit of modified Roche culture assay and Xpert MTB/RIF assay was 3×102 cfu/mL, which was 3×104 cfu/mL for gene chip assay.Xpert MTB/RIF assay resulted in false-positive rifampicin resistance when the concentration was 3×102 cfu/mL, and could not detect isoniazid resistance.The detection period of Xpert MTB/RIF assay was ≤ 2 h, which was ≤ 8 h for gene chip assay, and five to eight weeks for modified Roche culture assay and proportion assay. ConclusionsIn the detection of MTB and its drug resistance, molecular biology methods have obvious advantages in detection period, and each method has its own advantages in the minimum detection limit and accuracy.The economic level and critical degree of patients should be considered in the clinical diagnosis, so to choose appropriate detecting method. -
Key words:
- Mycobacterium tuberculosis /
- Xpert MTB/RIF assay /
- gene chip assay /
- drug resistance
-
表 1 改良罗氏培养检测MTB菌落数(cfu)
浓度/
(cfu/mL)标准H37Rν 敏感 耐链霉素 MDR 中性 PNB TCH 中性 PNB TCH 中性 PNB TCH 中性 PNB TCH 0 - - - - - - - - - - - - 3×100 - - - - - - - - - - - - 3×102 45 - + 42 - + 40 - + 41 - + 3×104 34 - + 32 - + 36 - + 35 - + 3×106 30 - + 28 - + 31 - + 30 - + 3×108 23 - + 25 - + 25 - + 22 - + 表 2 基因芯片法对MTB及其耐药性检测结果
浓度/
(cfu/mL)H37Rν 敏感 耐链霉素 MDR MTB RFP INH MTB RFP INH MTB RFP INH MTB RFP INH 0 — — — — — — — — — — — — 3×100 — — — — — — — — — — — — 3×102 — — — — — — — — — — — — 3×104 Y N N Y N N Y N N Y y y 3×106 Y N N Y N N Y N N Y y y 3×108 Y N N Y N N Y N N Y y y Y示可鉴别出MTB;y示耐INH和RFP;N示不耐INH、RFP 表 3 Xpert MTB/RIF法鉴别MTB和RFP耐药性结果
浓度/(cfu/mL) H37Rν 敏感 耐链霉素 MDR MTB RFP MTB RFP MTB RFP MTB RFP 0 — — — — — — — — 3×100 — — — — — — — — 3×102 极低 不明确 极低 N 极低 Y 极低 Y 3×104 低 N 低 N 低 N 低 Y 3×106 中 N 中 N 中 N 中 Y 3×108 中 N 中 N 中 N 中 Y N示不耐RFP;Y示有耐药性 -
[1] 程婉秋, 崔月颖, 王小万.结核病患者生命质量研究进展与评价[J].中国防痨杂志, 2018, 13(1):106. [2] 陆伟.直面老龄化趋势重视老年肺结核[J].结核病与肺部健康杂志, 2018, 7(3):153. [3] LEE SH, LEE SH.Diagnostic usefulness of bronchoalveolar lavage fluid Xpert MTB/RIF in patients with suspected pauci-bacillary pulmonary tuberculosis[J].Open Forum Infect Dis, 2017, 4(Suppl 1):S621. [4] 李晓非, 梁桂亮, 普冬, 等.基因芯片技术在分枝杆菌菌种鉴定和结核耐药性检测中的应用及评价[J].中国实验诊断学, 2015, 19(2):204. [5] 吴龙章, 钟炳棠, 刘燕文, 等.对《结核病诊断细菌学检验规程》的一点看法[J].中国防痨杂志, 2012, 34(3):192. [6] 丁百兴, 王明贵.多重耐药结核病的严峻形势[J].中国感染与化疗杂志, 2016, 21(1):49. [7] 郑飞跃, 李茜, 柳琳, 等.多重耐药结核杆菌的耐药机制及药物治疗原则[J].药品评价, 2010, 7(22):24. [8] 谢建宁, 王兆莉, 戴怡蘅, 等.NICU多重耐药菌筛查及耐药性分析[J].中国妇幼保健, 2016, 31(22):4744. [9] 温子禄, 王琳, 王军, 等.术后标本行分子生物学检测对结核病患者诊疗的价值[J].中国防痨杂志, 2018, 40(12):1291. [10] JOLOBA M, BWANGA F.Drug resistance in Mycobacterium tuberculosis[M].London:Antimicrob Resist Dev C, 2010. [11] 张威, 李国兰, 徐杰, 等.3种结核病快速诊断新技术与传统方法的对比分析[J].中国卫生检验杂志, 2016(22):3245. [12] WILLIAMSON DA, BASU I, BOWER J, et al.An evaluation of the Xpert MTB/RIF assay and detection of false-positive rifampicin resistance in Mycobacterium tuberculosis[J].Diagn Micr Infect Dis, 2012, 74(2):207. doi: 10.1016/j.diagmicrobio.2012.06.013 [13] 张瑞雪.GeneXpert MTB/RIF对结核性脑膜炎临床诊断价值的评价[D].西安: 第四军医大学, 2016. [14] 黄少君.分子生物学诊断新方法在淋巴结结核诊断中的应用研究[D].北京: 北京市结核病胸部肿瘤研究所, 2016. [15] TAHSEEN S, QADEER E, KHANZADA FM, et al.Use of Xpert(®) MTB/RIF assay in the first national anti-tuberculosis drug resistance survey in Pakistan[J].Int J Tuberc Lung Dis, 2016, 20(4):448. doi: 10.5588/ijtld.15.0645 -





 下载:
下载: