-
神经胶质瘤是大脑中最常见的原发性肿瘤,占所有恶性脑肿瘤的80%[1]。化疗是胶质瘤重要的辅助治疗手段之一,但是由于肿瘤存在异质性的问题,病人对化疗药物的敏感性有很大差异,从而影响了治疗效果。顺铂是胶质瘤化疗的重要药物之一,因此探讨胶质瘤的顺铂耐药分子特征,对开发胶质瘤个体化化疗具有参考意义。泛素特异性肽酶22 (ubiquitin specific peptidase 22,USP22)是泛素水解酶家族一个较新的成员,被证实在多种恶性肿瘤的发生、发展和转移中扮演重要角色[2-3]。大量的研究发现USP22在多种肿瘤中表达增高,其异常高表达常预示肿瘤即出现转移或出现化疗耐药[4-5]。其中,李朝晖等[6]检测到USP22基因在胶质瘤细胞中高表达,并且证实USP22基因在胶质瘤细胞的增殖中发挥重要作用。王宛明等[7]发现抑制USP22表达可增加胰腺癌细胞对化疗药物吉西他滨的敏感性。但是,USP22是否与胶质瘤耐药相关尚未有文献报道。本研究探讨在胶质瘤中USP22的表达是否参与其顺铂耐药,从而发掘胶质瘤顺铂耐药的潜在分子机制,为胶质瘤化疗提供新的理论依据。
-
人胶质瘤细胞株U251购自中科院上海细胞所。DMEM培养基、胎牛血清购自美国Gibco公司。顺铂(cisplatin)购自美国Sigma公司。USP22单克隆抗体为美国Santa Cruz公司的产品。Lipofectamine 2000试剂、CCK-8试剂盒和Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
-
参照文献[8],用顺铂剂量梯度爬升筛选方法将U251细胞体外培养10个月,建立顺铂耐受细胞株(U251/CP2)。采用CCK-8方法,测定细胞的顺铂半数抑制浓度(IC50),鉴定所诱导的U251/CP2细胞株的耐药性。
-
利用Lipofectamine 2000将USP22-shRNA表达质粒与病毒包装混合质粒共转染至293T细胞,进行病毒包装。收集病毒液后分别感染U251和U251/CP2细胞,polybrene筛选稳定干扰USP22表达的细胞克隆。RT-PCR法检测细胞USP22 mRNA表达水平,鉴定沉默效果。
-
转染24 h后,收集细胞。PBS洗涤2次,重悬于500 μL的Binding Buffer溶液中,细胞筛过筛,加入5 μL Annexin Ⅴ和5 μL PI染色液后混匀,室温下孵育15 min,然后上样至流式细胞仪检测分析凋亡情况。
-
提取细胞总蛋白质,BCA法检测蛋白浓度后取等量蛋白上样,10% SDS-PAG/E恒压电泳分离蛋白,然后恒流电转至PVDF膜,5%脱脂牛奶室温封闭1 h,USP22一抗和GAPDH内参4 ℃孵育过夜,PBST洗膜后,二抗37 ℃孵育1 h,采用凝胶成像系统成像,利用图像分析软件进行分析。
-
取对数生长期的细胞消化后制备成细胞悬液,以2×104/mL密度接种于96孔板,每孔100 μL,贴壁过夜。不同分组设3个复孔,培养24 h后,每孔加入10 μL CCK-8溶液,孵育3 h,酶标仪测定450 nm处的吸光度,绘制曲线,计算顺铂IC50。
-
采用t检验、单因素方差分析及q检验。
-
经历持续10个月的诱导,获得在顺铂(2μg/mL)中生长良好的耐药细胞U251/CP2。与亲本细胞相比,U251/CP2形态略有变化,表现为胞体较小,轴突较短且未分叉(见图 1)。CCK-8法检测亲本细胞U251和耐药细胞U251/CP2对顺铂的敏感性差异有统计学意义(P < 0.01),显示U251/CP2顺铂耐药;U251/CP2细胞无药培养2周后,IC50为(71.68±0.49) μg/mL,耐药性未见降低(P>0.05),说明U251/CP2对顺铂稳定耐药(见表 1)。
分组 顺铂IC50/(μg/mL) U251 1.20±0.24 U251/CP2 72.35±2.20** U251/CP2(不加顺铂) 71.68±0.49** F 2 308.51 P < 0.01 MS组内 3 731.620 q检验:与对照组U251比较**P < 0.01 表 1 耐药细胞U251/CP2的耐药性检测(ni=3;x±s)
-
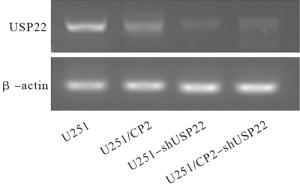
RT-PCR检测U251组、U251/CP2组、U251-shUSP22组和U251/CP2-shUSP22组细胞中USP22 mRNA的相对表达量分别为0.80±0.10、0.29±0.02、0.12±0.05、0.18±0.05。与U251组相比,U251-shUSP22组的USP22mRNA表达水平明显降低(t=10.49, P < 0.01);与U251/CP2组相比,U251/CP2-shUSP22组的USP22mRNA表达水平也明显降低(t=3.44, P < 0.05),说明成功干扰USP22基因沉默表达(见图 2)。
-
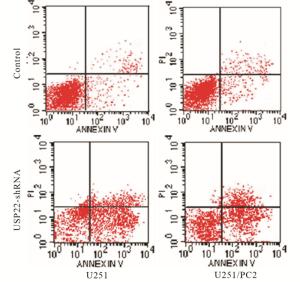
流式细胞仪检测U251组、U251-shUSP22组、U251/CP2组和U251/CP2-shUSP22组的细胞凋亡率分别为(4.13±0.59)%、(23.64±4.82)%、(7.65±0.73)%和(19.36±5.49)%;与U251组相比,U251-shUSP22组细胞凋亡率明显升高(t=6.96,P < 0.01);与U251/CP2组相比,U251/CP2-shUSP22组的细胞凋亡率同样也明显升高(t=3.66,P < 0.05);提示抑制USP22的表达可以显著提高胶质瘤细胞的凋亡率(见图 3)。
-
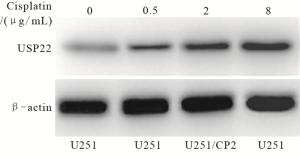
Western blotting检测发现0 μg/mL、0.5 μg/mL、8 μg/mL顺铂短暂处理(24 h)后U251细胞内USP22蛋白相对表达量分别为0.21±0.02、0.30±0.01、0.64±0.01,U251/CP2细胞2 μg/mL顺铂短暂处理(24 h)后USP22蛋白相对表达量为0.43±0.02(见图 4)。与对照U251(0 μg/mL)组相比,USP22蛋白表达水平在U251(0.5 μg/mL)组、U251(8 μg/mL)组和U251/CP2(2 μg/mL)组中均明显提高(t=9.70、40.35、14.60, P < 0.01)。提示顺铂用药可影响胶质瘤细胞中USP22的表达。
-
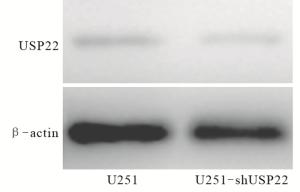
与对照细胞U251相比,U251-shUSP22中USP22的蛋白表达水平明显下调(t=6.83,P < 0.01)(见图 5)。同时,U251-shUSP22的顺铂IC50为(0.56±0.07) μg/mL,与U251的顺铂IC50 (1.23±0.13) μg/mL差异有统计学意义(t=7.70,P < 0.01)。提示下调USP22表达可增强胶质瘤细胞对顺铂的敏感性。
-
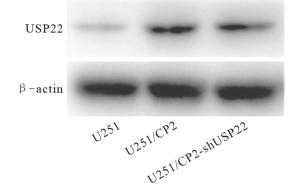
与对照细胞U251/CP2相比,U251/CP2-shUSP22中USP22蛋白表达水平显著下调(t=3.01,P < 0.05)(见图 6)。U251/CP2的顺铂IC50为(73.73±2.74) μg/mL,而U251/CP2-shUSP22的顺铂IC50下降至(51.25±1.09) μg/mL(P < 0.01) (见表 2),提示USP22表达下调,可逆转耐药细胞株U251/CP2对顺铂的耐药。U251与U251/CP2-shUSP22的顺铂敏感性差异有统计学意义(P < 0.01),说明USP22表达下调可在一定程度上逆转U251/CP2对顺铂耐药,但并非完全逆转。
分组 顺铂IC50/(μg/mL) U251 1.23±0.13 U251/CP2 73.73±2.74** U251/CP2-shUSP22 51.25±1.09** F 3 626.38 P < 0.01 MS组内 2914.630 q检验:与对照组U251比较**P < 0.01 表 2 CCK-8检测各组细胞的顺铂IC50(ni=3;x±s)
-
胶质瘤是最常见的原发性中枢神经系统肿瘤,恶性程度高,侵袭性强,易复发,治疗相当困难。目前临床常用的治疗胶质瘤推荐方案包括替莫唑胺(TMZ)剂量密度方案、联合治疗方案、抗血管生成治疗等。替莫唑胺为常用抗肿瘤药物,可通过阻断DNA合成,发挥抗肿瘤作用,控制病情进展。但是,并非所有病人均对替莫唑胺敏感,比如,O6-甲基鸟嘌呤-DNA甲基转移酶高表达病人易对烷化剂类产生耐药性[9]。有学者[10]指出采用替莫唑胺与铂类药物联合治疗复发性恶性肿瘤效果更优,可有效改善病人临床症状,控制癌灶扩散,延长病人生存时间。
顺铂是临床上最常用的铂类药物,主要作用靶点就是DNA,通过在细胞内形成铂-DNA加合物抑制DNA的复制和转录,是临床治疗多种实体瘤的重要药物,也是对胶质瘤敏感性较高的药物之一[11-12]。以抑制DNA合成的抗肿瘤药物,同时会使细胞启动防止其自身凋亡的多种修复机制来修复损伤的DNA,比如激活各种DNA修复酶使受损伤的DNA尽量恢复其结构和功能,从而尽量维持其正常的结构和功能,从而降低了该药物的临床疗效,使得肿瘤对该药物产生耐药性[13]。
胶质瘤的化疗耐药机制十分复杂,涉及到多方面因素,比如肿瘤细胞内药物的积聚减少、药物作用靶点减少、凋亡与抗凋亡机制失衡、DNA修复机制及肿瘤干细胞等。TABATABAI等[14]从胶质瘤中分离出胶质瘤干细胞(glioma stem cell, GSC)并发现胶质瘤细胞和GSC均具有多药耐药现象,以GSC更为显著。无论在体内还是体外GSC基本处于休眠状态,停滞于细胞周期中的G0/G1期并且高表达ABCG2、MDR等耐药基因。GSC能特征性表达ABC转运体,能将多种化疗药物转运出细胞外,从而对化疗药物产生耐药性[15]。另外,胶质瘤的耐药性还可能与高表达的MGMT、抗凋亡蛋白和凋亡蛋白抑制因子有关。崔磊等[16]利用芯片-基因组杂交技术筛选胶质瘤细胞中与顺铂耐药相关分子标志物,发现与胶质瘤顺铂耐药有关的基因包括CFHR1、CFHR3和IL-7等。但是,USP22基因是否也参与了胶质瘤耐药尚未有研究报道。
USP22基因位于人类17号染色体,编码蛋白产物约66000,是hSAGA(human Spt-Ada-Gcn5 acetyltransferase)复合物的一个亚单位, 是一类去泛素化酶,主要通过去泛素化修饰来调控肿瘤细胞的生长分化、影响细胞周期、转录激活和信号转导等。同时,USP22作为一个肿瘤干细胞标记家族的成员,在细胞周期、DNA转录、肿瘤发生发展进程中发挥重要作用,USP22可能通过细胞周期G1/S转换参与肿瘤耐药[17]。
李朝晖研究团队[6, 18]通过多项研究,明确了USP22在胶质瘤细胞中高表达,且验证了USP22通过调节细胞凋亡和细胞周期在胶质瘤细胞的增殖中发挥作用。吕磊等[19]的研究指出沉默USP22可逆转膀胱癌细胞T24对丝裂霉素化疗药的耐药。王宛明等[7]的研究则指出了抑制USP22可逆转胰腺癌细胞SW1990对吉西他滨化疗药的耐药。然而,关于USP22是否参与了胶质瘤细胞耐药目前尚无人研究。
本研究首次探讨USP22表达与胶质瘤细胞顺铂耐药的关系。首先,通过剂量梯度爬升诱导顺铂耐药胶质瘤细胞株U251/CP2,相对于亲本细胞株U251,U251/CP2对顺铂的敏感性显著下降,显示出顺铂耐受。此后,Western blotting检测其中USP22蛋白表达情况,发现在U251/CP2中USP22的表达显著高于U251,提示USP22可能参与了胶质瘤顺铂获得性耐药。因此,本文又采用小干扰RNA沉默U251、U251/CP2细胞的USP22表达,证实抑制USP22表达可降低U251对顺铂的抗药性并可在一定程度上逆转耐药细胞株对顺铂的耐药。
综上所述,本研究发现USP22的表达与胶质瘤U251细胞对顺铂的耐药有相关性,提示USP22可能是胶质瘤顺铂耐药的分子机制之一,为进一步研究胶质瘤顺铂耐药机制提供了新的方向。
抑制USP22表达对胶质瘤细胞顺铂耐药的影响
Effect of inhibiting the expression of USP22 on cisplatin resistance in glioma cells
-
摘要:
目的 探讨泛素特异性肽酶22(ubiquitin specific peptidase 22,USP22)对胶质瘤细胞顺铂耐药的作用。 方法 采用顺铂剂量梯度爬升筛选方法诱导顺铂耐药胶质瘤细胞株U251/CP2,转染USP22小干扰RNA沉默胶质瘤顺铂耐药细胞株U251/CP2中USP22的表达,RT-PCR检测细胞USP22 mRNA的表达水平,流式细胞术检测转染USP22-shRNA对细胞凋亡的影响,CCK-8法检测细胞的活力及耐药指数,Western blotting检测USP22的蛋白水平。 结果 成功构建了顺铂耐药胶质瘤细胞株U251/CP2、USP22基因沉默细胞株U251-shUPS22和U251/CP2-shUSP22。抑制USP22的表达可以明显提高U251/CP2-shUSP22细胞的凋亡率(P < 0.05),顺铂上调USP22蛋白在U251和U251/CP2细胞中的表达(P < 0.01)。U251-shUPS22、U251/CP2和U251/CP2-shUSP22各组细胞的顺铂半数抑制浓度分别为(0.56±0.07)μg/mL、(73.73±2.74)μg/mL和(51.25±1.09)μg/mL,与对照U251组(1.23±0.13)μg/mL比较差异均有统计学意义(P < 0.01)。 结论 抑制USP22表达可增强胶质瘤细胞对顺铂的敏感性,且可在一定程度上逆转耐药细胞株的顺铂耐药,提示USP22是胶质瘤顺铂耐药的潜在分子机制之一。 Abstract:Objective To investigate the effects of inhibiting the expression of ubiquitin specific peptidase 22(USP22) on cisplatin resistance in glioma cells. Methods The cisplatin-resistant glioma cell line(U251/CP2) was induced by gradual elevation of cisplatin concentration.The expression of USP22 in glioma cell line U251/CP2 was silenced using the transfection of USP22 small interfering RNA.The expression level of USP22 mRNA, cell apoptosis, viability and drug resistance index and protein level of USP22 were detected using RT-PCR, flow cytometry, CCK-8 and Western blotting, respectively. Results The cisplatin-resistant glioma cell line of U251/CP2 and USP22 gene silencing cell lines of U251-shUPS22 and U251/CP2-shUSP22 were successfully constrcucted.The inhibition of USP22 expression could significantly increase the apoptosis rate of U251/CP2-shUSP22 cells(P < 0.01), and cisplatin could up-regulate the expression of USP22 protein in U251 and U251/CP2 cells(P < 0.01).The IC50 values to cisplatin of U251-shUPS22, U251/CP2, U251/CP2-shUSP22 and U251 cells were (0.56±0.07)μg/mL, (73.73±2.74)μg/mL, (51.25±1.09)μg/mL and (1.23±0.13)μg/mL, respectively. Conclusions The inhibition of USP22 expression can enhance the chemosensitivity to cisplatin in glioma cells, and reverse the resistance of cisplatin in resistant cell line.It is suggested that USP22 may be one of the potential molecular mechanisms of cisplatin resistance in glioma. -
Key words:
- glioma /
- ubiquitin specific peptidase 22 /
- cisplatin /
- resistance
-
表 1 耐药细胞U251/CP2的耐药性检测(ni=3;x±s)
分组 顺铂IC50/(μg/mL) U251 1.20±0.24 U251/CP2 72.35±2.20** U251/CP2(不加顺铂) 71.68±0.49** F 2 308.51 P < 0.01 MS组内 3 731.620 q检验:与对照组U251比较**P < 0.01 表 2 CCK-8检测各组细胞的顺铂IC50(ni=3;x±s)
分组 顺铂IC50/(μg/mL) U251 1.23±0.13 U251/CP2 73.73±2.74** U251/CP2-shUSP22 51.25±1.09** F 3 626.38 P < 0.01 MS组内 2914.630 q检验:与对照组U251比较**P < 0.01 -
[1] LIU CA, CHANG CY, HSUEH KW, et al.Migration/invasion of malignant gliomas and implications for therapeutic treatment[J].Int J Mol Sci, 2018, 19(4):1115. doi: 10.3390/ijms19041115 [2] GENNARO VJ, STANEK TJ, PECK AR, et al.Control of CCND1 ubiquitylation by the catalytic SAGA subunit USP22 is essential for cell cycle progression through G1 in cancer cells[J].Proc Natl Acad Sci U S A, 2018, 115(40):E9298. doi: 10.1073/pnas.1807704115 [3] LIU T, LIU J, CHEN Q, et al.Expression of USP22 and the chromosomal passenger complex is an indicator of malignant progression in oral squamous cell carcinoma[J].Oncol Lett, 2019, 17(2):2040. [4] MA Y, FU HL, WANG Z, et al.USP22 maintains gastric cancer stem cell stemness and promotes gastric cancer progression by stabilizing BMI1 protein[J].Oncotarget, 2017, 8(20):33329. doi: 10.18632/oncotarget.16445 [5] LI Y, YANG Y, LI J, et al.USP22 drives colorectal cancer invasion and metastasis via epithelial-mesenchymal transition by activating AP4[J].Oncotarget, 2017, 8(20):32683. doi: 10.18632/oncotarget.15950 [6] 李朝晖, 王建, 付红, 等.siRNA沉默USP22基因对胶质瘤细胞增殖的抑制作用[J].中国微侵袭神经外科杂志, 2015, 20(9):419. [7] 王宛明, 董贾中, 管淑敏.泛素特异性肽酶22诱导胰腺癌细胞对吉西他滨耐药的观察[J].中国临床药理学与治疗学, 2017, 22(4):412. [8] ANDREWS PA, VELURY S, MANN SC, et al.Cis-Di-amminedichloroplatinum (II) accumulation in sensitive and resistant human ovarian carcinoma cells[J].Cancer Res, 1988, 48(1):68. [9] 廖加群, 黄立敏, 易敏, 等.替莫唑胺剂量密度方案联合顺铂治疗复发高级别胶质瘤效果观察[J].山东医药, 2018, 58(15):9. doi: 10.3969/j.issn.1002-266X.2018.15.003 [10] 韩小兵.顺铂联合替莫唑胺治疗复发性恶性脑胶质瘤临床研究[J].中国实用神经疾病杂志, 2018, 21(18):2019. [11] MORA J, PEREZ JS, CRUZ O.Treatment of childhood astrocytomas with irinotecan and cisplatin[J].Clin Transl Oncol, 2018, 20(4):500. doi: 10.1007/s12094-017-1741-z [12] HALL PE, LEWIS R, SYED N, et al.A Phase Ⅰ study of pegylated arginine deiminase (pegargiminase), cisplatin, and pemetrexed in argininosuccinate synthetase 1-deficient recurrent high-grade glioma[J].Clin Cancer Res, 2019, 25(9):2708. doi: 10.1158/1078-0432.CCR-18-3729 [13] 李正友.胶质瘤化疗耐药机制的研究进展[J].中国微侵袭神经外科杂志, 2015, 9(20):427. [14] TABATABAI G, WELLER M.Glioblastoma stem cells[J].Cell Tissue Res, 2011, 343(3):459. doi: 10.1007/s00441-010-1123-0 [15] WEE B, PIETRAS A, OZAWA T, et al.ABCG2 regulates self-renewal and stem cell marker expression but not tumorigenicity or radiation resistance of glioma cells[J].Sci Rep, 2016, 6:25956. doi: 10.1038/srep25956 [16] LI ZH, YU Y, DU C, et al.RNA interference-mediated USP22 gene silencing promotes human brain glioma apoptosis and induces cell cycle arrest[J].Oncol Lett, 2013, 5(4):1290. doi: 10.3892/ol.2013.1188 [17] WANG A, NING Z, LU C, et al.USP22 induces cisplatin resistance in lung adenocarcinoma by regulating γH2AX-mediated dNA damage repair and Ku70/Bax-mediated apoptosis[J].Front Pharmacol.2017, 17(8):274. doi: 10.3389/fphar.2017.00274 [18] 崔磊, 付军, 吴浩强, 等.脑胶质瘤细胞顺铂耐药分子标志物筛选[J].中国神经肿瘤杂志, 2009, 9(3):167. [19] 吕磊, 袁敬东, 黄韬, 等.USP22 aiRNA通过Mdm2-p53通路抑制膀胱癌耐药细胞株T24/MMC的增殖[J].华中科技大学学报(医学版), 2016, 45(6):597. -
 20200408.pdf
20200408.pdf
-





 下载:
下载: