-
甲状腺结节内部血管的形态和分布是判断甲状腺结节良、恶性质的重要参考[1]。超微血流成像技术(two-dimensional superb microvascular imaging, 2D-SMI)对甲状腺结节内部血流的评估明显优于传统的彩色多普勒成像技术(color Doppler flow image,CDFI)[2]。研究[3]证实2D-SMI在甲状腺结节良恶性的鉴别诊断中有重要的临床价值。超微血管三维立体成像技术(smart three-dimensional superb microvascular imaging, SMART 3D-SMI)基于2D-SMI,可以更加全面、立体地评价结节内部细微血管的空间分布特点和形态特征。本研究旨在探讨SMART 3D-SMI技术在甲状腺良恶性结节鉴别诊断中的应用价值。现作报道。
-
选取2018年12月至2019年6月在我院就诊的甲状腺结节病人47例进行回顾性分析,所有病人的甲状腺结节均经穿刺或手术活检确诊良恶性。所有病人均接受甲状腺的灰阶超声、CDFI、2D-SMI以及SMART 3D-SMI检查。
-
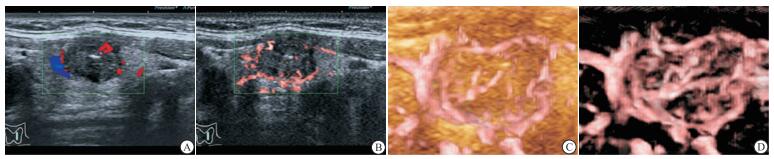
采用东芝Aplio 500型超声显像仪、14L5探头,探头频率为5~14MHz,观察和记录甲状腺腺体及结节的灰阶超声图像。应用CDFI观察和记录结节的血流信号的分布和形态特征。启动2D-SMI模式,自结节外侧缘开始扫查,缓慢移动探头,扫查至结节内侧缘结束,收集各平面的二维图像信息。立即启动SMART 3D-SMI模式,软件将对收集的信息进行三维重建,随即自动显示甲状腺结节的超微血管三维立体成像图。
-
(1) 灰阶超声特征:参照KWAK等[4]的TI-RADS标准, 综合病灶生长方式、颈部淋巴结、微钙化、边界以及回声高低的灰阶超声声像图表现对所有甲状腺结节进行评估。(2)血流信号特征:参照ADLER等[5]的血流分级标准将甲状腺结节的血流信号分级:0级,无血流信号;Ⅰ级,见1~2个点状、短棒状血流信号;Ⅱ级,见3~4个点状血流或1条较长血管;Ⅲ级,见5个以上点状血流或2条较长血管。
-
采用Friedman检验和ROC曲线分析。
-
本研究共纳入甲状腺结节病人47例,其中男6例,女41例,年龄19~68岁;共检出甲状腺结节100个,其中良性结节55个,恶性结节45个。
-
CDFI、2D-SMI及SMART 3D-SMI对甲状腺良性结节血流的分级差异无统计学意义(P>0.05),对恶性结节血流的分级差异有统计学意义(P < 0.01)(见表 1、图 1)。
方法 0级 Ⅰ级 Ⅱ级 Ⅲ级 χ2 P 良性结节 3.44 >0.05 CDFI 22(40.0) 26(47.3) 4(7.3) 3(5.5) 2D-SMI 16(29.1) 21(38.2) 12(21.8) 6(10.9) SMART 3D-SMI 10(18.2) 17(30.9) 17(30.9) 11(20.0) 恶性结节 70.40 < 0.01 CDFI 5(11.1) 10(22.2) 25(55.6) 5(11.1) 2D SMI 4(8.9) 7(15.6) 19(42.2) 15(33.3) SMART 3D-SMI 2(4.4) 5(11.1) 13(28.9) 25(55.6) 表 1 SMART 3D-SMI、2D-SMI及CDFI对甲状腺结节血流分级的比较[n;百分率(%)]
-
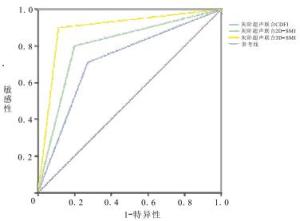
灰阶超声联合CDFI、2D-SMI及SMART 3D-SMI对甲状腺良恶性结节鉴别诊断的结果见表 2。灰阶超声联合3种方法诊断甲状腺结节的敏感度、特异性、准确度、阳性预测值、阴性预测值见表 3。ROC曲线分析显示,灰阶超声联合CDFI、2D-SMI及SMART 3D-SMI诊断甲状腺结节的ROC曲线下面积分别为0.719、0.800及0.890,灰阶超声联合SMART 3D-SMI对甲状腺良、恶性结节的诊断效能高于CDFI和2D-SMI(见图 2)。
方法 病理结果 合计 恶性 良性 灰阶超声联合CDFI 恶性 32 15 47 良性 13 40 53 灰阶超声联合2D-SMI 恶性 36 11 47 良性 9 44 53 灰阶超声联合SMART3D-SMI 恶性 40 6 46 良性 5 49 54 表 2 CDFI、2D-SMI及SMART 3D-SMI联合灰阶超声对甲状腺结节鉴别诊断的结果(n)
敏感性 特异性 准确度 阳性
预测值阴性
预测值CDFI 71.1 72.7 72.0 68.1 75.5 2D-SMI 80.0 80.0 80.0 76.5 83.0 SMART 3D-SMI 88.9 89.1 89.0 87.0 90.7 表 3 灰阶超声联合CDFI、2D-SMI及SMART 3D-SMI对甲状腺良、恶性结节的诊断效能(%)
-
SMART3D-SMI是新型的血流成像技术,通过采集二维声像图的血流信息进行三维重建,可全面、立体地显示低速血流的空间分布和形态特点。研究[6]显示SMART 3D-SMI对乳腺肿瘤的微血管的评估具有较高的临床价值。然而SMART 3D-SMI对于甲状腺结节微血管的评估及其对甲状腺良、恶性结节的鉴别诊断价值却未见报道。本研究发现SMART 3D-SMI对甲状腺结节细微血流的评估优于CDFI和2D-SMI,其鉴别甲状腺良、恶性结节的诊断效能高于CDFI、2D-SMI。
新生血管与肿瘤的侵袭过程密切相关[7]。甲状腺结节内部血流的形态和分布是判断甲状腺结节良恶性质的重要参考。然而,多种已被认可的甲状腺结节的TI-RADS分级标准[4, 8-9]均是建立在灰阶超声特征的基础上,例如结节边界、形态、生长方式、回声高低、微钙化等,却并未参考血流特点这一重要信息。其原因在于CDFI对于甲状腺结节细微血流的敏感性较低[10]。传统的CDFI通过壁滤波的方式去除杂波信号和运动伪像,但同时也丢失了细微低速的血流信号;而2D-SMI弥补了这一缺点,分离噪声和伪像的同时可以捕捉到低速的微小血流信号[3, 11]。本研究结果与之一致,11.1%的恶性结节经CDFI判定为Adler 0级,即未检测出血流信号,而2D-SMI发现8.9%的恶性结节未见血流信号。此外,本研究中仅4.4%的恶性结节经Smart 3D-SMI检测未见血流信号,这是因为Smart 3D-SMI的探查范围不只局限于二维平面,而是将捕获的二维血流信息进行三维重建,显示三维空间内的细微血流分布和形态特点。因此,SMART 3D-SMI对甲状腺恶性结节细微血流的探测较CDFI和2D-SMI更加全面和精确。
本研究联合运用灰阶超声和SMART 3D-SMI技术对100个甲状腺结节进行鉴别诊断,发现灰阶超声联合SMART 3D-SMI的诊断效能高于2D-SMI或CDFI联合灰阶超声。形态学特征和血流特点是良、恶性肿瘤鉴别诊断的重要因素[12]。高分辨率灰阶超声可以实时、准确地显示甲状腺结节的形态学特征,是临床上探查及鉴别诊断甲状腺结节的最常用的检查方法[13-14]。SMART 3D-SMI除了能够更好地捕捉细微血流信号之外,还可以直观、全面地展示肿瘤血管在三维空间内的分布和形态特点。恶性肿瘤血管走行高度扭曲,排列杂乱、不自然,还伴有穿支血管[15]。SMART 3D-SMI可以通过旋转重建后的三维图像,多维度、多角度地观察甲状腺结节微血管的特点,从而更加准确地判定甲状腺结节的良、恶性。因此,联合应用灰阶超声和SMART 3D-SMI鉴别甲状腺结节具有较高的诊断效能。
综上所述,SMART 3D-SMI可以较好地评价甲状腺结节微血管的空间分布和形态特点。联合应用灰阶超声和SMART 3D-SMI鉴别诊断甲状腺结节具有较大的临床价值。
超微血管三维立体超声成像在甲状腺良恶性结节鉴别诊断中的应用价值
Application value of Smart 3D-SMI in differential diagnosis of thyroid nodules
-
摘要:
目的探讨超微血管三维立体超声成像(SMART 3D-SMI)在甲状腺良恶性结节鉴别诊断中的应用价值。 方法应用彩色多普勒成像(CDFI)、超微血流成像(2D-SMI)以及SMART 3D-SMI观察和记录结节的血流的分布和形态特征,并比较3种方法联合灰阶超声鉴别良、恶性结节的诊断效能。 结果CDFI、2D-SMI及SMART 3D-SMI对甲状腺良性结节血流的分级差异无统计学意义(P>0.05),对恶性结节血流的分级差异有统计学意义(P < 0.01)。灰阶超声联合CDFI、2D-SMI及SMART 3D-SMI诊断甲状腺良恶性结节的敏感度分别为71.1% vs 80.0% vs 88.9%;特异度分别为72.7% vs 80.0% vs 89.1%;准确度分别为72.0% vs 80.0% vs 89.0%;阳性预测值分别为68.1% vs 76.5% vs 87.0%;阴性预测值分别为75.5% vs 83.0% vs 90.7%;ROC曲线下面积分别为0.719 vs 0.800 vs 0.890。 结论SMART 3D-SMI可以较好地评价甲状腺结节微血管的空间分布和形态特点。联合应用SMART 3D-SMI和灰阶超声鉴别诊断甲状腺结节具有较大的临床价值。 -
关键词:
- 超微血管三维立体成像 /
- 灰阶超声 /
- 彩色多普勒成像 /
- 超微血流成像 /
- 甲状腺结节
Abstract:ObjectiveTo investigate of the application value of smart three-dimensional superb microvascular imaging(SMART 3D-SMI) in the differential diagnosis of thyroid nodules. MethodsThe blood flow distribution and morphological characteristics of nodules were detected using color Doppler flow image(CDFI), two-dimensional superb microvascular imaging(2D-SMI) and SMART 3D-SMI, respectively.The diagnostic efficacy among three methods combined with gray-scale ultrasound in differentiating benign and malignant nodules was compared. ResultsAmong the detection of CDFI, 2D-SMI and SMART 3D-SMI, the differences of the grading of blood flow in benign nodules and malignant nodules were not and were statistically significant, respectively(P>0.05 and P < 0.01).The sensitivities, specificities, accuracy rating, positive predictive values, negative predictive values and areas under curve of CDFI, 2D-SMI, and SMART 3D-SMI combined with gray-scale ultrasound in the diagnosis of benign and malignant thyroid nodules were 71.1% vs 80.0% vs 88.9%, 72.7% vs 80.0% vs 89.1%, 72.0% vs 80.0% vs 89.0%, 68.1% vs 76.5% vs 87.0%, 75.5% vs 83.0% vs 90.7%, and 0.719 vs 0.800 vs 0.890, respectively. ConclusionSMART 3D-SMI can better evaluate the spatial distribution and morphological characteristics of the microvessels of thyroid nodules.The clinical value of SMART 3D-SMI combined with gray-scale ultrasound in the differential diagnosis of thyroid nodules is great. -
表 1 SMART 3D-SMI、2D-SMI及CDFI对甲状腺结节血流分级的比较[n;百分率(%)]
方法 0级 Ⅰ级 Ⅱ级 Ⅲ级 χ2 P 良性结节 3.44 >0.05 CDFI 22(40.0) 26(47.3) 4(7.3) 3(5.5) 2D-SMI 16(29.1) 21(38.2) 12(21.8) 6(10.9) SMART 3D-SMI 10(18.2) 17(30.9) 17(30.9) 11(20.0) 恶性结节 70.40 < 0.01 CDFI 5(11.1) 10(22.2) 25(55.6) 5(11.1) 2D SMI 4(8.9) 7(15.6) 19(42.2) 15(33.3) SMART 3D-SMI 2(4.4) 5(11.1) 13(28.9) 25(55.6) 表 2 CDFI、2D-SMI及SMART 3D-SMI联合灰阶超声对甲状腺结节鉴别诊断的结果(n)
方法 病理结果 合计 恶性 良性 灰阶超声联合CDFI 恶性 32 15 47 良性 13 40 53 灰阶超声联合2D-SMI 恶性 36 11 47 良性 9 44 53 灰阶超声联合SMART3D-SMI 恶性 40 6 46 良性 5 49 54 表 3 灰阶超声联合CDFI、2D-SMI及SMART 3D-SMI对甲状腺良、恶性结节的诊断效能(%)
敏感性 特异性 准确度 阳性
预测值阴性
预测值CDFI 71.1 72.7 72.0 68.1 75.5 2D-SMI 80.0 80.0 80.0 76.5 83.0 SMART 3D-SMI 88.9 89.1 89.0 87.0 90.7 -
[1] COOPER DS, DOHERTY GM, HAUGEN BR, et al.Revised American Thyroid Associationmanagement guidelines for patients with thyroid nodules and differentiatedthyroid cancer.American Thyroid Association (ATA)guidelines task force on thyroid nodules and differentiated thyroid cancer[J].Thyroid, 2009, 19(11):1167. doi: 10.1089/thy.2009.0110 [2] 孔晶, 杨薇, 金金, 等.超微血管显像、能量多普勒及彩色多普勒血流显像对甲状腺结节的诊断价值比较[J].中华超声影像学杂志, 2018, 27(7):595. doi: 10.3760/j.issn.1004-4477.2018.07.010 [3] CHEN L, ZHAN J, DIAO XH, et al.Additional value of superb microvascular imaging for thyroid nodule classification with the thyroid imaging reporting and data system[J].Ultrasound Med Biol, 2019, 45(8):2040. doi: 10.1016/j.ultrasmedbio.2019.05.001 [4] KWAK JY, HAN KH, YOON JH, et al.Thyroid imaging reporting and data system for us features of nodules:a step in establishing better stratification of cancer risk[J].Radiology, 2011, 260(3), 892. [5] ADLER DD, CARSON PL, RUBIN JM, et al.Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J].Ultrasound Med Biol, 1990, 16(6):553. doi: 10.1016/0301-5629(90)90020-D [6] 李伟伟, 周庆华, 吴迎, 等.超微血管三维立体成像技术对乳腺肿块血流的评估价值[J].中国超声医学杂志, 2019, 35(7):587. doi: 10.3969/j.issn.1002-0101.2019.07.005 [7] MANCINI M, GRECO A, SALVATORE G, et al.Imaging of thyroid tumor angiogenesis with microbubbles targeted to vascular endothelial growth factor receptor type 2 in mice[J].BMC Med Imaging, 2013, 13(1):31. [8] HORVATH E, MAJLIS S, ROSSI R, et al.An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J].J Clin Endocrinol Metab, 2009, 94(5):1748. doi: 10.1210/jc.2008-1724 [9] TESSLER FN, MIDDLETON WD, GRANT EG, et al.ACR thyroid imaging reporting and data system (TI-RADS):white paper of the ACR TI-RADS committee[J].J Am Coll Radiol, 2017, 14(5):587. doi: 10.1016/j.jacr.2017.01.046 [10] HEE SJ, HWAN BJ, JIN C, et al.Ultrasonography diagnosis and imaging-based management of thyroid nodules:revised Korean society of thyroid radiology consensus statement and recommendations[J].Korean J Radiol, 2016, 17(3):370. doi: 10.3348/kjr.2016.17.3.370 [11] PARK AY, SEO BK, WOO OH, et al.The utility of ultrasound superb microvascular imaging for evaluation of breast tumour vascularity:comparison with colour and power Doppler imaging regarding diagnostic performance[J].Clin Radiol, 2018, 73(3):304. doi: 10.1016/j.crad.2017.10.006 [12] SULTAN LR, XIONG H, ZAFAR HM, et al.Vascularity assessment of thyroid nodules by quantitative color Doppler ultrasound[J].Ultrasound Med Biol, 2015, 41(5):1287. doi: 10.1016/j.ultrasmedbio.2015.01.001 [13] 伍华亮.甲状腺结节灰阶超声影像诊断甲状腺癌的价值[J].深圳中西医结合杂志, 2018, 28(7):81. [14] 杨晓惠.基于TI-RADS的超声细化计分法和血清TSH值联合鉴别甲状腺结节良恶性[J].蚌埠医学院学报, 2019, 44(6):771. [15] KONG J, LI JC, WANG HY, et al.Role ofsuperb micro-vascular imaging in the preoperative evaluation ofthyroid nodules:Comparison with power Doppler flow imaging[J].J Ultrasound Med, 2017, 36(7):1329. doi: 10.7863/ultra.16.07004 -
 202004023.pdf
202004023.pdf
 202004023.pdf
202004023.pdf
-





 下载:
下载: