-
肝细胞癌为全球性健康问题[1],其发病率在全球排名第五,死亡率排名第二[2]。由于肝细胞癌早期无特征性临床表现,因此在发病早期难以发现,往往在病人就诊时已处于疾病晚期,失去了手术治疗的最佳时间[3]。因此,深入研究肝细胞癌的发病机制及发现新的治疗手段有重大意义。随着肿瘤免疫治疗突飞猛进,新型细胞免疫治疗技术得到飞速发展。近年来,在肿瘤免疫治疗研究中发现程序性死亡受体-1(programmed death receptor-1, PD-1) /程序性死亡配体-1(programmed death ligand-1,PD-L1/B7-H1) 信号通路的激活可以诱导发生肿瘤免疫逃逸,促进肿瘤快速生长, 在免疫耐受调节中扮演重要角色[4]。但目前尚未见文献报道有关PD-L1在肿瘤细胞自身增殖能力方面的研究。既往研究[5-12]表明,PD-L1在多种恶性肿瘤中呈高表达状态,如骨肉瘤、乳腺癌、非小细胞肺癌、结肠癌、淋巴瘤、胰腺癌、脑胶质瘤、鳞状细胞癌等。并且最近有研究[13]表明,PD-L1在肝细胞癌中同样呈高表达状态。本研究应用RNA干扰技术下调肝细胞癌细胞中PD-L1基因,观察下调PD-L1基因对肝癌细胞迁移、侵袭、增殖能力的影响,为肝细胞肝癌免疫治疗提供前期实验基础。现作报道。
-
人肝细胞癌细胞株(HepG2)(上海细胞库,中国)。DMEM培养基(Hyclone,美国);胎牛血清(Gibco,美国);胰蛋白酶(Biosharp,中国);双抗/青链霉素合剂(Gibco,美国);PBS 液(Biosharp,中国),Trizol(Invitrogen,美国);荧光定量试剂盒(TAKARA,日本) ;PD-L1山羊多克隆抗体(Abcam,英国);兔抗山羊IgG(Bisharp, 中国);PVDF膜(Bio-Rad,美国);RIPA裂解液(碧云天,中国)、SDS-PAGE 蛋白上样缓冲液(Bisharp,中国);siRNA-PD-L1,siRNA-Control(GenePharma)。CFX 荧光定量PCR仪(Bio-Rad);倒置显微镜(Olympus,日本);酶标仪(Leica,德国);荧光共聚焦显微镜(Leica,德国) 。
-
实验分组设siRNA-PD-L1组、siRNA-Control阴性对照组(siRNA-NC组)和正常细胞组(空白对照组),按照不同分组进行细胞转染。PD-L1的siRNA和siRNA-Control通过吉玛公司设计合成,培养细胞处于对数生长期时,应用siRNA-mate转染试剂(吉玛公司提供)进行常规转染,空白对照组不作处理。按细胞浓度1.5×106/2 mL于6孔板种植细胞,完全培养基(DMEM培养基,10%胎牛血清) 培养至细胞贴壁,分别用无血清DMEM培养基按质粒∶siRNA-mate=1∶5比例配置细胞转染液200 μL,室温静置10 min后混匀。培养板更换新鲜完全DMEN培养基,加入转染液,于37 ℃、5% CO2孵育箱内培养48 h,收取样本进行RT-PCR实验和Western blotting实验,检测PD-L1基因沉默水平。
-
常规培养HepG2细胞,当细胞进入对数生长期后,按实验分组处理细胞,分别收集各组细胞约2.5×106个,用RIPA强细胞裂解液裂解细胞,提取总蛋白。用BCA 试剂盒测定蛋白浓度,SDS-PAGE电泳、转膜后检测蛋白表达,图像用ImageJ软件进行分析。
-
常规培养HepG2细胞,当细胞进入对数生长期后,按实验分组处理细胞,分别收集各组细胞约2.5×106个,用Trizol 细胞裂解液裂解细胞,提取总RNA。用荧光定量PCR试剂盒检测 PD-L1基因表达,数据用ImageJ软件处理 。
-
取对数生长期 HepG2细胞常规转染后,以2×103/mL细胞浓度接种96孔板,每孔100 μL,按实验分组,每组设6个复孔处理细胞,培养24 h后,每孔加入MTT 10 μL(5 mg/mL)继续培养4 h,弃上清,每孔加入DMSO 100 μL,摇床混匀15 min,在酶标仪490 nm处测定各组光密度(opti-caldensity,OD)值,计算各实验组HepG2细胞增殖率=实验组OD值/对照组OD值。
-
在12孔板中加入细胞悬液,待细胞贴壁后,用消毒10 μL移液枪头均匀划4条横线,用PBS洗细胞3次,去除漂浮细胞。分3组处理细胞,放入37 ℃、5%CO2培养箱培养,取不同时间点于倒置显微镜下拍照,测量划痕融合率。
-
用已预冷的不含血清的DMEM培养基来稀释Matrigel基质胶(培养基∶基质胶=1∶3),快速充分混匀后快速包被小室的上室,37 ℃干燥2 h。以2×104/mL细胞浓度接种Transwell小室,在下室中加入500 μL不含血清的DMEM培养基,放入37 ℃、5%CO2培养箱培养48 h,取出小室,4%多聚甲醛固定20 min,苏木紫染色60 min,在光学显微镜下进行细胞计数。
-
采用方差分析和q检验。
-
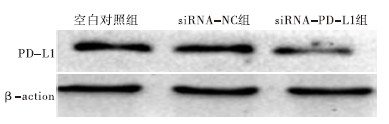
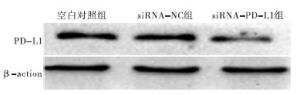
Western blotting结果显示,siRNA-PD-L1组、siRNA-NC组和空白对照组PD-L1蛋白表达量间差异有统计学意义(P<0.01),其中siRNA-PD-L1组均明显低于siRNA-NC组和空白对照组(P<0.01),而siRNA-NC组和空白对照组差异无统计学意义(P>0.05)(见图 1、表 1)。
分组 PD-L1蛋白 F P MS组内 siRNA-PD-L1组 0.332±0.011 siRNA-NC组 0.779±0.032** 439.64 <0.01 0.001 空白对照组 0.831±0.044** q检验:与siRNA-PD-L1组比较**P<0.01 表 1 各组细胞PD-L1蛋白表达量比较(x±s)
-
荧光定量PCR结果显示,siRNA-PD-L1组、siRNA-NC组和空白对照组PD-L1蛋白表达量间差异有统计学意义(P<0.01),其中siRNA-PD-L1组均明显低于siRNA-NC组和空白对照组(P<0.01),而siRNA-NC组和空白对照组差异无统计学意义(P>0.05)(见表 2)。
分组 PD-L1mRNA F P MS组内 siRNA-PD-L1组 0.421±0.065 siRNA-NC组 1.243±0.201** 219.62 <0.01 0.001 空白对照组 1** q检验:与siRNA-PD-L1组比较**P<0.01 表 2 各组细胞PD-L1mRNA相对表达量比较(x±s)
-
MTT实验结果显示,siRNA转染HepG2细胞后24、48 h,3组细胞增殖率差异均无统计学意义(P>0.05);转染后72 h,siRNA-PD-L1组细胞增殖率均明显低于siRNA-NC组和空白对照组(P<0.01)(见表 3)。
分组 n 24 h 48 h 72 h siRNA-PD-L1组 6 0.610±0.011 0.653±0.045 0.705±0.053 siRNA-NC组 6 0.628±0.029 0.710±0.029 0.901±0.034** 空白对照组 6 0.602±0.044 0.699±0.069 0.904±0.059** F — 1.10 2.16 31.44 P — >0.05 >0.05 <0.01 MS组内 — 0.001 0.003 0.003 q检验:与siRNA-PD-L1组比较**P<0.01 表 3 siRNA转染后不同时点各组细胞增殖率比较(x±s)
-
Transwell侵袭实验结果显示,3组细胞侵袭能力间差异有统计学意义(P<0.01),其中siRNA-PD-L1组穿膜细胞数均明显低于siRNA-NC组和空白对照组(P<0.01),而siRNA-NC组和空白对照组差异无统计学意义(P>0.05)(见图 2、表 4)。
分组 穿膜细胞数 F P MS组内 siRNA-PD-L1组 40.21±3.02 siRNA-NC组 105.31±3.03** 535.04 <0.01 17.340 空白对照组 110.62±5.78** q检验:与siRNA-PD-L1组比较**P<0.01 表 4 各组细胞侵袭能力比较(x±s)
-
细胞划痕实验结果显示,3组细胞迁移能力间差异有统计学意义(P<0.01),其中siRNA-PD-L1组均明显低于siRNA-NC组和空白对照组(P<0.01),而siRNA-NC组和空白对照组差异无统计学意义(P>0.05)(见图 3、表 5)。
分组 细胞迁移/% F P MS组内 siRNA-PD-L1组 12.30±2.00 siRNA-NC组 63.00±2.81** 441.71 <0.01 6.220 空白对照组 66.00±3.04** q检验:与siRNA-PD-L1组比较**P<0.01 表 5 各组细胞迁移能力比较(x±s)
-
PD-L1作为共刺激分子B7家族中的一员,其主要通过抑制T细胞的增殖、活化和相关细胞因子的分泌及降低细胞毒性作用来负性调控T细胞免疫。然而最近相关研究发现PD-L1同样影响着肿瘤的生物学活性,例如肿瘤细胞的增殖、迁移、侵袭能力。蒋涛等[14]研究发现,应用siRAN下调肺腺癌组织中PD-L1蛋白表达,可以显著降低癌细胞的增殖、侵袭及迁移能力。周婷等[15]研究亦显示,上调宫颈癌组织中PD-L1蛋白的表达,可以显著增加癌细胞的迁移能力。
本研究采用siRNA基因沉默技术下调肝细胞肝癌HepG2细胞中PD-L1蛋白的表达,观察HepG2细胞生物行为学变化。实验结果显示,在有效下调细胞中PD-L1蛋白表达后,siRNA-PD-L1组细胞的增殖、迁移、侵袭能力均明显低于siRNA-NC组和空白对照组,提示下调PD-L1可明显抑制HepG2细胞的增殖、迁移、侵袭。PD-L1作为肿瘤微环境中重要的免疫抑制分子,在多种实体肿瘤前期临床实验中,针对PD-L1的靶向性阻断显示出显著的疗效优势,具有可观前景[16],但其机制尚未阐明,仍有待于进一步研究。
综上,下调PD-L1后,肝癌细胞的增殖、迁移、侵袭能力有一定程度下降,PD-L1可能成为肝细胞肝癌免疫治疗中的一个新基因靶位。本研究应用siRNA基因沉默手段,为深入探讨其机制提供了依据,也为PD-L1在实体肿瘤治疗中的应用提供了前期实验基础。
PD-L1对肝细胞癌细胞增殖、侵袭及迁移的影响
Effect of PD-L1 on the proliferation,invasion and migration of hepatocellular carcinoma cells
-
摘要:
目的 探讨程序性死亡配体(PD-L1)在肝癌细胞增殖、侵袭、迁移中的作用。 方法 转染有效的PD-L1基因siRNA干扰片段进入人肝细胞癌HepG2细胞中,下调细胞中PD-L1表达。采用荧光定量PCR法检测HepG2细胞中PD-L1基因表达情况,采用Western blotting法检测HepG2细胞中PD-L1蛋白表达情况。通过MTT实验观察其对HepG2细胞增殖能力的影响,采用细胞划痕实验检测细胞融合率,采用Transwell小室进行侵袭实验,观察其对HepG2细胞迁移及侵袭能力影响。 结果 下调PD-L1后,HepG2细胞PD-L1基因表达量、PD-L1蛋白表达量和细胞增殖能力、迁移能力及侵袭能力均明显低于阴性对照组和空白对照组(P<0.01),阴性对照组和正常对照组上述指标差异均无统计学意义(P>0.05)。 结论 下调PD-L1后,肝癌细胞的增殖、迁移、侵袭能力有一定程度下降,PD-L1可能成为肝细胞肝癌免疫治疗中的一个新基因靶位。 Abstract:ObjectiveTo investigate the effects of PD-L1 in the proiferation, invasion and migration of hepatacellular carcinorma cells. MethodsThe effective PD-L1 gene siRNA interference fragment was transfected into the human hepatocellular carcinoma HepG2 cells to down-regulate PD-L1 expression.The expression levels of PD-L1 gene and protein in HepG2 cells were detected using the real-time PCR and Western blotting, resepctively.The cells proliferation and fusion rate of HepG2 cells were observed using the MTT assay and cell scratch test, respectively.The invasion experiment was implemented using Transwell chamber, and the migration and invasion ability of HepG2 cells were observed. ResultsAfter the expression level of PD-L1 gene was down-regulated, the expression levels of PD-L1 gene and protein in HepG2 cells, and proliferation, migration and invasion abilities of HepG2 cells in PD-L1 interference group were significantly lower than those in negative control group and blank control group(P<0.01), and there was no statistical significance in the above indicators between the negative control group and normal control group(P>0.05). ConclusionsAfter the down-regulation of PD-L1, the proliferation, migration and invasion abilities of the human hepatocellular carcinoma cells decrease to a certain extent, and PD-L1 may become a new gene target in the immunotherapy of hepatocellular carcinoma. -
Key words:
- hepatocellular neoplasms /
- PD-L1 /
- invasion /
- migration /
- proliferation
-
表 1 各组细胞PD-L1蛋白表达量比较(x±s)
分组 PD-L1蛋白 F P MS组内 siRNA-PD-L1组 0.332±0.011 siRNA-NC组 0.779±0.032** 439.64 <0.01 0.001 空白对照组 0.831±0.044** q检验:与siRNA-PD-L1组比较**P<0.01 表 2 各组细胞PD-L1mRNA相对表达量比较(x±s)
分组 PD-L1mRNA F P MS组内 siRNA-PD-L1组 0.421±0.065 siRNA-NC组 1.243±0.201** 219.62 <0.01 0.001 空白对照组 1** q检验:与siRNA-PD-L1组比较**P<0.01 表 3 siRNA转染后不同时点各组细胞增殖率比较(x±s)
分组 n 24 h 48 h 72 h siRNA-PD-L1组 6 0.610±0.011 0.653±0.045 0.705±0.053 siRNA-NC组 6 0.628±0.029 0.710±0.029 0.901±0.034** 空白对照组 6 0.602±0.044 0.699±0.069 0.904±0.059** F — 1.10 2.16 31.44 P — >0.05 >0.05 <0.01 MS组内 — 0.001 0.003 0.003 q检验:与siRNA-PD-L1组比较**P<0.01 表 4 各组细胞侵袭能力比较(x±s)
分组 穿膜细胞数 F P MS组内 siRNA-PD-L1组 40.21±3.02 siRNA-NC组 105.31±3.03** 535.04 <0.01 17.340 空白对照组 110.62±5.78** q检验:与siRNA-PD-L1组比较**P<0.01 表 5 各组细胞迁移能力比较(x±s)
分组 细胞迁移/% F P MS组内 siRNA-PD-L1组 12.30±2.00 siRNA-NC组 63.00±2.81** 441.71 <0.01 6.220 空白对照组 66.00±3.04** q检验:与siRNA-PD-L1组比较**P<0.01 -
[1] RINGELHAN M,PFISTER D,O'CONNOR T,et al.The immunology of hepatocellular carcinoma[J].Nature Immunol,2018,19(3):222. [2] ABOU-ALFA GK,MEYER T,CHENG AL,et al.Cabozantinib in patients with advanced and progressing hepatocellular carcinoma[J].N Engl J Med,2018,379(1):54. doi: 10.1056/NEJMoa1717002 [3] European Association for the Study of the Liver.EASL Clinical Practice Guidelines:Management of hepatocellular carcinoma[J].J Hepatol,2018,69(1):182. [4] PARDOLL DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(5):252. [5] SHEN JK,COTE GM,CHOY E,et al.Programmed cell death ligand 1 expression in osteosarcoma[J].Cancer Immunol Res,2014,2(7):690. doi: 10.1158/2326-6066.CIR-13-0224 [6] SOLIMAN H,KHALIL F.PD-L1 expression is increased in a subset of basal type breast cancer cells[J].PLoS One,2014,9(2):e88557. [7] CHEN YB,MU CY.Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer:A 5-year-follow-up study[J].Tumori,2012,98(6):751. doi: 10.1177/030089161209800612 [8] DROESER RA,HIRT C,VIEHL CT,et al.Clinical impact of programmed cell death ligand 1 expression in colorectal cancer[J].Eur J Cancer,2013,49(9):2233. doi: 10.1016/j.ejca.2013.02.015 [9] BERGHOFF AS,RICKEN G,WIDHALM G,et al.PD1(CD279) and PD-L1(CD274,B7H1) expression in primary central nervous system lymphomas (PCNSL)[J].Clin Neuropathol,2014,33(1):42. doi: 10.5414/NP300698 [10] BIGELOW E,BEVER KM,XU H,et al.Immunohistochemical staining of B7-H1(PD-L1) on paraffin-embedded slides of pancreatic adenocarcinoma tissue[J].J Vis Exp,2013,1(3):71. [11] CURIEL TJ,WEI S,DONG H,et al.Blockade of B7-H1 improves myeloid dendritic cell-mediated antitumor immunity[J].Nature Med,2003,9(5):562. doi: 10.1038/nm863 [12] STROME SE,DONG H,TAMURA H,et al.B7-H1 blockade augments adoptive T-cell immunotherapy for squamous cell carcinoma[J].Cancer Res,2003,63(19):6501. [13] 苏纯洁,何前进,毛伟明,等.肝癌组织中PD-L1和HIF-1α的相关性研究[J].中国现代普通外科进展,2019,22(1):22. [14] 蒋涛,付立业,李妍.RNAi沉默肺腺癌A549细胞系PD-L1基因表达对其增殖和凋亡的影响[J].现代肿瘤医学,2015,23(2):177. doi: 10.3969/j.issn.1672-4992.2015.02.09 [15] 周婷,严玉荣,赵晨辰,等.PD-L1蛋白过表达对HeLa细胞迁移能力的影响[J].生物技术,2017,27(6):557. [16] SWAIKA A,HAMMOND WA.Current state of anti-PD-L1 and anti-PD-1 agents in cancer therapy[J].Mol Immunol,2015,67(2 Pt A):4. doi: 10.1016/j.molimm.2015.02.009 -




 下载:
下载: