-
乳腺癌是女性最常见的恶性肿瘤之一[1],近年发病率正在逐渐上升。尽管有新的靶向药物及化疗方案不断推出,但大多数乳腺癌病人仍会出现复发和转移,复发转移性乳腺癌病人的生存率较低,特别是经历三线治疗失败的病人,目前没有标准的化疗方案,并且出现多药耐药[2],如何提高这类病人生存质量,改善生存期是值得我们研究的方向。甲磺酸阿帕替尼是我国自主研制的一种小分子抗血管生成的口服靶向药物[3],在我国批准用于至少接受过2种系统化疗后进展或复发的晚期胃腺癌,主要抑制作用靶点为血管内皮生长因子受体-2(VEGFR-2)。目前国内外学者[4-5]对于阿帕替尼治疗晚期乳腺癌病人的临床效果也在不断研究中。我们通过回顾性分析25例晚期复发转移性乳腺癌病人口服阿帕替尼的临床资料,分析其有效率和不良反应。现作报道。
-
回顾性分析2016年8月至2018年7月我院收治的至少三线治疗失败转移性乳腺癌病人25例的临床资料,随访至2019年3月31日。均为女性。年龄32~60岁,中位年龄47岁,其中 < 35岁3例,35~60岁22例。EOCG评分0~2分,其中0~1分20例,2分5例。绝经前16例,绝经后9例。病理类型:黏液癌1例,浸润性导管癌24例。
以免疫组织化学人表皮生长因子受体2(HER-2)(-)或(+)为阴性,HER-2 3+为阳性,HER-2 2+给予FISH检测;免疫组织化学激素受体明确,雌激素受体(ER)及孕激素受体(PR)阴性,免疫组织化学染色 < 1%。ER阴性18例,阳性7例;PR阴性22例,阳性3例;HER-2阴性21例,阳性4例。根据中国临床肿瘤学乳腺癌诊疗指南进行分子分型,Luminal A型3例,Luminal B型(HER-2阴性)5例,HER-2阳性(HR阳性)1例,HER-2阳性(HR阴性)3例,三阴性13例。
经3线化疗方案治疗病人17例,4线化疗方案病人5例,5线化疗方案病人2例,6线化疗方案化疗1例。病人既往接受过蒽环类、紫杉类、长春瑞滨、吉西他滨、铂类、卡培他滨等化疗药物;对于HER-2有扩增病人给予曲妥珠单抗抗HER-2治疗;激素受体阳性的病人给予至少1次内分泌治疗,有内脏转移病人18例,无内脏转移病人7例。转移部位:肝脏12例,骨13例,肺4例,胸膜6例,淋巴结7例,脑3例,皮肤1例。25例病人用药前检查血常规、生化常规、尿常规、心电图均正常。排除标准:病人有不可控制的高血压疾病。
-
22例病人接受阿甲磺酸帕替尼(江苏恒瑞医药股份有限公司)单药口服治疗,1例联合紫杉醇周方案化疗,1例联合卡陪他滨方案化疗,1例联合替吉奥方案化疗,治疗剂量为500 mg,每天早餐后30 min服用,每天1次。3例病人因3~4级蛋白尿、高血压及手足综合症,减量为250 mg。25例病人至少接受2个月口服药物治疗。
-
病人口服药物治疗28 d后通过CT或MRI影像学检查评价疗效,每4周评价疗效1次,直到疾病进展。病人疗效评价依据RECIST 1.1标准进行,分为完全缓解、部分缓解、病情稳定和疾病进展。客观有效率=(完全缓解例数+部分缓解例数)/总例数×100%;疾病控制率=(完全缓解例数+部分缓解例数+病情稳定例数)/总例数×100%。无进展生存期指从病人用药开始至疾病进展时间;总生存期指从病人用药开始至病人死亡或随访结束时间(失访病人为最后一次随访时间)。不良反应根据不良反应事件评价标准(CTCAE 4.03)进行评价。
-
采用Kaplan-Meier法计算病人生存率并绘制生存曲线,病人预后影响因素采用COX回归分析。
-
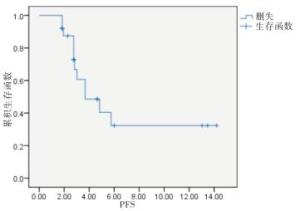
25例病人中,无完全缓解病例,部分缓解4例,病情稳定11例,疾病进展10例,客观有效率为16.0%,疾病控制率为60.0%。随访至2019年3月31日,因病情进展导致病人死亡12例,失访2例,11例存活,中位无进展生存期3.68个月,总生存期16.06个月(见图 1~2)。
-
COX比例风险模型结果显示,既往化疗数和ER状态是乳腺癌病人无进展生存期的影响因素(P<0.05)(见表 1)。
因素 B SE Wald P Exp(B) 既往化疗数 1.087 0.528 4.234 0.040 2.964 内脏转移 0.807 0.768 1.103 0.294 2.241 年龄 0.035 0.053 0.420 0.517 1.035 ER -2.210 0.970 5.194 0.023 0.110 PR 1.126 1.144 0.969 0.325 3.084 HER-2 1.814 1.059 2.934 0.087 6.136 表 1 复发转移性乳腺癌病人无进展生存期的多因素分析
-
25例病人无一例严重不良反应,服用阿帕替尼后主要不良反应为高血压(20.0%)、乏力(20.0%)、手足综合征(16.0%)和腹泻(16.0%)(见表 2)。
不良反应 1~2级 3~4级 合计 高血压 4(16.0) 1(4.0) 5(20.0) 手足综合征 3(12.0) 1(4.0) 4(16.0) 蛋白尿 2(8.0) 1(4.0) 3(12.0) 乏力 5(20.0) 0 5(20.0) 腹泻 4(16.0) 0 4(16.0) 恶心、呕吐 2(12.0) 0 2(8.0) 皮疹 1(4.0) 0 1(4.0) 白细胞减少 1(4.0) 0 1(4.0) 合计 22(88.0) 3(12.0) 25(100.0) 表 2 25例复发转移性乳腺癌病人不良反应情况[n;百分率(%)]
-
转移性乳腺癌病人给予系统性化学治疗、靶向治疗、内分泌治疗失败后,尚无标准治疗策略,其主要治疗目标是改善病人生活质量、延长生存期。持续血管生成是肿瘤生长发展的前提、浸润和转移的关键,乳腺癌的生长、发展和转移也与血管的生长有密切的关系。我国自主研制的甲磺酸阿帕替尼是一种小分子VEGFR-2酪氨酸激酶抑制剂,可以竞争性抑制肿瘤细胞VEGFR-2的ATP结合位点,通过阻断其下游信号传导从而抑制和阻断VEGFR-2的自身磷酸化及下游细胞外信号c-kit等相关的激酶磷酸化[6],抑制肿瘤血管的生成,在胃癌、肝癌、非小细胞肺癌等研究中获得一定的疗效[7],在我国被批准用于晚期胃腺癌或食管-胃结合部腺癌病人。
阿帕替尼对乳腺癌的治疗作用也在不断研究和探索中,有基础研究[8]表明,阿帕替尼联合氟尿嘧啶协同抑制乳腺癌细胞并诱导凋亡,使抗肿瘤活性显著增强。我国学者[9]研究显示,阿帕替尼可能通过抑制P-gp转运体的外排功能,逆转P-gp转运体介导的乳腺癌化疗多药耐药性。有研究[10]表明,阿帕替尼可能通过调控Cell division protein kinase 2、GTPase HRas、NONE和CYP P450 2C9的功能或生物作用来参与乳腺癌进展过程,发挥治疗作用。临床上对于阿帕替尼治疗复发转移性乳腺癌也有一定的临床数据,我国学者HU等[11]进行的Ⅱ期临床研究显示,56例晚期三阴性乳腺癌病人采用阿帕替尼治疗的疾病控制率为25%,中位生存期为10.6个月,中位无进展生存期3.2个月。该学者[12]另一项Ⅱ期临床研究显示,阿帕替尼治疗38例非三阴性乳腺癌的疾病控制率为66.7%,中位生存期为10.3个月,中位无进展生存期4.0个月。
本研究回顾性分析25例晚期复发转移性乳腺癌病人临床资料,均经历3线及以上治疗方案失败,口服阿帕替尼治疗后,病情稳定11例,部分缓解4例,疾病进展8例。病情缓解4例中Luminal A型病人1例,三阴性3例,其中1例通过联合卡陪他滨获得病情缓解;病情稳定11例中Luminal B型(HER-2阴性)4例,三阴性7例。晚期激素受体阳性乳腺癌病人经历标准内分泌治疗,化学治疗失败后出现多药耐药,本研究结果显示,激素受体阳性乳腺癌病人口服阿帕替尼后疾病控制率为62.5%,获益率较高。三阴性乳腺癌恶性程度较高,由于缺少特意向的治疗靶点,晚期三阴性乳腺癌病人一般通过化学治疗延长生存期,但治疗效果欠佳。本研究结果显示,三阴性乳腺癌可通过口服阿帕替尼获益,与王晓蕊等[13]研究结果一致。本研究中,25例病人客观有效率为16.0%,疾病控制率60.0%,中位无进展生存期3.68月(95%CI 1.49~5.86),中位生存期16.06个月(95%CI 12.39~19.73),病人获益率较高。其中病情缓解病人4例随访至今,仍口服阿帕替尼,明显改善生活质量,延长生存期。此外,本研究中COX比例风险模型显示,既往化疗数和ER状态是乳腺癌病人的无进展生存期的影响因素。病人经历化疗数目越多,无进展生存期越短,与既往研究[14]一致。
阿帕替尼主要的不良反应包括血液学毒性和非血液学毒性,血液学毒性包括白细胞减少、粒细胞减少和血小板较少,非血液学毒性包括蛋白尿、高血压、手足综合征和乏力。本研究结果显示,病人主要出现非血液学毒性,1~2级主要不良反应为乏力和腹泻,3~4级不良反应为高血压、手足综合征和蛋白尿,通过减量为250 mg后症状明显改善。提示阿帕替尼在晚期乳腺癌治疗中病人耐受性尚可,安全性较好,病人依从性较好,不良反应可控。
综上,阿帕替尼应用于晚期复发转移性乳腺癌病人可以获益,尤其是对于激素受体阳性乳腺癌及三阴型乳腺癌病人,获益率较高。并且该药口服方便,不良反应可控,病人生活质量得到提高。但本研究样本量较少,仍需要扩大样本量进行进一步分期研究。
甲磺酸阿帕替尼治疗复发转移性乳腺癌的临床观察
The clinical efficacy of apatinib mesylate in the treatment of recurrent metastatic breast cancer
-
摘要:
目的探讨晚期复发转移性乳腺癌病人口服甲磺酸阿帕替尼的有效率和不良反应。 方法回顾性分析25例经3线治疗失败以上的晚期复发转移性乳腺癌病人临床资料,给予口服甲磺酸阿帕替尼,分析其客观有效率、疾病控制率、无进展生存期、总生存期及不良反应。 结果25例病人中,病情稳定11例,部分缓解4例,疾病进展10例,客观有效率16.0%,疾病控制率60.0%,中位无进展生存期3.68个月,总生存期16.06个月。多因素分析显示,既往化疗数和雌激素受体状态均为乳腺癌病人无进展生存期的影响因素(P < 0.05)。病人服用阿帕替尼主要不良反应为高血压(20.0%)、乏力(20.0%)、手足综合征(16.0%)和腹泻(16.0%),25例病人中无一例严重不良反应。 结论晚期复发转移性乳腺癌病人口服甲磺酸阿帕替尼获益率较高,不良反应可控,生活质量有所提高,值得进一步研究。 Abstract:ObjectiveTo investigate the efficacy and safety of apatinib mesylate in the treatment of advanced recurrent metastatic breast cancer. MethodsThe clinical data of 25 advanced recurrent metastatic breast cancer patients with more than 3-line treatment failure were retrospectively analyzed.The objective response rate, disease control rate, progress free survival, overall survival and safety in patients treated with oral apatinib mesylate were evaluated. ResultsAmong 25 patients, the disease stabliation in 11 cases, partial remission in 4 cases and disease progression in 10 cases were identified.The objective response rate, disease control rate, median progress free survival and overall survival were 16.0%, 60.0%, 3.68 months and 16.06 months, respectively.The results of multi-factor analysis showed that the number of chemotherapy and ER status were the influencing factors of progress free survival(P < 0.05).The hypertension, fatigue, hand-foot syndrome and diarrhea were the main adverse reactions of apatinib, and no serious adverse reactions in 25 patients were found. ConclusionThe apatinib mesylate in the treatment of advanced recurrent metastatic breast cancer has high efficacy, the adverse reactions is controllable, and the quality of life of patients can be improved, which is worthy of further study. -
Key words:
- breast neoplasms /
- apatinib mesylate /
- progress free survival /
- adverse reaction
-
表 1 复发转移性乳腺癌病人无进展生存期的多因素分析
因素 B SE Wald P Exp(B) 既往化疗数 1.087 0.528 4.234 0.040 2.964 内脏转移 0.807 0.768 1.103 0.294 2.241 年龄 0.035 0.053 0.420 0.517 1.035 ER -2.210 0.970 5.194 0.023 0.110 PR 1.126 1.144 0.969 0.325 3.084 HER-2 1.814 1.059 2.934 0.087 6.136 表 2 25例复发转移性乳腺癌病人不良反应情况[n;百分率(%)]
不良反应 1~2级 3~4级 合计 高血压 4(16.0) 1(4.0) 5(20.0) 手足综合征 3(12.0) 1(4.0) 4(16.0) 蛋白尿 2(8.0) 1(4.0) 3(12.0) 乏力 5(20.0) 0 5(20.0) 腹泻 4(16.0) 0 4(16.0) 恶心、呕吐 2(12.0) 0 2(8.0) 皮疹 1(4.0) 0 1(4.0) 白细胞减少 1(4.0) 0 1(4.0) 合计 22(88.0) 3(12.0) 25(100.0) -
[1] SIEGEL RL, MILLER KD, JEMAL A, et al.Cancer Statistics, 2017[J].CA Cancer J Clin, 2017, 67(1):7. doi: 10.3322/caac.21387 [2] YAN X, YU Q, GUO L, et al.Positively charged combinatory drug delivery systems against multi-drug-resistant breast cancer:Beyond the drug combination[J].ACS Appl Mater Interfaces, 2017, 9(8):6804. doi: 10.1021/acsami.6b14244 [3] HUANG L, WEI Y, SHEN S, et al.Therapeutic effect of apatinib on overall survival is mediated by prolonged progression free survival in advanced gastric cancer patient[J].Oncotarget, 2017, 8(17):29346. doi: 10.18632/oncotarget.12897 [4] 张桂芳, 黄普超, 周林静, 等.阿帕替尼治疗多线以上治疗失败9例晚期乳腺癌的临床疗效[J].肿瘤学杂志, 2017, 23(9):827. doi: 10.3969/j.issn.1009-0460.2017.09.012 [5] HU T, LIU C, LI Q, et al.Apatinib+CPT-11+S-1 for treatment of refractory brain metastases in patient with triple-negative breast cancer:Case report and literature review[J].Medicine (Baltimore), 2018, 97(15):e0349. doi: 10.1097/MD.0000000000010349 [6] TIAN S, QUAN H, XIE C, et al.YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J].Cancer Sci, 2011, 102(7):1374. doi: 10.1111/j.1349-7006.2011.01939.x [7] SCOTT AJ, MESSERSMITH WA, JIMENO A, et al.Apatinib:a promising oral anti-angiogenic agent in the treatment of multiple solid tumors[J].Drugs Today, 2015, 51(4):223. doi: 10.1358/dot.2015.51.4.2320599 [8] 安改丽, 李旭, 冯璐, 等.Apatinib联合5-Fu协同抑制乳腺癌MCF-7细胞的体外研究[J].实用癌症杂志, 2017, 32(5):702. doi: 10.3969/j.issn.1001-5930.2017.05.002 [9] 张圣村, 马敏, 徐丽丽.阿帕替尼逆转P-gp转运体介导的乳腺癌化疗多药耐药性的作用及其机制[J].肿瘤防治研究, 2018, 45(4):210. doi: 10.3971/j.issn.1000-8578.2018.17.1112 [10] 朱婉婷, 范雪梅, 位华, 等.基于网络药理学探讨阿帕替尼治疗乳腺癌的作用机制[J].中国药学杂志, 2016, 51(18):1569. [11] HU X, ZHANG J, XU B, et al.Multicenter phase Ⅱ study of apatinib, a novel VEGFR inhibitor in heavily pretreated patients with metastatic triple-negative breast cancer[J].Int J Cancer, 2014, 135(8):1961. doi: 10.1002/ijc.28829 [12] HU X, CAO J, HU W, et al.Multicenter phase Ⅱ study of apatinib in non-triple-negative metastatic breast cancer[J].BMC Cancer, 2014, 14(6):820. [13] 王晓蕊, 汪旭, 史业辉, 等.阿帕替尼治疗晚期难治性三阴性乳腺癌的临床疗效观察[J].中国肿瘤临床, 2017, 44(15):769. doi: 10.3969/j.issn.1000-8179.2017.15.643 [14] 远丽芳, 刘俊宝, 秦岭, 等.阿帕替尼治疗多线治疗失败的转移性乳腺癌的疗效观察[J].癌症进展, 2017, 15(4):411. -




 下载:
下载:



