-
肺硬化性肺泡细胞瘤(pulmonary sclerosing peumocytoma,PSP)又被称为肺硬化性血管瘤、颗粒状肺泡细胞瘤等,是一种少见的良性肿瘤,其CT表现变化较大,术前常被诊断为错构瘤、血管瘤、肺癌等[1],以往文献多提及与前述肿瘤的鉴别要点。本研究的主要目的是分析PSP的CT平扫及增强特征,探讨PSP与一些相对少见的肺恶性肿瘤鉴别的可能性。
-
本研究入组2013-2019我院收治经病理证实为PSP的病例27例, 其中男4例,女23例,年龄16~76岁, 19例为体检意外发现,余8例皆因咳嗽、咳痰就诊。27例均有平扫图像,其中22例同时完成增强检查。搜索报告系统影像学不典型、有强化的肺部恶性肿瘤,采用1:1配对,选取与PSP组病灶直径接近的22例作为对照组,其中类癌6例,黏液表皮样癌4例,腺癌7例,鳞癌1例,神经内分泌肿瘤复合型1例,转移瘤1例,低分化癌2例。PSP组和对照组间性别、年龄及病灶直径差异均无统计学意义(P>0.05)(见表 1)。
指标 PSP组(n=22) 对照组(n=22) t P 性别 男
女4
188
41.83* >0.05 年龄/岁 52.09±15.66 54.27±11.09 0.53 >0.05 直径/cm 33.05±13.13 33.09±14.61 0.01 >0.05 相对CT值 平扫 0.77±0.41 0.78±0.51 0.11 >0.05 增强后50 s 1.30±0.43△△ 1.38±0.79△△ 0.42 >0.05 增强后90 s 1.45±0.46△△# 1.29±0.71△△ 0.84 >0.05 *示χ2值;组内比较:与平扫组比较△△P < 0.01;与增强后50 s组比较#P < 0.05 表 1 一般资料及相对CT值比较(x±s)
-
CT检查由以下设备完成:GE Discovery CT750、light speed VCT、optima CT660、NeuViz 128及philips Brilliance 64,扫描范围包括胸廓入口至双侧肾上腺水平整个胸腔。检查扫描参数如下:管电压120 kV,管电流160~360 mA,层厚5 mm,无间隔,增强检查所用参数与平扫相同,共35例被重建为1.25 mm层厚的无间隔图像,所用对比剂剂量为60~70 mL,注射速度2.5~3 mL/s,增强后共扫描2期,延迟时间分别为50 s、90 s。
-
两名放射科医生共同进行图像评估,当意见不一致时增加一名高年资医师阅片,以达到一致认同。影像学评估如下:测量PSP病例直径,记录病灶形状和术前诊断结果;记录病灶主要成分及是否有钙化,并对病灶征象进行记录,如假包膜征、贴边血管征、空气半月征、晕征等。测量PSP及对照组病灶及相应层面背部肌肉的CT值,测量时需注意避开明显坏死区、磨玻璃密度部分及钙化,然后按下述公式计算平扫及增强时各期的相对CT值:相对CT值=病灶CT值/背部肌肉CT值。
-
采用χ2检验、t检验、方差分析和q检验。
-
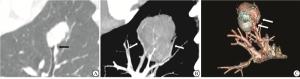
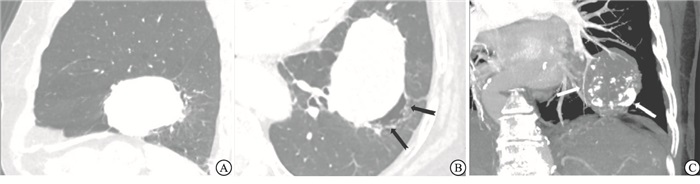
27例PSP均为单发,CT肺窗测得病灶平均直径为(31.10±12.90)mm,其中14例>30 mm(仅1例>50 mm),多位于肺叶周边,仅累及单叶,但在术前CT评估时,有5例病灶,由于较大,且突向相邻肺叶,较难判断位置(见图 1A)。病灶多呈圆形或椭圆形,边界清晰,仅4例欠规则;27例中5例在术前正确诊断为PSP,4例在术前诊断为肺癌,余被诊断为错构瘤、血管瘤等良性病灶。CT平扫时病灶以软组织密度为主,部分可见钙化(11例,40.74%),其中2例钙化位于病灶边缘,呈弧形;共6例出现晕征,多位于病灶一侧,边界欠清晰;3例有空气半月征(见图 1B);出现贴边血管征16例(见图 1C);本组病例未出现假包膜征;另1例发现局部支气管受累(见图 2),并在术前诊断为肺癌。
-
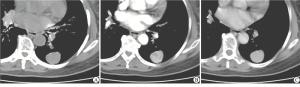
27例PSP中,22例同时进行了平扫和增强检查,1:1配对,PSP组及对照组平扫及增强相对CT值各时间点组间差异均无统计学意义(P>0.05)(见表 1);但PSP组平扫相对CT值均低于增强后延迟50 s、90 s的相对CT值,延迟时间50 s时的相对CT值低于90 s的相对CT值,差异均有统计学意义(P < 0.05~P < 0.01)(见表 2、图 3)。
分组 n 相对CT值 平扫 22 0.77±0.41 增强后50 s 22 1.30±0.43** 增强后90 s 22 1.45±0.46**△ F — 14.92 P — < 0.01 MS组内 — 0.188 q检验:与平扫组比较*P < 0.05, **P < 0.01;与增强后50s组比较△P < 0.05, △△P < 0.01 表 2 PSP组平扫及增强后相对CT值(x±s)
-
PSP为一种少见的肺内良性肿瘤,多发生于亚洲中年女性[2-3],男女发生比例为1:5,多无临床症状,部分病人因咳嗽咳痰就诊。1956由Liebow首次报道,2015年WHO首次将其更名为硬化性肺泡细胞瘤,并归为II型肺泡上皮细胞来源的肿瘤[1]。
-
PSP多为孤立结节,偶为多发,形态规则,以软组织密度为主,部分可见钙化,边界清晰[4-5],本组2例病例钙化位于病灶边缘,且呈弧条形,形态较为特殊。与以往研究[6]相似,本组多数病例也位于胸膜下及叶间裂区,5例术前怀疑跨叶间裂的病灶,在术中发现叶间裂完整,相邻肺叶可分离。本组病例未观察到假包膜征,但多数可观察到瘤体边缘条形血管影,部分血管被推移拉伸,血管贴边征是PSP中较常见的征象,认为是瘤体边缘较小的滋养动脉或引流静脉显影,或肿瘤推挤周围肺组织原有血管所致[7]。共有3例图像显示空气半月征,有研究[8]认为与小气道周围未分化的肺泡间质细胞增殖后阻塞气道、导致远侧的小气道扩张有关,或为瘤周出血后,经气道排出而形成的残腔。晕征在本组病例中相对少见,一般认为为肿瘤出血和局灶肿瘤细胞向周围正常肺组织内结构生长引起。另据文献[9-10]报道少数PSP可发生非典型增生,部分病例术后会出现肺门淋巴结转移,此外,笔者遇到2例不典型病例[11-12]:1例生长于肺门血管周围,在平扫时密度较低,未进行增强检查,被误判为支气管囊肿;另1例发现局部支气管腔内有异常软组织影,这一征象极为少见,同时强化欠均匀,导致该病例在术前被误诊为恶性肿瘤,回顾观察发现,这例病灶位于外周、较小,且边缘较光整。
为矫正机器及扫描参数的差异,本研究选用相对CT值进行评估。由于增强后,多数PSP相对CT值明显上升,且延迟90 s时更明显;同时,以往文献报道PSP镜下主要由乳头区、实性区、出血区及硬化区构成,其比例多变,并常与CT表现密切相关[13];而本研究中,与血供较丰富的骨骼肌相比,PSP强化更明显,说明本组PSP血供较丰富,可能有较多血管瘤样成份及乳头样结构[14-15],属于强化较明显的肿瘤。以往有研究[16]报道在以肺腺癌为主的肺结节病例中,衡量增强后与增强前的CT值增幅时,用30 Hu为截点,筛查恶性肿瘤的敏感度为100%,但特异度较低,较难进行鉴别诊断;本研究结果显示,当对照组为血供较丰富的肿瘤,如类癌、黏液表皮样癌等,组间各时间点相对CT值仍缺乏统计学差异,说明在进一步鉴别强化较明显的肺部肿瘤时,除关注CT增强后的强化特点外,仍需联合考虑疾病的流行病学特点及各自较特殊的影像特征。
-
PSP常被误诊为其他种类的良性肿瘤, 如错构瘤、血管瘤,以往文献多提及与良性肿瘤的鉴别要点,固本文不再赘述,而主要讨论与临床中血供较丰富的恶性肺肿瘤[17],如类癌、黏液表皮样癌等的鉴别要点。(1)类癌:起源于气道黏膜上皮的Kultchitsky细胞,属于肺神经内分泌肿瘤的一种,恶性程度较低。影像学上也可表现为血供丰富的软组织肿块,并伴钙化。但发病人群中老年男性占多数,可伴有类癌综合征或异位ACTH综合征。肿瘤多出现在肺门周围,常部分突向支气管腔内,所以继发的支气管阻塞性改变发生率较高,部分肺门及纵隔内见淋巴结增大。(2)黏液表皮样癌:可发生于各个年龄段,但50%以上的病例发生于30岁以下人群。病灶平扫特征可与PSP表现相似,但多位于较大的气道腔内,可向腔外生长,长径与气道长轴平行,常看见远侧气道内形成黏液栓。(3)腺癌:多数具有典型征象,但部分具有晕征或有钙化的病灶需注意鉴别,腺癌晕征多为肿瘤细胞沿肺泡上皮生长所致,出血较少,所以边界更加清晰,而肿瘤内钙化多为细砂样表现,边界多欠清晰,同时更容易出现转移、胸水等恶性征象。
综上所述,PSP影像学具有一定特征,结合增强后病灶强化明显及流行病学特征后,部分病例可明确诊断,以助临床术前决策。
肺硬化性肺泡细胞瘤的CT影像学表现
CT imaging findings of pulmonary sclerosing peumocytoma
-
摘要:
目的探讨肺硬化性肺泡细胞瘤(PSP)CT平扫及增强影像学特征。 方法回顾分析27例PSP病例的CT特点,并对其中22例PSP及对照组平扫、增强的相对CT值进行分析。 结果多数PSP形态规则,以软组织密度为主,部分可见钙化、空气半月征、血管贴边征及晕征,平扫相对CT值为0.77±0.41,小于增强后50 s(1.30±0.43)及90 s(1.45±0.46),差异均有统计学意义(P < 0.05和P < 0.01)。PSP组与对照组各时间点相对CT值差异均无统计学意义(P>0.05)。 结论CT平扫可显示PSP特点,结合增强后病灶强化明显,可助PSP诊断。 Abstract:ObjectiveTo investigate the plain CT and enhanced imaging features of pulmonary sclerosing peumocytoma(PSP). MethodsThe CT features in 27 patients with PSP were retrospectively analyzed.The relative CT value of plain CT and enhanced imaging in 22 cases with PSP and control group were analyzed. ResultsThe regular shape, main soft tissue density, partial calcification, air-gap, overlying vessel and halo sign were the main symptoms in most PSP, the relative CT value of PSP was (0.77±0.41), which was less than that after 50 s and 90 s of enhance[(1.30±0.43) and (1.45±0.46)] (P < 0.05 and P < 0.01).The differences of the relative CT value at each time-point between two groups were not statistically significant(P>0.05). ConclusionsThe CT plain scan can show the characteristics of PSP, which combined with obvious enhancement of lesions can help the PSP diagnosis. -
Key words:
- pulmonary sclerosing peumocytoma /
- tomography /
- diagnosis
-
表 1 一般资料及相对CT值比较(x±s)
指标 PSP组(n=22) 对照组(n=22) t P 性别 男
女4
188
41.83* >0.05 年龄/岁 52.09±15.66 54.27±11.09 0.53 >0.05 直径/cm 33.05±13.13 33.09±14.61 0.01 >0.05 相对CT值 平扫 0.77±0.41 0.78±0.51 0.11 >0.05 增强后50 s 1.30±0.43△△ 1.38±0.79△△ 0.42 >0.05 增强后90 s 1.45±0.46△△# 1.29±0.71△△ 0.84 >0.05 *示χ2值;组内比较:与平扫组比较△△P < 0.01;与增强后50 s组比较#P < 0.05 表 2 PSP组平扫及增强后相对CT值(x±s)
分组 n 相对CT值 平扫 22 0.77±0.41 增强后50 s 22 1.30±0.43** 增强后90 s 22 1.45±0.46**△ F — 14.92 P — < 0.01 MS组内 — 0.188 q检验:与平扫组比较*P < 0.05, **P < 0.01;与增强后50s组比较△P < 0.05, △△P < 0.01 -
[1] TRAVIS WD, BRAMBILLA E, NICHOLSON AG, et al.The 2015 world health organization classification of lung tumors:impact of genetic, clinical and radiologic advances since the 2004 classification[J].J Thorac Oncol, 2015, 10(9):1243. doi: 10.1097/JTO.0000000000000630 [2] YANG CH, LEE LY.Pulmonary sclerosing pneumocytoma remains a diagnostic challenge using frozen sections:a clinicopathological analysis of 59 cases[J].Histopathology, 2018, 72(3):500. doi: 10.1111/his.13391 [3] LIM JH, LEE N, CHOI DW, et al.Pulmonary sclerosing pneumocytoma mimicking lung cancer:Case report and review of the literature[J].Thorac Cancer, 2016, 7(4):508. doi: 10.1111/1759-7714.12341 [4] SHIN SY, KIM MY, OH SY, et al.Pulmonary sclerosing pneumocytoma of the lung:CT characteristics in a large series of a tertiary referral center[J].Medicine (Baltimore), 2015, 94(4):e498. doi: 10.1097/MD.0000000000000498 [5] CHEUNG YC, NG SH, CHANG JW, TAN CF, et al.Histopathological and CT features of pulmonary sclerosing haemangiomas[J].Clin Radiol, 2003, 58(8):630. doi: 10.1016/S0009-9260(03)00177-6 [6] IM JG, KIM WH, HAN MC, et al.Sclerosing hemangiomas of the lung and interlobar fissures:CT findings[J].JCAT, 1994, 18(1):34. [7] 史讯, 张志勇, 张兴伟, 等.肺硬化性血管瘤的CT表现与病理对照分析(附21例报告)[J].实用放射学杂志, 2007, 3(23):311. [8] NAM JE, RYU YH, CHO SH, et al.Air-trapping zone surrounding sclerosing hemangioma of the lung[J].JCAT, 2002, 26(3):358. [9] SOO IX, SITTAMPALAM K, LIM CH.Pulmonary sclerosing pneumocytoma with mediastinal lymph node metastasis[J].Asian Cardiovasc Thorac Ann, 2017, 25(7/8):547. [10] XU HM, ZHANG G.A rare case of pulmonary sclerosing hemagioma with lymph node metastasis and review of the literature[J].Int J Clin Exp Pathol, 2015, 8(7):8619. [11] KITAGAWA H, GOTO A, MINAMI M, et al.Case Reports sclerosing hemangioma of the lung with cystic appearance[J].Jpn J Clin Oncol, 2003, 33(7):360. doi: 10.1093/jjco/hyg067 [12] KHANNA A, ALSHABANI K, MUKHOPADYAY S, et al.Sclerosing pneumocytoma:case report of a rare endobronchial presentation[J].Medicine (Baltimore), 2019, 98(15):e15038. doi: 10.1097/MD.0000000000015038 [13] CHUNG MJ, LEE KS, HAN J, et al.Pulmonary sclerosing hemangioma presenting as solitary pulmonary nodule:dynamic CT findings and histopathologic comparisons[J].AJR, 2006, 187(2):430. doi: 10.2214/AJR.05.0460 [14] 况红妹, 龚洪翰, 彭德昌, 等.肺硬化性血管瘤的CT表现(附10例报告)[J].放射学实践, 2014, 29(2):166. [15] 史景云, 易祥华, 刘士远, 等.肺硬化性血管瘤增强CT表现及其与微血管密度的关系[J].临床放射学杂志, 2004, 23(1):53. [16] YI CA, LEE KS, KIM EA, et al.Solitary pulmonary nodules:dynamic enhanced multi-detector row CT study and comparison with vascular endothelial growth factor and microvessel density[J].Radiology, 2004, 233(1):191. doi: 10.1148/radiol.2331031535 [17] HAN SY, KIM BH, JANG HR, et al.Ectopic ACTH syndrome caused by pulmonary carcinoid tumor mimicking long-standing sclerosing hemangioma[J].Korean J Intern Med, 2016, 31(4):794. doi: 10.3904/kjim.2014.320 -





 下载:
下载: