-
全球每年新增食管癌病例约46万,死亡约40万,其死亡率居各种恶性肿瘤前列[1]。在我国食管癌是最常见的恶性肿瘤之一,其中约90%的病例为食管鳞状细胞癌。尽管近几十年来各种新技术、新方法不断发展,但食管癌病人总的生存时间并没有明显提高,术后转移和复发是其主要原因。含WW结构域的氧化还原酶(WW domain-containing oxidoreductase,WWOX)是一种抑癌基因,该基因位于人染色体16q23.216q24.1。WWOX基因表达异常在多种肿瘤中均可出现,主要为杂合性缺失和甲基化[2]。细胞外信号调节蛋白激酶1(extracellular signal regulated protein kinase 1,ERK1)是调节细胞生长、增殖及分裂信号网络的关键分子,其通过磷酸化激活后可以从细胞质转到细胞核,并通过诱导其上下游多种相关基因表达,从而促进肿瘤细胞的增殖、浸润和转移[3]。本研究主要通过免疫组织化学EliVisionTM plus法检测150例食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)病人肿瘤组织中WWOX和ERK1蛋白的表达,分析其与ESCC病人临床病理各参数之间的关系。现作报道。
-
收集蚌埠医学院第一附属医院临床病理科2010年1月至2012年6月存档石蜡包埋ESCC组织标本150例(术前未行任何放、化疗及其他抗肿瘤治疗)(ESCC组)和正常食管黏膜组织80例(对照组),所有病人均有完整的临床病理资料及随访资料,入选病人随访至病人死亡或截至2019年1月,根据随访者死亡及失访时间设定随访时间为7~100个月。80例对照组食管黏膜组织均取自远离ESCC肿块>5.0 cm,且均经病理HE染色证实为正常食管黏膜组织。
-
兔抗人多克隆抗体WWOX购自美国Abcam公司;鼠抗人ERK1单克隆抗体购自美国Origen公司;EliVisionTM plus和DAB显色试剂盒均购自中国福州迈新生物技术有限公司。
-
所有ESCC标本经4%中性甲醛溶液固定、石蜡包埋,4 μm厚连续切片,于二甲苯溶液及梯度浓度的乙醇溶液中脱蜡至水洗。使用pH值6.0的0.1 mol/L枸橼酸钠作为修复液,高压煮沸20 min,进行抗原修复。一抗原液以1:100稀释作为实验浓度。免疫组织化学其他操作步骤均按试剂说明书进行,同时采用已知阳性片作对照,采用PBS液替代一抗作为空白对照。
-
WWOX主要以细胞质内出现黄色或棕黄色颗粒为阳性着色;ERK1主要以细胞核出现黄色或棕黄色颗粒为阳性着色,细胞质也可以着色。阳性结果判定根据有关文献[4]描述方法进行。以积分≥3分为阳性, < 3分为阴性。免疫标记结果判定由两位病理医生采用独立双盲法得出。
-
采用χ2检验、Spearman相关分析、COX多因素分析及log-rank检验。
-
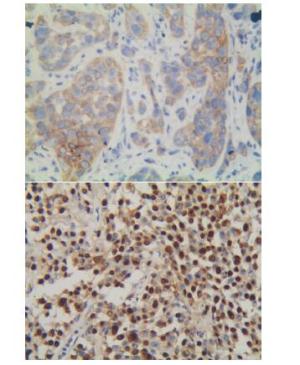
ESCC组WWOX和ERK1蛋白的阳性表达率分别为46.0%(69/150)和58.7%(88/150),与对照组的85.0%(68/80)和42.5%(34/80)差异均有统计学意义(χ2=32.96、5.47,P < 0.05)(见图 1)。Spearman相关分析显示,ESCC组织中WWOX表达与ERK1表达呈明显负相关关系(r=-0.420,P < 0.01)。
-
WWOX蛋白阳性率在不同TNM分期、组织浸润深度和有无淋巴结转移的ESCC病人间差异均有统计学意义(P < 0.05~P < 0.01);ERK1蛋白阳性率在不同组织分化程度、浸润深度、TNM分期和和有无淋巴结转移的ESCC病人间差异均有统计学意义(P < 0.01)(见表 1)。
临床参数 WWOX χ2 P ERK1 χ2 P 阴性 阳性 阴性 阳性 性别 男 59 53 0.31 >0.05 49 63 1.07 >0.05 女 22 16 13 25 年龄/岁 < 60 32 32 0.72 >0.05 22 42 2.23 >0.05 ≥60 49 37 40 46 肿瘤位置 上段 4 5 5 4 中段 55 50 1.18 >0.05 38 67 3.84 >0.05 下段 22 14 19 17 肿瘤大小/cm ≤3.0 30 21 0.72 >0.05 26 25 2.97 >0.05 >3.0 51 48 36 63 分化程度 高分化 18 16 20 14 中分化 43 40 0.76 >0.05 36 47 11.73 < 0.01 低分化 20 13 6 27 浸润深度 黏膜下层 5 11 11 5 肌层 23 31 11.02 < 0.05 33 21 27.83 < 0.01 外膜层 42 21 14 46 邻近组织 11 6 1 16 淋巴结转移 无 33 55 23.34 < 0.01 52 36 27.69 < 0.01 有 48 14 10 52 TNM分期/期 Ⅰ~Ⅱ 31 49 16.05 < 0.01 47 33 21.45 < 0.01 Ⅲ~Ⅳ 50 0 15 55 WWOX表达 阴性 — — — — 18 63 26.52 < 0.01 阳性 — — 44 25 表 1 不同临床病理参数ESCC病人的WWOX和ERK1蛋白表达比较(n)
-
将ESCC病人的年龄、性别、肿瘤长径、肿瘤位置、分化程度、淋巴结转移、TNM分期、浸润深度、WWOX表达、ERK1表达等因素纳入COX多因素模型进行分析,结果显示,WWOX和ERK1蛋白阳性表达和TNM分期是影响ESCC病人生存的独立预后因素(P<0.05~P < 0.01)(见表 2)。
变量 B SE Waldχ2 P OR(95%CI) WWOX表达 -0.461 0.227 4.115 < 0.05 0.630(0.404~0.985) ERK1表达 1.033 0.271 14.566 < 0.01 2.809(1.653~4.778) TNM分期 1.924 0.376 26.168 < 0.01 60.848(3.276~14.307) 表 2 ESCC病人生存预后的COX多因素分析
-
本组病例总的5年生存率为26.7%(40/150)。WWOX蛋白阳性组与阴性组的中位生存时间分别为56.0(35.0,72.0)个月和28.0(18.0,54.5)个月,差异有统计学意义(χ2=3.92,P < 0.05);ERK1蛋白阳性组与阴性组的中位生存时间分别为29.5(19.0,51.3)个月和56.5(38.0,74.3)个月,差异无统计学意义(χ2=2.27,P>0.05)。
-
WWOX基因是一个跨越脆性位点16D的大型基因[5],该基因是抑癌基因,它编码一个WWOX蛋白,在细胞凋亡、细胞代谢以及调节多种相互作用的转录因子方面发挥重要作用[6-8]。WWOX蛋白在大部分正常组织中强表达,但是在多种癌组织中却表达降低或缺失,包括乳腺癌、卵巢癌、膀胱癌、食管癌以及白血病等[6, 9-12]。本研究通过免疫组织化学法检测WWOX蛋白在ESCC组织及癌旁正常食管黏膜组织中的表达,结果显示,ESCC组织中WWOX蛋白阳性率明显低于对照组;而在ESCC组织中,随着浸润越深,WWOX蛋白阳性率降低,淋巴结有转移病人的ESCC组织中WWOX蛋白阳性率低于淋巴结无转移者,TNM分期增高,WWOX蛋白阳性率降低。Kaplan-Meier生存分析显示,在WWOX蛋白阳性表达的ESCC病人总生存时间高于其表达阴性者。上述结果提示WWOX的异常表达参与了ESCC的增殖、浸润及转移,且其表达降低意味着病人的预后不良,与相关文献[13]报道一致。
ERK1是MAPK信号通路中的关键成分,其具有丝氨酸/苏氨酸激酶特性,只有当其磷酸化后(p-ERK)才具有活性,而ERK1活化与否决定其在细胞增殖方面发挥的作用[14]。磷酸化的ERK1由细胞质进入细胞核内,从而激活其上下游相关的基因转录,促进细胞的增殖及抑制凋亡,导致细胞异常增殖而最终形成肿瘤。最近有研究者[15]在脑胶质母细胞瘤研究中发现ERK1明显增强,可导致肿瘤细胞异常增生,促进肿瘤生长。有学者[16]研究显示,用二氟甲基鸟氨酸(DFMO)可抑制NMBA诱导的p38α,ERK1/2和AKT/mTOR/p70S6K途径的激活。在NMBA诱导的大鼠模型中,发现DFMO可抑制ERK1通路,并在这些大鼠中被下调,从而进一步阻碍食管鳞状上皮不典型增生向浸润性癌的发展。还有学者[17]发现ESCC中的NONO蛋白水平显着上调,使用siRNA进行NONO耗竭可显著抑制ESCC细胞的增殖,侵袭并促进其凋亡,因为敲低NONO可以降低磷酸化Akt和ERK1的蛋白质水平。此外,ERK1还能促进肿瘤细胞的运动及诱导血管形成,从而促进肿瘤的复发与转移。本研究结果显示,ERK1蛋白在ESCC组织中阳性率高于对照组;且在ESCC组织中,随着ESCC的分化越差、浸润越深、TNM分期越高,ERK1的阳性率越高,淋巴结有转移病人的ERK1阳性率亦高于淋巴结无转移者;生存分析结果也显示,ERK1阳性ESCC病人的总生存时间低于ERK1阴性者。提示ERK1的反常激活促进了ESCC的发生、增殖、浸润及转移,且其阳性表达往往表明病人预后差[18]。
本研究中,Spearman相关分析显示,ESCC组织中WWOX与ERK1表达呈负相关关系。WWOX的表达异常降低或缺失,导致其诱导细胞凋亡的功能丧失,促使细胞异常增殖而导致ESCC的发生。ERK1的异常激活则进一步促进了ESCC发生及增殖[19],其还可以促进MMP的表达而降解基底膜及诱导肿瘤血管形成,最终导致ESCC的浸润及转移。COX多因素分析显示,WWOX和ERK1蛋白阳性表达及TNM分期是影响ESCC病人术后生存时间的独立预后因素。
综上所述,WWOX和ERK1在ESCC组织中的反常表达与ESCC的发生、增殖、浸润及转移相关,ESCC病人早期检测WWOX和ERK1蛋白表达,可作为预测ESCC病人浸润及转移的指标之一。
WWOX与ERK1在食管鳞状细胞癌中表达及其临床病理意义
Expression levels of WWOX and ERK1 in esophageal squamous cell carcinoma, and their clinicopathologic significance
-
摘要:
目的检测食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中含WW结构域的氧化还原酶(WW domain-containing oxidoreductase,WWOX)蛋白和细胞外信号调节蛋白激酶1(extracellular signal regulated protein kinase 1,ERK1)表达及其与ESCC病人临床病理参数的相关性。 方法采用免疫组织化学EliVisionTM plus法检测150例ESCC和80例正常食管黏膜组织(对照组)中WWOX和ERK1蛋白的表达情况。 结果ESCC组织中WWOX和ERK1蛋白的阳性表达率分别为46.0%和58.7%;对照组中WWOX和ERK1蛋白的阳性率分别为85.0%和42.5%,差异均有统计学意义(P < 0.05)。ESCC组织中WWOX蛋白阳性率与ERK1蛋白阳性率呈负相关关系(P < 0.01)。WWOX和ERK1蛋白阳性表达率在ESCC病人不同肿瘤组织浸润深度、TNM分期和是否淋巴结转移间差异均有统计学意义(P < 0.05~P < 0.01)。生存分析显示,WWOX蛋白阳性表达病人的生存时间高于阴性者(P < 0.05)。多因素回归分析显示,WWOX和ERK1蛋白阳性表达及TNM分期是影响ESCC病人术后生存的独立影响因子(P < 0.05~P < 0.01)。 结论WWOX和ERK1的异常表达参与了ESCC的发生、发展、浸润以及转移,早期联合检测WWOX和ERK1蛋白表达对ESCC的进展和预后判断有重要意义。 -
关键词:
- 食管鳞状细胞肿瘤 /
- 含WW结构域的氧化还原酶 /
- 细胞外信号调节蛋白激酶1
Abstract:ObjectiveTo explore the expression levels of WW domain-containing oxidoreductase(WWOX) and extracellular signal regulated protein kinase 1(ERK1) in esophageal squamous cell carcinoma(ESCC), and their correlations with the clinical characteristics. MethodsThe expression levels of WWOX and ERK1 protein in 150 specimens of ESCC and 80 normal esophageal mucosa tissues were examined using EliVisionTM plus immunohistochemistry. ResultsThe positive rates of WWOX and ERK1 protein in ESCC tissues and normal esophageal tissues were 46.0% & 58.7% and 85.0% & 42.5%, respectively, and the differences of those between two groups were statistically significant(P < 0.05).The positive rate of WWOX protein expression was negatively correlated with the positive rate of ERK1 protein in ESCC tissues(P < 0.01).The differences of the positive expression rates of WWOX and ERK1 protein in ESCC patients with different tumor tissue invasion depth, TNM stage and lymph node metastasis were statistically significant(P < 0.05 to P < 0.01).The results of survival analysis showed that the survival time of patients with positive WWOX expression was higher than that of patients with negative WWOX expression(P < 0.05).The results of multivariate regression analysis showed that the positive WWOX and ERK1 protein expression and TNM stage were the independent influencing factors of postoperative survival of ESCC patients(P < 0.05 to P < 0.01). ConclusionsThe abnormal expression of WWOX and ERK1 may be involved in the occurrence, progression and metastasis of ESCC.The combined detection of WWOX and ERK1 in early stage has an important role in predicting the progression and prognosis of ESCC. -
表 1 不同临床病理参数ESCC病人的WWOX和ERK1蛋白表达比较(n)
临床参数 WWOX χ2 P ERK1 χ2 P 阴性 阳性 阴性 阳性 性别 男 59 53 0.31 >0.05 49 63 1.07 >0.05 女 22 16 13 25 年龄/岁 < 60 32 32 0.72 >0.05 22 42 2.23 >0.05 ≥60 49 37 40 46 肿瘤位置 上段 4 5 5 4 中段 55 50 1.18 >0.05 38 67 3.84 >0.05 下段 22 14 19 17 肿瘤大小/cm ≤3.0 30 21 0.72 >0.05 26 25 2.97 >0.05 >3.0 51 48 36 63 分化程度 高分化 18 16 20 14 中分化 43 40 0.76 >0.05 36 47 11.73 < 0.01 低分化 20 13 6 27 浸润深度 黏膜下层 5 11 11 5 肌层 23 31 11.02 < 0.05 33 21 27.83 < 0.01 外膜层 42 21 14 46 邻近组织 11 6 1 16 淋巴结转移 无 33 55 23.34 < 0.01 52 36 27.69 < 0.01 有 48 14 10 52 TNM分期/期 Ⅰ~Ⅱ 31 49 16.05 < 0.01 47 33 21.45 < 0.01 Ⅲ~Ⅳ 50 0 15 55 WWOX表达 阴性 — — — — 18 63 26.52 < 0.01 阳性 — — 44 25 表 2 ESCC病人生存预后的COX多因素分析
变量 B SE Waldχ2 P OR(95%CI) WWOX表达 -0.461 0.227 4.115 < 0.05 0.630(0.404~0.985) ERK1表达 1.033 0.271 14.566 < 0.01 2.809(1.653~4.778) TNM分期 1.924 0.376 26.168 < 0.01 60.848(3.276~14.307) -
[1] TORRE LA, BRAY F, SIEGEL RL, et al.Global cancer statistics, 2012[J].Cancer J Clin, 2015, 65(2):87. doi: 10.3322/caac.21262 [2] YANG J, ZHAO L, TIAN W, et al.Correlation of WWOX, RUNX2 and VEGFA protein expression in human osteosarcoma[J].BMC Med Genomics, 2013, 6:56. doi: 10.1186/1755-8794-6-56 [3] HSU YL, HOU MF, KUO PL, et al.Breast tumor-associated osteoblast-derived CXCL5 increases cancer progression by ERK/MSK1/Elk-1/snail signaling pathway[J].Oncogene, 2013, 32(37):4436. doi: 10.1038/onc.2012.444 [4] WU S, YU L, WANG D, et al.Aberrant expression of CD133 in non-small cell lung cancer and its relationship to vasculogenic mimicry[J].BMC Cancer, 2012, 12:535. doi: 10.1186/1471-2407-12-535 [5] STEWART DJ, NUNEZ MI, JELINEK J, et al.Impact of decitabine on immunohistochemistry expression of the putative tumor suppressor genes FHIT, WWOX, FUS1 and PTEN in clinical tumor samples[J].Clin Epigenetics, 2014, 6(1):13. doi: 10.1186/1868-7083-6-13 [6] CUI Z, LIN D, CHENG F, et al.The role of the WWOX gene in leukemia and its mechanisms of action[J].Oncol Rep, 2013, 29(6):2154. doi: 10.3892/or.2013.2361 [7] DAYAN S, O'KEEFE LV, CHOO A, et al.Common chromosomal fragile site FRA16D tumor suppressor WWOX gene expression and metabolic reprogramming in cells[J].Genes Chromosomes Cancer, 2013, 52(9):823. doi: 10.1002/gcc.22078 [8] AGEILAN R, CROCE CM.WWOX in biological control and tumorigenesis[J].J Cell Physiol, 2007, 212(2):307. doi: 10.1002/jcp.21099 [9] GULER G, HUEBNER K, HIMMETOGLU C, et al.Fragile histidine triad protein, WW domain-containing oxidoreductase protein WWOX, and activator protein 2gamma expression levels correlate with basal phenotype in breast cancer[J].Cancer, 2009, 115(4):899. doi: 10.1002/cncr.24103 [10] LAN C, CHENGGANG W, YULAN B, et al.Aberrant expression of WWOX protein in epithelial ovarian cancer:a clinicopathologic and immunohistochemical study[J].Int J Gynecol Pathol, 2012, 31(2):125. doi: 10.1097/PGP.0b013e3182297fd2 [11] YANG W, CUI S, MA J, et al.Cigarette smoking extract causes hypermethylation and inactivation of WWOX gene in T-24 human bladder cancer cells[J].Neoplasma, 2012, 59(2):216. doi: 10.4149/neo_2012_028 [12] GUO W, WANG G, DONG Y, et al.Decreased expression of WWOX in the development of esophageal squamous cell carcinoma[J].Mol Carcinog, 2013, 52(4):265. [13] YAN H, SUN J.Methylation status of WWOX gene promoter CpG islands in epithelial ovarian cancer and its clinical significance[J].Biomed Rep, 2013, 1(3):375. [14] SUBRAMANIAM S, UNSICKER K.ERK and cell death:ERK1/2 in neuronal death[J].FEBS J, 2010, 227(1):22. [15] XIE Y, DONG CD, WU Q, et al.Ornithine decarboxylase inhibition downregulates multiple pathways involved in the formation of precancerous lesions of esophageal squamous cellcancer[J].Mol Carcinog, 2020, 59(2):215. doi: 10.1002/mc.23144 [16] LAN L, WEI W, ZHENG Y, et al.Deferoxamine suppresses esophageal squamous cell carcinoma cell growth via ERK1/2 mediated mitochondrial dysfunction[J].Cancer Lett, 2018, 432:132. doi: 10.1016/j.canlet.2018.06.012 [17] CHENG R, ZHU S, GUO S, et al.Downregulation of NONO induces apoptosis, suppressing growth and invasion in esophageal squamous cell carcinoma[J].Oncol Rep, 2018, 39(6):2575. [18] 李伟, 邵南乐, 张小燕, 等.ERK1/2通路与舌鳞癌细胞Cal-27生物学行为的相关性[J].华中科技大学学报(医学版), 2012, 41(6):650. [19] HUANG YC, HUNG WC, CHEN WT, et al.Expression of WWOX and FHIT is downregulated by exposure to arsenite in human uroepithelial cells[J].Toxicol Lett, 2013, 220(2):118. -




 下载:
下载:


