-
全氟辛酸(perfluorooctanoic acid,PFOA)属于全氟类化合物,是全氟烷酸的重要代表物,其不仅具有较强的稳定性,还能耐光解、水解及微生物降解,基于此类特性PFOA被大量应用于食品包装、水源、纺织中,从而造成了广泛的环境污染,并为进入机体提供了条件;而饮食是摄入PFOA的主要途径,PFOA在机体中难被代谢排出[1-2]。研究[3-4]报道,在动物组织与人体血清中均能检测到PFOA,PFOA暴露会造成肝脏、心脏、肾脏、免疫、生殖及甲状腺等大量脏器系统侵损,是具有全身多脏器毒性作用的化合物。在心血管方面,PFOA可降低成年豚鼠心室肌细胞动作电位持续时间与峰值,此外可使膜电位改变异常,促进Ca2+内流加快细胞中Ca2+负荷从而发生心肌细胞损伤[5-6]。还有研究[6-7]发现,PFOA暴露在心脏中造成的心肌细胞损伤与氧化应激密切相关,PFOA暴露易增加活性氧释放,促进细胞DNA氧化加重心肌损伤程度。因此,目前应确定安全、有效药物用于预防PFOA引起的心肌损伤,显得尤为重要。
芦丁是一种生物活性丰富的黄酮类化合物,具有预防心肌缺血、心律失常,调节血清胆固醇等作用。研究[8-9]发现芦丁可缓解5-羟色胺所致的血管损伤并保护血管内皮细胞,同时还有抗炎症、抗化学性肝损伤的作用,但芦丁对PFOA造成的小鼠心肌损伤保护作用尚不明确。本研究探讨芦丁对PFOA诱导的小鼠心肌损伤的保护机制,为开发预防PFOA毒性作用心肌损伤的药物提供实验依据。
-
芦丁(纯度≥98%,153-18-4,北京百灵威科技有限公司);PFOA(纯度≥98%,335-67-1,Sigma-Aldrich);乳酸脱氢酶(LDH)测定试剂盒(微孔法)(A020-2,南京建成生物工程研究所);总胆固醇(TC)测定试剂盒(单试剂GPO-PAP法)(A111-1-1,南京建成生物工程研究所);三酰甘油(TG)测定试剂盒(单试剂GPO-PAP法)(A110-1-1,南京建成生物工程研究所);还原型谷胱甘肽检测试剂盒(微板法)(A006-2,南京建成生物工程研究所);总超氧化物歧化酶(T-SOD)测定试剂盒(羟胺法)(A001-1,南京建成生物工程研究所)。酶标仪(Synergy2,美国伯腾仪器有限公司)。
-
健康SPF级雄性ICR小鼠24只,体质量18~20 g,购自南京市江宁区青龙山动物繁殖场,动物合格证号:SCXK(沪)2013-0006。饲养于小鼠动物房适应性1周,经蚌埠医学院动物伦理委员会批准,饲养温度(21±2)℃,相对湿度为50%~70%,光周期为每天12 h光照、12 h黑暗,小鼠自由取食,自由饮去离子水。
-
适应性1周后将24只ICR小鼠随机分为3组,每组8只,即对照组、PFOA组、PFOA+芦丁组。
对照组:在实验14 d内每日灌胃等体积0.9%氯化钠溶液,连续14 d;PFOA组:在实验14 d内每天早上9点称重后,按体质量进行5mg·kg-1·d-1 PFOA灌胃,PFOA暴露浓度设计参考WANG等[9]研究,连续14 d;PFOA+芦丁组:在实验14 d内每天早上9点称重5mg/kg PFOA进行灌胃,每天下午3点160mg·kg-1·d-1芦丁灌胃前搅拌水浴加热37℃后灌胃,芦丁浓度设计参考储金秀等[10]研究,连续14 d。期间每天记录小鼠体质量与生命体征,称量体质量与灌胃时间为固定在每天的相同时间点,每日1次,连续14 d。
-
在14 d时,眼眶后静脉丛采集血液1 mL,并处死小鼠,血液经3000 r/min、4℃离心15 min制备血清,并存放于-80℃待测。立即迅速取出心脏组织,去除右心耳心房及大血管,用等体积0.9%氯化钠溶液清洗,滤纸充分将水分吸干后称重,然后取一部分存放于-80℃环境中备用;取一部分心肌组织固定于甲醛溶液中。随机挑选5只小鼠进行生化及酶活检测,余下3只小鼠进行HE切片染色。
-
采用微板法测定小鼠血清LDH活性。
-
取待测心脏组织5 cm3,采用高速组织研磨仪(Servicebio,KZ-Ⅱ)将组织和0.9%氯化钠溶液混合制作成10%心肌组织匀浆,各取0.5 mL 10%匀浆加0.9%氯化钠溶液4.5 mL制备1%匀浆,采用FD酶法测定TG、TC含量,按照测试盒说明书严格操作,采用酶标仪读取光密度值。
-
取待测心脏组织5 cm3,采用高速组织研磨仪将组织和0.9%氯化钠溶液混合制作成10%心肌组织匀浆,各取0.5 mL 10%匀浆加0.9%氯化钠溶液4.5 mL制备1%匀浆。采用组织硫代巴比妥酸法检测丙二醛(MDA)含量、微板法法检测谷胱甘肽过氧化物酶(GSH-PX)活性、羟胺法检测T-SOD活性,以上观察指标均严格按照检测试剂盒说明书操作。
-
将固定于甲醛溶液中的心脏组织石蜡包埋切片、厚度约4 μm,经脱蜡、乙醇脱水后,苏木精复染、脱水、透明、封片,将封片放在100倍光学显微镜下观察心肌组织并拍照。
-
心脏体质量比=小鼠心脏质量/小鼠体质量×100%。
-
采用方差分析和q检验。
-
各组小鼠体质量1~2 d比较差异无统计学意义(P>0.05);3~14 d各组小鼠体质量有差异,且PFOA组小鼠体质量低于PFOA+芦丁组(P < 0.05);PFOA组和PFOA+芦丁组小鼠干预14 d心脏质量低于对照组,而PFOA+芦丁组高于PFOA组(P < 0.05);3组小鼠14 d心脏体质量差异无统计学意义(P>0.05)(见表 1)。
分组 体质量D1 体质量D2 体质量D3 体质量D4 体质量D5 体质量D6 体质量D7 体质量D8 对照组 19.32±0.38 24.51±0.37 25.82±0.43 25.95±0.48 26.25±0.72 29.18±0.56 30.59±0.66 31.41±0.67 PFOA组 19.60±0.26 24.52±0.42 24.98±0.44* 25.02±0.45* 25.60±0.36* 26.80±0.45* 28.03±0.56* 27.96±0.52* PFOA+芦丁组 19.65±0.20 24.16±0.35 25.33±0.45* 25.91±0.54# 26.86±0.53*# 27.17±0.65*# 28.36±0.71 28.97±0.30*# F 3.01 2.32 7.35 9.06 10.26 41.94 37.14 93.34 P >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 0.084 0.145 0.194 0.242 0.310 0.313 0.418 0.270 分组 体质量D9 体质量D10 体质量D11 体质量D12 体质量D13 体质量D14 D14心脏质量/g D14心脏体质量比/% 对照组 32.73±0.83 33.60±0.80 34.01±0.91 34.59±0.86 35.53±0.89 36.01±0.93 0.65±0.02 1.81±0.38 PFOA组 27.67±0.72* 27.57±0.86* 26.51±0.63* 26.73±0.98* 27.61±0.99* 27.41±0.74* 0.48±0.02* 1.80±0.12 PFOA+芦丁组 28.20±0.66*# 28.45±0.74*# 28.79±0.93*# 29.07±0.76*# 29.89±0.57*# 29.76±0.62*# 0.58±0.01*# 1.95±0.36 F 113.01 132.12 169.83 171.62 190.21 263.93 194.71 0.59 P <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 >0.05 MS组内 0.548 0.642 0.697 0.760 0.699 0.599 0.000 0.096 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 表 1 芦丁干预PFOA暴露14 d小鼠体质量和心脏质量比较(ni=8;x±s; g)
-
PFOA+芦丁组小鼠14 d心肌血清LDH活性低于PFOA组(P < 0.05);而PFOA组与PFOA+芦丁组小鼠14 d心肌TG、TC含量差异均无统计学意义(P>0.05)(见表 2)。
分组 TG含量/(mmol/L) TC含量/(mmol/L) LDH/(U/L) 对照组 3.17±0.44 2.36±0.56 194.91±88.13 PFOA组 3.81±0.68 3.24±0.51* 584.72±218.84* PFOA+芦丁组 2.61±1.35 2.96±0.23 485.09±168.40# F 2.18 4.84 7.32 P >0.05 <0.05 <0.01 MS组内 0.826 0.209 28 005.470 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 表 2 芦丁干预PFOA暴露14 d小鼠心肌TG、TC含量和血清LDH活性(ni=5;x±s)
-
PFOA组小鼠14 d心肌MDA含量高于对照组(P < 0.05),而PFOA组与对照组小鼠14 d心肌T-SOD、GSH-PX活性差异无统计学意义(P>0.05);PFOA+芦丁组小鼠14 d心肌MDA含量低于PFOA组,但无统计学意义(P>0.05)。PFOA+芦丁组与PFOA组在小鼠14 d时心肌T-SOD活性上差异亦无统计学意义(见表 3)。
分组 T-SOD/(U/mg·prot) GSH-PX/(U/mg·prot) MDA/(nmol/mg·prot) 对照组 10 342.21±1 565.84 12 853.69±2 959.59 151.27±16.19 PFOA组 16 728.75±3 515.45 20 168.04±6 013.59 215.22±31.45* PFOA+芦丁组 15 366.38±11 288.74 26 208.19±10 713.66* 186.24±23.41 F 1.19 4.20 8.55 P >0.05 <0.05 < 0.01 MS组内 47 415 298.130 53 234 982.750 599.749 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 表 3 芦丁干预PFOA暴露14 d小鼠心肌MDA含量、GSH-PX和T-SOD活性(ni=5;x±s)
-
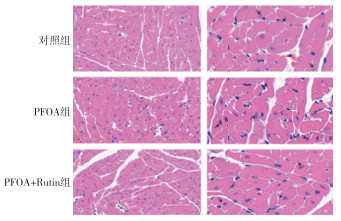
对照组心肌纤维排列整齐,心肌细胞并未见萎缩或肥大;PFOA组小鼠表现出不同程度心肌细胞表现出肥大、坏死,心肌纤维扭曲、横纹模糊;如图中黑色箭头所示,PFOA处理组,部分心肌细胞胞核明显偏向细胞边缘。PFOA+芦丁组排列较为整齐,质内间观察到少量胶原纤维增生胞质,部分心肌细胞表现出心肌纤维扭曲轻微(见图 1)。
-
全氟烷酸属于一类人工合成化合物,在国民生产及生活中都具有重要作用,但由于其广泛的使用,现已造成了持久性的环境污染,在人与动物健康方面也造成了很多影响[10]。PFOA是这类化合物的重要代表,它严重影响机体代谢稳定性,经过氧化物酶体增殖物活化受体活性在心肌损伤中发挥毒性作用[11]。研究[12]报道,PFOA暴露易造成的心肌损伤常表现在小鼠体质量、心脏质量及心肌组织形态学变化等方面。在本研究中,从体质量、心脏质量观察到,PFOA组小鼠体质量下降、心脏质量增加,而从组织病理学中发现PFOA暴露小鼠的心脏发生显著形态学改变,如纤维结构紊乱、心肌细胞肥大、坏死,胶原结缔组织增生等;此外,PFOA暴露明显增加了心肌TC含量及血清LDH活性与心肌MDA含量,在心肌细胞损伤时,大量LDH从细胞释放到血液。研究[13]报道,PFOA暴露所致的心肌损伤与氧自由基造成TG、TC过氧化,同时加快细胞中Ca2+负荷过大诱发不可逆性线粒体损伤密切相关。MDA是脂质过氧化产物,该含量在心肌发生过氧化损伤时呈现为高表达,本研究中PFOA组MDA含量高于对照组,与既往文献[14-15]报道相符。提示PFOA暴露对心脏具有毒性作用,可造成小鼠发生明显的心肌损伤。
临床研究[16-17]发现,芦丁在改善心肌缺血、抗氧化、心律失常,调低血清胆固醇水平、血小板聚集等多个方面具有作用。SONAM等[18]研究报道芦丁可改善心肌缺血再灌注大鼠的心功能,预防抗氧化损伤;PRAMANIL等[19]研究采用曲克芦丁干预蒽环类药物建立大鼠心肌损伤模型,结果发现芦丁对蒽环类药物诱发的大鼠心肌损伤具有保护作用;WANG等[20]研究发现,芦丁可降低心肌损伤大鼠SOD活性,增加MDA含量。
本研究发现芦丁对PFOA所致小鼠血清LDH升高及心肌组织结构损伤等有明显的改善作用。可在一定程度上减少MDA的生成。
综上所述,芦丁可显著改善PFOA造成的小鼠心肌损伤组织病理学变化,同时调控小鼠心肌MDA含量、血清LDH活性、GSH-PX活性,提示芦丁可缓解PFOA小鼠心肌组织损伤,抑制心肌纤维化,具有一定的抗氧化保护作用。
芦丁减轻全氟辛酸暴露致小鼠心肌损伤的作用研究
Effect of rutin on reducing myocardial injury induced by perfluorooctanoic acid exposure in mice
-
摘要:
目的探讨芦丁对全氟辛酸(PFOA)造成的小鼠心肌损伤的保护作用研究。 方法采用PFOA暴露建立小鼠心肌损伤模型,观察芦丁对PFOA造成小鼠心肌损伤模型体质量、心脏质量、心肌TG、TC含量和血清LDH活性、氧化应激指标变化(心肌MDA含量、GSH-PX和T-SOD活性)及心肌组织形态学变化。 结果各组小鼠体质量1~2 d比较差异无统计学意义(P>0.05);3~14 d各组小鼠体质量有差异,且PFOA组小鼠体质量低于PFOA+芦丁组(P < 0.05);PFOA组和PFOA+芦丁组小鼠干预14 d心脏质量低于对照组,而PFOA+芦丁组高于PFOA组(P < 0.05)。PFOA组小鼠14 d心肌TC含量及血清LDH活性高于对照组(P < 0.05);PFOA+芦丁组小鼠14 d心肌TG含量及血清LDH活性低于PFOA组(P < 0.05);而PFOA组与PFOA+芦丁组小鼠14 d心肌TC含量差异无统计学意义(P>0.05);PFOA组小鼠14 d心肌MDA含量高于对照组(P < 0.05),而PFOA组与对照组小鼠14 d心肌T-SOD、GSH-PX活性差异无统计学意义(P>0.05);PFOA+芦丁组小鼠14 d心肌GSH-PX活性高于PFOA组,而PFOA+芦丁组与PFOA组在小鼠14 d时心肌MDA含量、GSH-PX活性差异无统计学意义(P>0.05)。 结论芦丁干预可以减轻PFOA暴露致小鼠心肌损伤作用。 Abstract:ObjectiveTo explore the protective effects of rutin on myocardial injury induced by perfluorooctanoic acid(PFOA) exposure in mice. MethodsPFOA was used to establish a model of myocardial injury in mice, and the effects of rutin on the body weight, heart weight, myocardial TG, TC content, serum LDH activity, and oxidative stress indicators(myocardial MDA content, GSH-PX and T-SOD activity) and myocardial morphology were investigated in mice. ResultsThere was no statistical significance in the weight of 1-2 d mice among all groups(P>0.05).The differences of in the weight of 3- 14 d mice on day 8 to day 14 among all groups were statistically significant(P < 0.05), and the weight of mice in PFOA group was lower than that in PFOA+rutin group, the heart weight of mice in PFOA group and PFOA+rutin group was lower than that in control group after 14 days of intervention, while the heart weight of mice in PFOA+rutin group was higher than that in PFOA group(P < 0.05).After 14 days of intervention, the myocardial TC content and serum LDH activity in PFOA group were higher than those in control group(P < 0.05), the myocardial TG content and serum LDH activity in PFOA+rutin group were lower than those in PFOA group(P < 0.05), and the difference of the myocardial TC content between PFOA group and PFOA+rutin group was not statistically significant(P>0.05).After 14 days of inverention, the myocardial MDA content and in PFOA group was higher than those in control group(P < 0.05), but there was no statistical significance in myocardial GSH-PX activity between PFOA group and the control group(P>0.05), the myocardial MDA content in PFOA+rutin group was lower than that in PFOA group, while the differences of the myocardial MDA content and GSH-PX activity between PFOA+rutin group and PFOA group were not statistically significant(P>0.05). ConclusionsRutin intervention can ameliorate the myocardial injury induced by PFOA exposure in mice. -
Key words:
- myocardial injury /
- rutin /
- perfluorooctanoic acid /
- toxicology
-
表 1 芦丁干预PFOA暴露14 d小鼠体质量和心脏质量比较(ni=8;x±s; g)
分组 体质量D1 体质量D2 体质量D3 体质量D4 体质量D5 体质量D6 体质量D7 体质量D8 对照组 19.32±0.38 24.51±0.37 25.82±0.43 25.95±0.48 26.25±0.72 29.18±0.56 30.59±0.66 31.41±0.67 PFOA组 19.60±0.26 24.52±0.42 24.98±0.44* 25.02±0.45* 25.60±0.36* 26.80±0.45* 28.03±0.56* 27.96±0.52* PFOA+芦丁组 19.65±0.20 24.16±0.35 25.33±0.45* 25.91±0.54# 26.86±0.53*# 27.17±0.65*# 28.36±0.71 28.97±0.30*# F 3.01 2.32 7.35 9.06 10.26 41.94 37.14 93.34 P >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 0.084 0.145 0.194 0.242 0.310 0.313 0.418 0.270 分组 体质量D9 体质量D10 体质量D11 体质量D12 体质量D13 体质量D14 D14心脏质量/g D14心脏体质量比/% 对照组 32.73±0.83 33.60±0.80 34.01±0.91 34.59±0.86 35.53±0.89 36.01±0.93 0.65±0.02 1.81±0.38 PFOA组 27.67±0.72* 27.57±0.86* 26.51±0.63* 26.73±0.98* 27.61±0.99* 27.41±0.74* 0.48±0.02* 1.80±0.12 PFOA+芦丁组 28.20±0.66*# 28.45±0.74*# 28.79±0.93*# 29.07±0.76*# 29.89±0.57*# 29.76±0.62*# 0.58±0.01*# 1.95±0.36 F 113.01 132.12 169.83 171.62 190.21 263.93 194.71 0.59 P <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 >0.05 MS组内 0.548 0.642 0.697 0.760 0.699 0.599 0.000 0.096 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 表 2 芦丁干预PFOA暴露14 d小鼠心肌TG、TC含量和血清LDH活性(ni=5;x±s)
分组 TG含量/(mmol/L) TC含量/(mmol/L) LDH/(U/L) 对照组 3.17±0.44 2.36±0.56 194.91±88.13 PFOA组 3.81±0.68 3.24±0.51* 584.72±218.84* PFOA+芦丁组 2.61±1.35 2.96±0.23 485.09±168.40# F 2.18 4.84 7.32 P >0.05 <0.05 <0.01 MS组内 0.826 0.209 28 005.470 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 表 3 芦丁干预PFOA暴露14 d小鼠心肌MDA含量、GSH-PX和T-SOD活性(ni=5;x±s)
分组 T-SOD/(U/mg·prot) GSH-PX/(U/mg·prot) MDA/(nmol/mg·prot) 对照组 10 342.21±1 565.84 12 853.69±2 959.59 151.27±16.19 PFOA组 16 728.75±3 515.45 20 168.04±6 013.59 215.22±31.45* PFOA+芦丁组 15 366.38±11 288.74 26 208.19±10 713.66* 186.24±23.41 F 1.19 4.20 8.55 P >0.05 <0.05 < 0.01 MS组内 47 415 298.130 53 234 982.750 599.749 q检验:与对照组比较*P < 0.05;与PFOA组比较#P < 0.05 -
[1] GANG D, JINHONG S, YANG Z.Perfluorooctanoic acid impaired glucose homeostasis through affecting adipose AKT pathway[J].Cytotechnol, 2018, 70(1):479. doi: 10.1007/s10616-017-0164-6 [2] STEENLAND K, BARRY V, SAVITZ D.Serum perfluorooctanoic acid and birthweight:an updated meta-analysis with bias analysis[J].Epidemiol, 2018, 29(1):765. [3] PARK K, ALI L, KIM J.Photodegradation of perfluorooctanoic acid by graphene oxide-deposited tio 2 nanotube arrays in aqueous phase[J].J Environ Manage, 2018, 218(1):333. [4] YI Z, GUANG L, DAQIAN Q, et al.Biomarker responses of earthworms (Eisenia fetida) to soils contaminated with perfluorooctanoic acid[J].Environ Sci Poll Res Int, 2017, 24(2):22073. [5] SU H, SHI Y, YONG L, et al.Home produced eggs:An important pathway of human exposure to perfluorobutanoic acid (PFBA) and perfluorooctanoic acid (PFOA) around a fluorochemical industrial park in China[J].Environ Int, 2017, 101(3):1. [6] SHU J.Differential toxicity between perfluorooctane sulfonate(PFOS) and perfluorooctanoic acid (PFOA)[J].J Toxicol Sci, 2016, 41(4):SP27. [7] QI L, SHANG L, QING H.Laccase induced degradation of perfluorooctanoic acid in a soil slurry[J].J Hazard Mater, 2018, 359(3):241. [8] ASIF M, QUANWEI W, KAIZHI Z, et al.Protective roles of rutin against restraint stress on spermatogenesis in testes of adult mice[J].Tissue Cell, 2018, 50(4):133. [9] WANG J, ZHANG Y, ZHANG W, et al.Association of perfluorooctanoic acid with HDL cholesterol and circulating miR-26b and miR-199-3p in workers of a fluorochemical plant and nearby residents.[J].Environ Sci Technol, 2012, 46(17):9274. doi: 10.1021/es300906q [10] 储金秀, 韩淑英, 余红, 等.荞麦花叶芦丁对小鼠酒精性肝损伤的保护作用[J].江苏医药, 2011, 37(5):503. [11] BEHR A, LICHTENSTEIN D, BRAEUNING A, et al.Perfluoroalkylated substances (PFAS) affect neither estrogen and androgen receptor activity nor steroidogenesis in human cells, in vitro[J].Toxicol Lett, 2018, 291(3):51. [12] MARINO A, ZENG G, NOSTRO A, et al.Antimicrobial activities, toxicity and phenolic composition of Asphodeline anatolica E.Tuzlaci leaf extracts from Turkey[J].Nat Prod Res, 2016, 30(5):2620. [13] FENG P, TIAN S, YANG L.Extraction, purification and antioxidation of a polysaccharide from Fritillaria unibracteata var wabuensis[J].Int J Biol Macromol, 2018, 112(2):1073. [14] MAGDA S, MOUTINHO S, SOFIA A, et al.Curcumin and rutin down-regulate cyclooxygenase-2 and reduce tumor-associated inflammation in HPV16-transgenic mice[J].Anticancer Res, 2018, 38(1):1461. [15] QSAWE S, FAROMBI E.Quercetin and rutin ameliorates sulphasalazine-induced spermiotoxicity, alterations in reproductive hormones and steroidogenic enzyme imbalance in rats[J].Andrologia, 2018, 50(6):12981. [16] DANIELLE S, ALAN O, MARILIA T, et al.Vaccinium macrocarpon aiton extract ameliorates inflammation and hyperalgesia through oxidative stress inhibition in experimental acute pancreatitis[J].Evid Based Compl Alternat Med, 2018, 7(4):1. [17] MEHMET E, DERYA C, OZBEK H, et al.Evaluation of the antidiabetic property of capparis ovata desf.Var.palaestina zoh.extracts using in vivo and in vitro approaches[J].Endocr Metab Immune Disord Drug Targets, 2018, 18(5):489. doi: 10.2174/1871530318666180328110524 [18] SONAM K, MADHURI G, HAVEER C, et al.Rosa damascena restrains Plasmodium falciparum progression in vitro and impedes malaria pathogenesis in murine model[J].Biomed Pharmacother, 2018, 97(3):1654. [19] PRAMANIL B, PRAMANIK S, SARKER D, et al.Removal of emerging perfluorooctanoic acid and perfluorooctane sulfonate contaminants from lake water[J].Environ Technol, 2017, 38(2):1937. [20] WANG N, LV H, ZHOU Y, et al.Complete defluorination and mineralization of perfluorooctanoic acid by a mechanochemical method using alumina and persulfate[J].Enviro Sci Technol, 2019, 53(6):8302. -





 下载:
下载: