-
肺癌是世界范围内发病率和死亡率最高的肿瘤,是一个重要的全球健康性问题。非小细胞肺癌作为肺癌最主要的类型,占初诊病人的80%以上[1],5年生存率仅17%左右[2]。肺腺癌作为非小细胞肺癌诊断最多的组织学亚型[3-4],其生存期仍不太理想。虽然肺腺癌有很多新的、疗效较好的治疗方法,如靶向治疗、免疫治疗等,但全身化疗仍为重要的治疗方法。现如今尽管化疗的疗效有所提高,但晚期肺癌病人的预后仍较差。因此,早期识别和确定预后指标对提高病人生活质量和延长生存期颇为重要。越来越多的证据[5-6]表明,中性粒细胞淋巴细胞比值(NLR)和血小板淋巴细胞比值(PLR)是系统性炎症和免疫反应的潜在指标,且这些比值易于计算,已被明确为胃癌[7]、胆管癌[8]、肝癌[9]、非小细胞肺癌[10]、乳腺癌[11]、结肠癌[12]预后的预测标志物。目前监测NLR及PLR动态变化与一线化疗疗效关系的研究较少,现就NLR及PLR动态变化与晚期肺腺癌病人一线化疗疗效及预后关系作一探究。
-
回顾性分析2012-2017年在我院接受一线化疗的晚期肺腺癌病人的临床资料。纳入标准:(1)经病理学及细胞学确诊的晚期(ⅢB~Ⅳ期)肺腺癌(按国际UICC 2009年肺癌TNM分期标准进行分期);(2)预计生存期超过3个月;(3)能签署化疗知情同意书并接受后续随访的;(4)在此之前未经任何抗肿瘤治疗;(5)近期无感染及以往无其他恶性肿瘤病史;(6)至少完成4周期化疗,每2周期治疗后行CT等影像学检查对化疗疗效进行评估;(7)具有完整的病历资料及随访记录。共纳入病人192例,男128例,女65例,ⅢB期47例,Ⅳ期146例。
-
通过病历管理系统收集相关资料,包括年龄、性别、TNM分期、吸烟史、淋巴结转移、远处转移、表皮生长因子受体(EGFR)突变情况、一线化疗方案,对2、4周期化疗后疗效评价及总生存期(OS)。收集并利用化疗前、3周期化疗前及5周期化疗前1周中性粒细胞计数、淋巴细胞计数、血小板计数等炎症指标,计算NLR、PLR。
-
通过电话、短信及来院随访等方式了解病人疾病变化及生存情况。OS定义为病人初次确诊至死亡的时间,尚存者计算初次确诊至最后一次随访的时间,所有病人随访开始时间为2012年1月,末次随访时间2019年6月6日。随访率为100.0%,最短随访时间98d,最长2187d。
-
化疗疗效评价依照实体瘤疗效评价标准1.1版[13]分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD);观察指标:NLR、PLR、一线化疗的近期疗效和OS;化疗前NLR、PLR标记为NLR0、PLR0,2周期后标记为NLR2、PLR2,4周期后标记为NLR4、PLR4;NLR0、NLR4、PLR0、PLR2、PLR4通过受试者工作特征曲线(ROC曲线)确定的截断值分别为≥3.39、≥2.54、≥186.48、≥170.50、≥137.64。
-
采用非参数检验、Spearman相关分析、ROC曲线、Kaplan-Meier生存分析、Log-rank检验和Cox多因素分析模型。
-
NLR0、NLR2、PLR0、PLR2在2周期化疗后PD组的水平明显高于CR+PR+SD组(P<0.01)。NLR0、NLR2、NLR4、PLR0、NLR2、NLR4在4周期化疗后PD组的水平高于CR+PR+SD组(P<0.01)(见表 1)。
变量 2周期化疗后疗效 Z P 4周期化疗后疗效 Z P CR+PR+SD PD CR+PR+SD PD NLR0 2.69(1.95, 3.56) 4.27(2.07, 6.40) -3.16 < 0.01 2.70(1.89, 3.56) 3.70(2.40, 5.58) -3.14 < 0.01 NLR2 1.86(1.47, 2.49) 2.90(1.69, 5.75) -3.56 < 0.01 1.86(1.47, 2.52) 2.49(1.66, 4.94) -3.30 < 0.01 NLR4 1.79(1.26, 2.55) 3.50(2.67, 6.30) -6.10 < 0.01 PLR0 134.30(107.96, 179.89) 205.85(125.90, 322.95) -3.93 < 0.01 142.43(105.61, 185.08) 190.20(129.17, 277.88) -3.79 < 0.01 PLR2 151.92(122.35, 206.40) 243.87(152.59, 362.42) -3.96 < 0.01 153.02(123.45, 213.65) 184.62 (143.52, 331.43) -2.55 < 0.01 PLR4 137.64(100.00, 175.69) 215.09(136.20, 290.72) -4.21 < 0.01 表 1 NLR、PLR与2、4周期化疗后疗效关系[M(P25, P75)]
-
Spearman相关分析表明193例肺癌病人总生存期与NLR0、NLR4、PLR0、PLR2、PLR4、2周期疗效、4周期疗效呈负相关关系(P < 0.05~P < 0.01)(见表 2)。
变量 NLR0 NLR4 PLR0 PLR2 PLR4 生存期 -0.249** -0.199** -0.143* -0.212** -0.143* 2周期后疗效 -0.228** -0.069 -0.284** -0.286** -0.202** 4周期后疗效 -0.227** -0.440** -0.273** -0.184** -0.304** *P < 0.05,**P < 0.01 表 2 NLR、PLR与生存期及疗效间的相关分析(r)
-
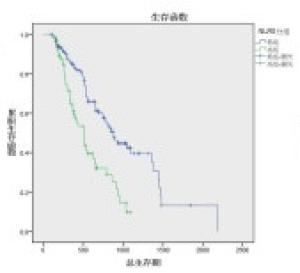
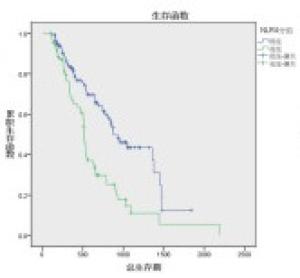
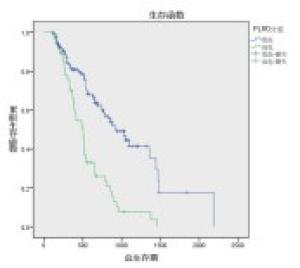
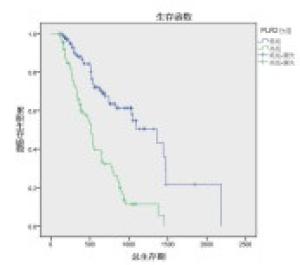
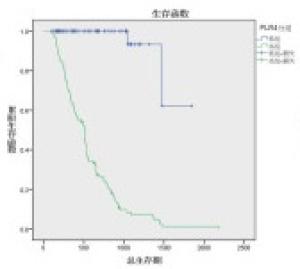
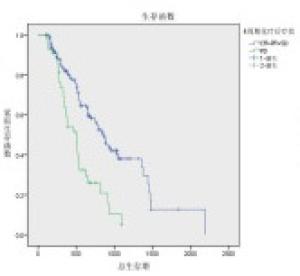
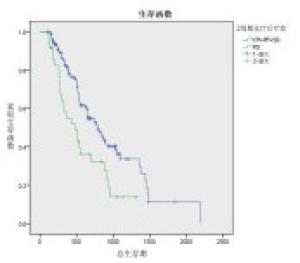
对NLR0、NLR4、PLR0、PLR2、PLR4、N分期、2周期疗效、4周期疗效进行单因素分析,发现除N分期外(P>0.05),NLR0、NLR4、PLR0、PLR2、PLR4对OS的影响均有统计学意义(P < 0.01)(见表 3),生存曲线见图 1~8。
分组 n 中位/平均生存期/d 95%CI Z P 下限 上限 N分期 N0 39 859 455.64 1 262.36 2.03 >0.05 N1+2+3 154 745 540.04 949.06 NLR0 ≥3.39 124 510 400.5 619.5 17.75 < 0.01 < 3.39 69 876 730.8 1 021.2 NLR4 ≥2.54 74 515 494.5 535.5 17.39 < 0.01 < 2.54 119 878 682.2 1 073.8 PLR0 ≥186.48 57 504 388.00 620.00 28.34 < 0.01 < 186.48 136 928 717.56 1 138.44 PLR2 ≥170.50 88 513 449.35 576.65 35.11 < 0.01 < 170.50 105 1 357 963.06 1 750.94 PLR4 ≥137.64 1076 558 485.49 631.62 93.92 < 0.01 < 137.64 86 1 673 1 469.72 1 896.94 2周期化疗后疗效 CR+PR+SD 155 792 274.44 687.56 8.93 < 0.01 PD 38 481 274.44 687.56 4周期化疗后疗效 CR+PR+SD 148 859 731.47 986.53 18.39 < 0.01 PD 15 504 349.82 658.18 表 3 影响193例肺癌病人Kaplan-Meier生存分析
-
在校正病人NLR0、NLR2、NLR4、PLR0、PLR2、PLR4、2周期化疗后疗效及4周期化疗后疗效等因素后,多因素分析表明,NLR0与PLR4是生存期的独立预测因素(P < 0.05和P < 0.01),而NLR4、PLR0、PLR2及2、4周期化疗疗效与生存期的关系无统计学意义(P>0.05)(见表 4)。
变量 B SE Waldχ2 P Exp(β) 95%CI NLR0 -0.529 0.25 4.32 < 0.05 0.589 0.358~0.970 NLR4 0.066 0.25 0.07 >0.05 1.068 0.651~1.752 PLR0 0.099 0.24 0.17 >0.05 1.104 0.687~1.774 PLR2 0.365 0.24 2.31 >0.05 0.695 0.434~1.111 PLR4 -3.738 0.73 26.49 < 0.01 0.024 0.006~0.099 2周期化疗疗效 0.048 0.27 0.03 >0.05 1.049 0.624~1.764 4周期化疗疗效 0.418 0.26 2.60 >0.05 1.520 0.914~2.527 表 4 影响193例肺腺癌病人预后的多因素分析
-
全身炎症反应和机体免疫系统与肿瘤的进展和预后有关。炎症反应可通过上调细胞因子、产生炎症介质、抑制细胞凋亡、促进血管生成、诱导DNA突变等促进肿瘤转移。细胞的侵袭性不仅与肿瘤细胞的本质特征有关,还取决于微环境。中性粒细胞、淋巴细胞、血小板作为肿瘤微环境中主要的炎症细胞,是肿瘤形成过程中不可或缺的参与者。
中性粒细胞是肿瘤微环境的重要组成部分[14],在肿瘤局部炎性炎症或抗菌防御过程中发挥着主要的作用[15]。中性粒细胞在血管生成过程中分泌促血管生成因子。它们通过表皮生长因子的蛋白水解物释放、转化生长因子β和血小板源生长因子直接影响肿瘤的进展[16-17]。此外,中性粒细胞具有影响其他肿瘤促进细胞如T淋巴细胞和NK细胞的能力[18]。淋巴细胞是抗肿瘤免疫反应的主要细胞,在肿瘤的发生、发展过程中发挥重要作用[19]。
NLR代表中性粒细胞和淋巴细胞之间的平衡状态。NLR越高,失衡状态越明显,即炎症反应越严重,免疫抑制越强。DERMAN等[20]发现,在139例接受化疗的晚期NSCLC病人中,NLR高水平和进行性增加与NSCLC病人更短OS有关,NLRs与总体生存率和病人体质量之间呈负相关关系。WANG等[21]认为NLR是预测OS(P < 0.01)和疾病特异性生存期(P < 0.05)较差的独立标记。本研究结果与以往关于NLR对NSCLC预后的影响以及高NLR与非小细胞肺癌病人有低OS的文献一致。我们不仅发现NLR0与OS呈负相关关系,NLR4与OS在本研究中也呈显著的相关性,但只有NLR0是OS的独立危险因素。研究证明了NLR的动态变化对晚期肺腺癌的预后也存在一定预测作用。但在本研究中,NLR2并没有显示出对病人OS的预测作用,一方面,传统观念认为化疗药物对骨髓增生有抑制作用,化疗后所有的血细胞均会出现不同程度下降,之后可逐渐恢复至正常,特别在化疗之初,机体对化疗药物较为敏感,炎症激活因子与炎症调节因子的平衡状态发生改变,对中性粒细胞、淋巴细胞细胞数量影响较大,导致对NLR2值在预测病人OS上有一定偏差。另一方面可能与本研究样本量小,病人仅局限于晚期肺腺癌病人有关。
PLR与NLR在预测癌症病人预后方面具有相似的作用。PLR升高导致预后不良的机制可能与肿瘤转移或肿瘤病人淋巴细胞减少及血小板计数增加有关。血小板在肿瘤进展中发挥重要作用,促进循环肿瘤细胞的黏附、包裹和定植。活化的血小板也会释放VEGF等细胞因子,激活血管生成,进而促进肿瘤生长[22-23]。PLR升高对预后的潜在影响已有大量研究,但结果并不一致。DIEM等[24]对52例经纳武单抗治疗的转移性非小细胞肺癌(NSCLC)病人进行研究后发现,治疗前NLR和PLR升高与较短的OS和无进展生存期(PFS)相关。SONG等[25]研究表明,高预处理PLR与较短的OS有关。QIANG等[26]对PLR与肺癌预后的关系进行了Meta分析表明,高PLR预示着OS和PFS较短,是影响NSCLC病人预后的独立危险因素。而部分研究却得出了不同的结果,KANG等[27-28]研究并未发现PLR对NSCLC预后存在意义。以往大量研究只局限于对治疗前PLR的观察,没有进一步探讨治疗后PLR的作用。我们利用PLR的动态变化去观察肺癌预后的作用,不仅发现治疗前后PLR均与肺腺癌病人OS有显著相关性,而且PLR4是肺腺癌病人预后的独立预测因素。这在对PLR与肺癌预后的研究上取得了新的进展。
以往的研究中,NLR、PLR对治疗疗效的评估是否有效存在异议。LIU等[29]研究表明,PLR可能是预测NSCLC一线化疗疗效和预后的潜在指标。YAO等[30]研究认为治疗前NLR <2.63有较好的化疗疗效,NLR(OR=2.043, P < 0.05)与一线化疗疗效相关。易福梅等[31]在68例NSCLC病人中做了与我们相似的研究,发现NLR0、一线化疗4周期后疗效、二线治疗状态是OS的独立预测因素,NLR2与一线化疗2周期和4周期的疗效显著相关。而我们的研究发现无论是2周期还是4周期,化疗后疗效评定为PD组的NLR、PLR水平都显著高于CR+PR+SD组,且除NLR4外,NLR0、NLR2、PLR0、PLR2、PLR4与化疗疗效均呈负相关关系,即NLR、PLR水平越高可能提示疗效不佳,进一步证明了NLR、PLR在肺腺癌病人中对化疗疗效的预测作用。
本研究也存在一定的局限性:(1)回顾性研究是在一个单一的机构进行的,无法控制潜在的混杂因素,且样本量偏小,存在选择性偏倚可能。(2)总随访时间不够长,部分病人没有达到OS。(3)不同的样本产生的NLR、PLR临界值不同,目前还没有统一的标准用来确定可以影响病人预后NLRJ及PLR临界值,仍需要进一步的研究来确定。
综上所述,NLR、PLR可预测经一线化疗的晚期肺腺癌病人疗效及预后,特别是NLR0、PLR4是预测晚期肺腺癌病人预后的理想指标,也是肺腺癌治疗潜在干预的靶点,但仍需要进一步大样本量的前瞻性临床研究进行验证。
动态监测NLR、PLR变化与晚期肺腺癌一线化疗疗效及预后关系
Relationship between dynamic monitoring NLR and PLR, and efficacy of first-line chemotherapy and prognosis of advanced lung adenocarcinoma
-
摘要:
目的探讨中性粒细胞淋巴细胞比率(NLR)及血小板淋巴细胞比率(PLR)的动态变化对晚期肺腺癌病人化疗疗效及生存期的预测价值。 方法回顾性分析193例经一线化疗的晚期肺腺癌病人病历资料,收集其化疗前、化疗2周期后及化疗4周期后的相关资料进行疗效评定,并分别计算NLR、PLR;分析NLR、PLR的动态变化与各种临床特征、一线化疗疗效及总生存期(OS)之间的关系。 结果NLR、PLR水平在化疗前及化疗后疾病进展组均高于完全缓解+部分缓解+疾病稳定组(P < 0.01);在化疗疗效方面,除NLR4(P>0.05)外,NLR0、NLR2、PLR0、PLR2、PLR4与2周期化疗疗效呈负相关关系(P < 0.05~P < 0.01);而NLR0、NLR2、NLR4、PLR0、PLR2、PLR4与4周期化疗疗效均呈负相关关系(P < 0.01);Kaplan-Meier生存分析表明,OS在不同NLR0、NLR4、PLR0、PLR2、PLR4、2周期化疗疗效及4周期化疗疗效中差异均有统计学意义(P < 0.01),且多因素分析表明,NLR0与PLR4是生存期的独立危险因素(P < 0.05和P < 0.01)。 结论NLR、PLR与一线化疗晚期肺腺癌疗效及生存密切相关,治疗前NLR与化疗4周后PLR是一线化疗晚期肺腺癌病人的独立预后因素。 -
关键词:
- 肺腺癌 /
- 总生存期 /
- 中性粒细胞淋巴细胞比率 /
- 血小板淋巴细胞比率
Abstract:ObjectiveTo investigate the predictive value of dynamic monitoring the neutrophil-to-lymphocyte ratio(NLR) and platelet-to-lymphocyte ratio(PLR) in the chemotherapeutic effects and lifetime of lung adenocarcinoma patients. MethodsThe clinical data of 193 advanced lung adenocarcinoma patients treated with first-line chemotherapy were retrospectively analyzed.The relevant data of patients before chemotherapy, after 2 and 4 cycles of chemotherapy were collected.The curative effects of patients were evaluated, and the NLR and PLR were calculated.The relationship between the dynamic changes of NLR and PLR, and various clinical features, first-line chemotherapy efficacy and overall survival(OS) were analyzed. ResultsThe levels of NLR and PLR in PD group before and after chemotherapy were higher than those in CR group, PR group and SD group(P < 0.01).In terms of the efficacy of chemotherapy, except for NLR4(P>0.05), the NLR0, NLR0, PLR0, PLR2 and PLR4 were negatively correlated with the efficacy of 2-cycle chemotherapy(P < 0.05 to P < 0.01).The NLR0, NLR2, NLR4, PLR0, PLR2 and PLR4 were negatively correlated with the efficacy of 4-cycle chemotherapy(P < 0.01).The results of Kaplan-Meier survival analysis showed that the OS was significantly correlated with the NLR0, NLR4, PLR0, PLR2, PLR4, efficacy of 2-cycle chemotherapy and efficacy of 4-cycle chemotherapy(P < 0.01).The results of multivariate analysis showed that the NLR0 and PLR4 were the independent risk factors of survival(P < 0.05 and P < 0.01). ConclusionsThe NLR and PLR are closely related to the efficacy and survival of first-line chemotherapy for advanced lung adenocarcinoma.The NLR before treatment and PLR after 4 cycle chemotherapy are the independent prognostic factors of advanced lung adenocarcinoma patients treated with first-line chemotherapy. -
表 1 NLR、PLR与2、4周期化疗后疗效关系[M(P25, P75)]
变量 2周期化疗后疗效 Z P 4周期化疗后疗效 Z P CR+PR+SD PD CR+PR+SD PD NLR0 2.69(1.95, 3.56) 4.27(2.07, 6.40) -3.16 < 0.01 2.70(1.89, 3.56) 3.70(2.40, 5.58) -3.14 < 0.01 NLR2 1.86(1.47, 2.49) 2.90(1.69, 5.75) -3.56 < 0.01 1.86(1.47, 2.52) 2.49(1.66, 4.94) -3.30 < 0.01 NLR4 1.79(1.26, 2.55) 3.50(2.67, 6.30) -6.10 < 0.01 PLR0 134.30(107.96, 179.89) 205.85(125.90, 322.95) -3.93 < 0.01 142.43(105.61, 185.08) 190.20(129.17, 277.88) -3.79 < 0.01 PLR2 151.92(122.35, 206.40) 243.87(152.59, 362.42) -3.96 < 0.01 153.02(123.45, 213.65) 184.62 (143.52, 331.43) -2.55 < 0.01 PLR4 137.64(100.00, 175.69) 215.09(136.20, 290.72) -4.21 < 0.01 表 2 NLR、PLR与生存期及疗效间的相关分析(r)
变量 NLR0 NLR4 PLR0 PLR2 PLR4 生存期 -0.249** -0.199** -0.143* -0.212** -0.143* 2周期后疗效 -0.228** -0.069 -0.284** -0.286** -0.202** 4周期后疗效 -0.227** -0.440** -0.273** -0.184** -0.304** *P < 0.05,**P < 0.01 表 3 影响193例肺癌病人Kaplan-Meier生存分析
分组 n 中位/平均生存期/d 95%CI Z P 下限 上限 N分期 N0 39 859 455.64 1 262.36 2.03 >0.05 N1+2+3 154 745 540.04 949.06 NLR0 ≥3.39 124 510 400.5 619.5 17.75 < 0.01 < 3.39 69 876 730.8 1 021.2 NLR4 ≥2.54 74 515 494.5 535.5 17.39 < 0.01 < 2.54 119 878 682.2 1 073.8 PLR0 ≥186.48 57 504 388.00 620.00 28.34 < 0.01 < 186.48 136 928 717.56 1 138.44 PLR2 ≥170.50 88 513 449.35 576.65 35.11 < 0.01 < 170.50 105 1 357 963.06 1 750.94 PLR4 ≥137.64 1076 558 485.49 631.62 93.92 < 0.01 < 137.64 86 1 673 1 469.72 1 896.94 2周期化疗后疗效 CR+PR+SD 155 792 274.44 687.56 8.93 < 0.01 PD 38 481 274.44 687.56 4周期化疗后疗效 CR+PR+SD 148 859 731.47 986.53 18.39 < 0.01 PD 15 504 349.82 658.18 表 4 影响193例肺腺癌病人预后的多因素分析
变量 B SE Waldχ2 P Exp(β) 95%CI NLR0 -0.529 0.25 4.32 < 0.05 0.589 0.358~0.970 NLR4 0.066 0.25 0.07 >0.05 1.068 0.651~1.752 PLR0 0.099 0.24 0.17 >0.05 1.104 0.687~1.774 PLR2 0.365 0.24 2.31 >0.05 0.695 0.434~1.111 PLR4 -3.738 0.73 26.49 < 0.01 0.024 0.006~0.099 2周期化疗疗效 0.048 0.27 0.03 >0.05 1.049 0.624~1.764 4周期化疗疗效 0.418 0.26 2.60 >0.05 1.520 0.914~2.527 -
[1] FOSSELLA F.Randomized, multinational, phase Ⅲ study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for advanced non-small-cell lung cancer:the tax 326 study group[J].J Clin Oncol, 2003, 21(16):3016. doi: 10.1200/JCO.2003.12.046 [2] SIEGEL RL, MILLER KD, JEMAL A.Cancer statistics, 2015[J].CACA J Clin, 2015, 65(1):5. doi: 10.3322/caac.21254 [3] SIEGEL RL, MILLER KD, JEMAL A.Cancer statistics, 2016[J].CACA J Clin, 2016, 66(1):7. doi: 10.3322/caac.21332 [4] MILLER KD, SIEGEL RL, LIN CC, et al.Cancer treatment and survivorship statistics, 2016[J].CA J Clin, 2016, 66(4):271. doi: 10.3322/caac.21349 [5] SARA SF, FERNANDES JR PAULO CéSAR, BARBOSA SILVA MARCELO JOSé, et al.The neutrophil-to-lymphocyte ratio:a narrative review[J].Ecancermedicalscience, 2016, 10:702. [6] MARCHIONI M, PRIMICERI G, INGROSSO M, et al.The clinical use of the neutrophil to lymphocyte ratio (nlr) in urothelial cancer:a systematic review[J].Clin Genitourin Cancer, 2016, 14(6):473. doi: 10.1016/j.clgc.2016.04.008 [7] MIYAMOTO R, INAGAWA S, SANO N, et al.Theneutrophil-to-lymphocyte ratio (NLR) predicts short-term and long-term outcomes in gastric cancer patients[J].Eur J Surg Oncol, 2018, 44(5):607. doi: 10.1016/j.ejso.2018.02.003 [8] KITANO Y, YAMASHITA YI, YAKAMURA K, et al.Effects of preoperative neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios on survival in patients with extrahepatic cholangiocarcinoma[J].Anticancer Res, 2017, 37(6):3229. [9] YANG HJ, JIANG JH, LIU QA, et al.Preoperative platelet-to-lymphocyte ratio is a valuable prognostic biomarker in patients with hepatocellular carcinoma undergoing curative liver resection[J].Tumour Biol, 2017, 39(6):1010428317707375. [10] YUAN C, LI N, MAO X, et al.Elevated pretreatment neutrophil/white blood cell ratio and monocyte/lymphocyte ratio predict poor survival in patients with curatively resected non-small cell lung cancer:Results from a large cohort[J].Thorac Cancer, 2017, 8(4):350. doi: 10.1111/1759-7714.12454 [11] IIMORI N, KASHIWAGI S, ASANO Y, et al.Clinical significance of the neutrophil-to-lymphocyte ratio in endocrine therapy for stage Ⅳ breast cancer[J].In Vivo, 2018, 32(3):669. [12] ZHANG J, ZHANG HY, LI J, et al.The elevated NLR, PLR and PLT may predict the prognosis of patients with colorectal cancer:a systematic review and meta-analysis[J].Oncotarget, 2017, 8(40):68837. doi: 10.18632/oncotarget.18575 [13] NISHINO M, JACKMAN DM, HATABU H, et al.New Response Evaluation Criteria in Solid Tumors (RECIST) guidelines for advanced non small cell lung cancer:comparison with original RECIST and impact on assessment of tumor response to targeted therapy[J].AJR Am J Roentgenol, 2010, 195(3):W221. doi: 10.2214/AJR.09.3928 [14] 张文, 张鹏, 徐雪莹, 等.中性粒细胞在肿瘤中作用的研究进展[J].肿瘤, 2017, 37(1):96. doi: 10.3969/j.issn.1672-4992.2017.01.026 [15] COFFELT SB, WELLENSTEIN MD, DE VISSER KE.Neutrophils in cancer:neutral nomore[J].Nat Rev Cancer, 2016, 16(7):431. doi: 10.1038/nrc.2016.52 [16] YAN W, XU H, WENYING X.Prognostic value of a novel scoring system using inflflammatory response biomarkers in non-small cell lung cancer:a retrospective study[J].Thorac Cancer, 2019, 10(6):1402. doi: 10.1111/1759-7714.13085 [17] VAN EGMOND M.BAKEMA JE.Neutrophils as effector cells for antibody-based immunotherapy of cancer[J].Semin Cancer Biol, 2013, 23(3):190. doi: 10.1016/j.semcancer.2012.12.002 [18] JIN H, ZHANG G, LIU X, et al.Blood neutrophil-lymphocyte ratio predicts survival for stages Ⅲ-Ⅳ gastric cancer treated with neoadjuvant chemotherapy[J].World J Surg Oncol, 2013, 11(1):12. doi: 10.1186/1477-7819-11-12 [19] BANAT GA, TRETYN A, PULLAMSETTI SS, et al.Immune and inflammatory cell composition of human lung cancer stroma[J].PLos One, 2015, 10(9):e0139073. doi: 10.1371/journal.pone.0139073 [20] DERMAN BA, MACKLIS JN, AZEEM MS, et al.Relationships between longitudinal neutrophil to lymphocyte ratios, body weight changes, and overall survival in patients with non-small cell lung cancer[J].BMC Cancer, 2017, 17(1):141. doi: 10.1186/s12885-017-3122-y [21] WANG J, KALHOR N, HU J, et al.Pretreatment neutrophil to lymphocyte ratio is associated with poor survival in patients with stage i-iii non-small cell lung cancer[J].PLoS One, 2016, 11(10):e0163397. doi: 10.1371/journal.pone.0163397 [22] BAMBACE NM, HOLMES CE.The platelet contribution to cancer progression[J].J Thromb Haemost, 2011, 9(2):237. doi: 10.1111/j.1538-7836.2010.04131.x [23] MORIMOTO K, SATOH-YAMAGUCHI K, HAMAGUCHI A, et al.Interaction of cancer cells with platelets mediated by Necl-5/poliovirus receptor enhances cancer cell metastasis to the lungs[J].Oncogene, 2008, 27(3):264. doi: 10.1038/sj.onc.1210645 [24] DIEM S, SCHMID S, KRAPF M, et al.Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio (PLR) as prognostic markers in patients with non-small cell lung cancer (NSCLC) treated with nivolumab[J].Lung Cancer, 2017, 111:176. doi: 10.1016/j.lungcan.2017.07.024 [25] SONG XY, CHEN DW, MA Y, et al.Total lymphocyte count, neutrophil-lymphocyte ratio, and platelet-lymphocyte ratio as prognostic factors in advanced non-small cell lung cancer with chemoradiotherapy[J].Cancer Manag Res, 2018, 10:6677. doi: 10.2147/CMAR.S188578 [26] QIANG G, LIANG C, XIAO F, et al.Prognostic significance of platelet-to-lymphocyte ratio in non-small-cell lung cancer:a meta-analysis[J].Onco Targets Ther, 2016, 9:869. [27] KANG KH, EFIRD JT, SHARMA N, et al.Prognostic potential of neutrophil-to-lymphocyte ratio and lymphocyte nadir in stage Ⅲ non-small-cell lung cancer[J].Future Oncol, 2017, 13(16):1405. doi: 10.2217/fon-2017-0045 [28] PINATO DJ, SHINER RJ, SECKL MJ, et al.Prognostic performance of inflammation-based prognostic indices in primary operable non-small cell lung cancer[J].Br J Cancer, 2014, 110(8):1930. doi: 10.1038/bjc.2014.145 [29] LIU HB, WU Y, WANG ZF, et al.Pretreatment platelet-to-lymphocyte ratio (PLR) as a predictor of response to first-line platinum-based chemotherapy and prognosis for patients with non-small cell lung cancer[J].J Thorac Dis, 2013, 5(6):783. [30] YAO Y, YUAN D, LIU H, et al.Pretreatment neutrophil to lymphocyte ratio is associated with response to therapy and prognosis of advanced non-small cell lung cancer patients treated with first-line platinum-based chemotherapy[J].Cancer Immunol Immunother, 2013, 62(3):471. doi: 10.1007/s00262-012-1347-9 [31] 易福梅, 顾阳春, 陈森, 等.治疗前后NLR和PLR对进展期非小细胞肺癌一线化疗疗效及预后的预测价值[J].中国肺癌杂志, 2018, 21(6):481. -





 下载:
下载: