-
年轻恒牙在发育过程中,常由于各种有害刺激、解剖变异等导致牙髓暴露,牙根发育受限[1]。相对于牙髓治疗,以替代或修复病损区细胞为主的干细胞疗法成为一种理想的治疗方案[2]。根尖牙乳头干细胞(stem cells from the apical papilla, SCAP)是生长在恒牙牙乳头内的新型干细胞群体,该细胞具有集落形成、自我更新、多分化及抗感染的优越性,是牙根牙本质再生的种子细胞[3]。当牙髓炎及根尖炎发生时,炎性环境及炎性因子的存在致使牙根发育停止,SCAP介导的牙本质再生功能受限,表明炎性因子可以影响SCAP的特性[4]。
白细胞介素-34(interleukin-34,IL-34)是一种具有复杂生物学特性的炎性因子,它可以刺激破骨细胞的产生,导致炎症区域的骨吸收[5]。研究[6]发现IL-34在牙周炎和种植体周围炎中高表达,参与牙周组织破坏过程;另有研究[7]发现IL-34在慢性根尖周病损组织中高表达,参与根尖炎症反应过程,但炎性环境中的IL-34是否作用于SCAP,尚鲜见研究报道。本研究通过不同浓度的IL-34作用于SCAP, 探究IL-34对SCAP增殖能力的影响,从而进一步了解炎性坏境中SCAP特性的改变,为临床治疗年轻恒牙牙髓炎、根尖炎提供理论依据。
-
青链霉素混合液,高糖培养基DMEM、胎牛血清FBS(美国Gibco);IL-34(上海沪震);CD24单克隆抗体(美国BD);茜素红染液(美国sigma);MTT(德国BioFROXX);流式细胞仪(美国BD-FACSVerse);细胞培养箱(美国Thermo Scientific 8000);光学显微镜、倒置拍照显微镜(德国莱卡),低速离心机(上海卢湘仪),酶标检测仪(美国MDC)。
-
经蚌埠医学院伦理委员会批准,取2只2~3周龄的SD大鼠,水合氯醛麻醉致死,将根尖牙乳头组织从根尖分离,PBS清洗后,无菌剪刀剪碎,置于3mg/mL的胶原酶和4mg/mL的dispase酶中,37℃的环境下消化30min,在含有20%FBS的DMEM培养基中生长到70%的融合率,按1:3的比例用酶消化法传代。
-
CD24是SCAP的特征性标志物,在SCAP中优先表达,而在其他间充质干细胞中不表达[8]。故本研究收集第3代SCAP,计数并调整细胞密度为107个/毫升,离心,沉淀后,加入含CD24的100μL的染色缓冲液,对应孔加入含IgM的100μL的染色缓冲液, 放置4 ℃冰箱避光孵育30 min。洗涤、重悬细胞后,流式细胞术定量检测。
-
取第3代SCAP,以5×104个/孔接种到12孔板中,以FBS为10%的DMEM培养细胞。待细胞融合率达到70%时,更换成骨诱导液。成骨诱导2周后,茜素红染色。
-
调整SCAP密度为2×103个/孔,随机分为对照组和实验组6组,分别接种至96孔细胞培养板,每孔液体体积200μL,待细胞贴壁后饥饿24h,实验组加入含IL-34的培养液,浓度分别为25、50、100、200、400、600ng/mL,每个浓度梯度3个复孔。在细胞培养的第1、3、5、7、9天,酶标仪492 nm波长测出同一时间点吸光度值,实验重复3次。
-
采用方差分析和q检验。
-
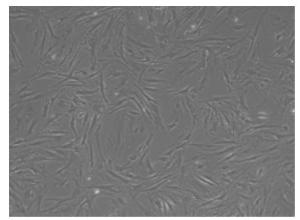
分离出的大鼠根尖牙乳头呈条索状,原发性SCAP在培养5~7d后呈现典型的细胞集落,显微镜下大部分SCAP呈梭形(见图 1)。
-
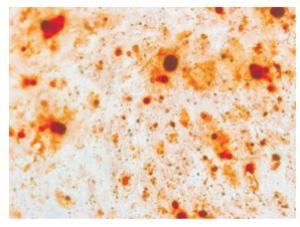
流式细胞仪结果显示,第3代SCAP表达CD24为90.7%,呈阳性表达(见图 2)。成骨诱导液诱导2周后,茜素红染色,镜下见钙盐沉积(见图 3)。
-
通过MTT实验测得各组不同时间细胞吸光度值,结果显示,第1天600ng/mL组低于对照组;第3天50ng/mL组和100ng/mL组高于对照组,400ng/mL组和600ng/mL组低于对照组;第5天和第7天25ng/mL组、50ng/mL组和100ng/mL组高于对照组,400ng/mL组和600ng/mL组低于对照组;第9天25ng/mL组、50ng/mL组和100ng/mL组高于对照组,200ng/mL组、400ng/mL组和600ng/mL组低于对照组,差异均有统计学意义(P < 0.05)。说明25ng/mL、50ng/mL、100ng/mL3组浓度的IL-34对SCAP增殖能力具有促进作用,其中50ng/mL实验组对SCAP增殖作用最显著,达到峰值;200ng/mL、400ng/mL、600ng/mL 3组浓度的IL-34抑制SCAP的增殖能力,尤以600ng/m L实验组对SCAP的抑制作用最显著(见表 1)。
分组 n 第1天 第3天 第5天 第7天 第9天 对照组 3 0.453±0.020 0.599±0.015 0.871±0.018 1.210±0.053 1.717±0.063 25ng/mL 3 0.446±0.021 0.608±0.020 1.167±0.033* 1.572±0.040* 1.763±0.004* 50ng/mL 3 0.459±0.014 0.621±0.008* 1.240±0.022* 1.652±0.045* 1.875±0.001* 100ng/mL 3 0.465±0.025 0.618±0.003* 0.969±0.008* 1.334±0.037* 1.732±0.032* 200ng/mL 3 0.441±0.015 0.582±0.015 0.857±0.016 1.168±0.028 1.693±0.065* 400ng/mL 3 0.424±0.017 0.572±0.015* 0.813±0.011* 1.133±0.028* 1.578±0.018* 600ng/mL 3 0.385±0.009* 0.489±0.012* 0.714±0.010* 0.907±0.020* 1.394±0.009* F — 6.78 34.42 311.48 145.28 51.300 P — < 0.01 < 0.01 < 0.01 < 0.01 0.006 MS组内 — 0.000 0.000 0.000 0.000 0.000 q检验:与对照组比较*P < 0.05 表 1 不同浓度IL-34各组吸光度值比较(x±s)
-
在未发育完全的牙齿中,根尖牙乳头代表着一个丰富的干细胞池,其中存在的SCAP作为一种外间充质细胞,在牙髓完全丧失的情况下,可以迁移到髓腔,促进牙髓再生[9],且该细胞来源于早期成牙本质细胞,有效促进牙根再生[10]。研究[3, 11]发现,与其他干细胞相比,SCAP具有快速增殖、诱导生物迁移和矿化的能力,然而SCAP的特性却受到炎性环境等因素影响, TOBIAS DUARTE等[12]研究了牙髓感染后根尖牙乳头的组织学状况,发现牙髓暴露后,炎性因子的释放导致根尖牙乳头组织紊乱,SCAP活力降低。IL-34是2008年发现的新型炎性因子,该因子在牙周膜细胞、牙龈成纤维细胞中均有表达[13-14],并在根尖周炎症组织中高表达,因此探讨IL-34对SCAP增殖能力的影响对临床具有重要的指导意义。
本研究通过MTT实验发现低浓度的IL-34对SCAP增殖能力具有显著的促进作用,其中50ng/mL的IL-34对SCAP增殖的促进作用最显著,SÉGALINY等[15]研究了IL-34对集落形成样内皮前体细胞(ECFCs)的影响,发现IL-34可有效促进ECFCs增殖,最佳增殖浓度为50ng/mL。这与本实验研究结果一致,提示50ng/mL的IL-34可能为细胞增殖的最佳浓度。
IL-34在病理生理状态下具有潜在致病性[16],BATRA等[17]研究发现IL-34在慢性牙周炎和侵袭性牙周炎病人的龈沟液中高表达,HWANG等[18]也发现IL-34在类风湿关节炎病人的滑膜组织和滑液中高表达,并与滑膜炎的严重程度有关。本研究发现随着IL-34浓度的增加,其对SCAP的增殖作用逐渐减弱,并在浓度达到200 ng/mL时抑制SACP的增殖,且浓度越高,抑制作用越强。
IL-34作为根尖炎性环境中的促炎因子之一,与炎性因子肿瘤坏死因子α(TNF-α)关系密切。在类风湿性关节炎病人的滑膜组织中,IL-34作为TNF-α的下游效应因子调节巨噬细胞的增殖和分化,导致炎症和骨侵蚀[18]。在干燥综合征中,IL-34与TNF-α的表达呈正相关[19]。LIU等[20]曾研究TNF-α对SCAP增殖能力的影响,发现10ng/mL的TNF-α对SCAP的增殖作用显著增强。YANG等[21]也发现10ng/mL的TNF-α可以提高SCAP的增殖潜能。本研究结果与前述研究相似,发现低浓度的炎性因子IL-34促进SCAP增殖,提示在炎症的早期阶段,IL-34可能是干细胞抵御外界刺激的屏障之一,然而IL-34在低浓度时对SCAP增殖能力的促进作用是否与TNF-α有关,还需进一步研究。
综上所述,本研究表明炎性因子IL-34对SCAP的增殖能力有一定的影响,为临床治疗年轻恒牙牙髓炎、根尖周炎提供一定的指导意义,但其发生的具体机制,还需后续实验进一步研究。
白细胞介素34对大鼠根尖牙乳头干细胞增殖的影响
Effect of interleukin-34 on the proliferation of rat stem cells from the apical papilla
-
摘要:
目的探究炎性因子白细胞介素34(interleukin-34,IL-34)对大鼠根尖牙乳头干细胞(stem cells from rat apical papilla,SCAP)增殖的影响。 方法采用酶消化法分离培养大鼠根尖牙乳头干细胞,流式细胞仪鉴定SCAP表面标记分子,茜素红染色鉴定SCAP成骨分化潜能。将细胞分为实验组(含有不同浓度IL-34的细胞培养液)和对照组(不含IL-34的细胞培养液),四甲基偶氮唑蓝(MTT)实验检测IL-34对SCAP增殖能力的影响。 结果MTT实验结果显示,25 ng/mL、50 ng/mL、100 ng/mL IL-34实验组促进SCAP增殖,尤以50 ng/mL IL-34实验组对SCAP增殖的促进作用最显著,而200 ng/mL、400 ng/mL、600 ng/mL IL-34实验组则抑制SCAP增殖。 结论IL-34对SCAP的增殖有一定的调节作用,低浓度的IL-34促进SCAP增殖,高浓度的IL-34抑制SCAP增殖。 Abstract:ObjectiveTo investigate the effects of interleukin-34(IL-34)on the proliferation of rat stem cells from the apical papilla(SCAP). MethodsThe rat SCAP were isolated and cultured using enzyme digestion method.The surface marking molecules of SCAP were identified using flow cytometry, and the Alizarin red staining was used to identify the osteogenic potential of SCAP.The cells were divided into the experimental group(cell culture medium with different concentrations of IL-34)and control group(cell culture medium without IL-34).The effects of IL-34 on the proliferation of SCAP were detected using MTT assay. ResultsThe results of MTT assay showed that the proliferation of SCAP was promoted at the concentration of 25 ng/mL, 50 ng/mL and 100 ng/mL of IL-34, especially the 50 ng/mL of IL-34.The proliferation of SCAP was inhibited at the concentration of 200 ng/mL, 400 ng/mL and 600 ng/mL of IL-34. ConclusionsIL-34 can regulate the proliferation of SCAP.The low concentration of IL-34 can promote the proliferation of SCAP, while the high concentration of IL-34 can inhibit the proliferation of SCAP. -
Key words:
- stem cells from the apical papilla /
- interleukin-34 /
- proliferation /
- rat
-
表 1 不同浓度IL-34各组吸光度值比较(x±s)
分组 n 第1天 第3天 第5天 第7天 第9天 对照组 3 0.453±0.020 0.599±0.015 0.871±0.018 1.210±0.053 1.717±0.063 25ng/mL 3 0.446±0.021 0.608±0.020 1.167±0.033* 1.572±0.040* 1.763±0.004* 50ng/mL 3 0.459±0.014 0.621±0.008* 1.240±0.022* 1.652±0.045* 1.875±0.001* 100ng/mL 3 0.465±0.025 0.618±0.003* 0.969±0.008* 1.334±0.037* 1.732±0.032* 200ng/mL 3 0.441±0.015 0.582±0.015 0.857±0.016 1.168±0.028 1.693±0.065* 400ng/mL 3 0.424±0.017 0.572±0.015* 0.813±0.011* 1.133±0.028* 1.578±0.018* 600ng/mL 3 0.385±0.009* 0.489±0.012* 0.714±0.010* 0.907±0.020* 1.394±0.009* F — 6.78 34.42 311.48 145.28 51.300 P — < 0.01 < 0.01 < 0.01 < 0.01 0.006 MS组内 — 0.000 0.000 0.000 0.000 0.000 q检验:与对照组比较*P < 0.05 -
[1] LIN LM, RICUCCI D, SAOUD TM, et al.Vital pulp therapy of mature permanent teeth with irreversible pulpitis from the perspective of pulp biology[J].Aust Endod J, 2020, 46(1):154. doi: 10.1111/aej.12392 [2] BANIEBRAHIMI G, KHANMOHAMMADI R, MIR F.Teeth-derived stem cells:a source for cell therapy[J].Cell Physiol, 2019;234(3):2426. doi: 10.1002/jcp.27270 [3] NADA OA, EL BACKLY RM.Stem Cells From the Apical Papilla(SCAP)as a Tool for Endogenous Tissue Regeneration[J].Front Bioeng Biotechnol, 2018, 6:103. doi: 10.3389/fbioe.2018.00103 [4] HENRIQUES LC, DE BRITO LC, TAVARES WL, et al.Cytokine analysis in lesions refractory to endodontic treatment[J].J Endod, 2011, 37(12):1659. doi: 10.1016/j.joen.2011.08.007 [5] BAGHDADI M, UMEYAMA Y, HAMA N, et al.Interleukin-34, a comprehensive review[J].Leukoc Biol, 2018, 104(5):931. doi: 10.1002/JLB.MR1117-457R [6] 孙志新, 王小亮, 张新莲, 等.IL-34在牙周炎和种植体周围炎牙龈组织中的表达及临床意义[J].全科口腔医学杂志, 2019, 6(3):123. doi: 10.3969/j.issn.2095-7882.2019.03.091 [7] 马楠, 曲柳, 徐莉雅, 等.IL-34在慢性根尖周病损组织中的表达及临床意义[J].上海口腔医学, 2016, 25(1):53. [8] SONOYAMA W, LIU Y, FANG D, et al.Mesenchymal stem cell-mediated functional tooth regeneration in swine[J].PLoS One, 2006, 1(1):e79. doi: 10.1371/journal.pone.0000079 [9] 马学娟, 刘雪梅, 毕静, 等.根尖牙乳头干细胞细胞膜片构建及其成骨/成牙本质分化性能研究[J].上海口腔医学, 2018, 27(2):123. [10] BAKOPOULOU A, LEYHAUSEN G, VOLK J, et al.Comparative analysis of in vitro osteo/odontogenic differentiation potential of human dental pulp stem cells(DPSCs)and stem cells from the apical papilla(SCAP)[J].Arch Oral Biol, 2011, 56(7):709. doi: 10.1016/j.archoralbio.2010.12.008 [11] HU L, LIU Y, WANG S.Stem cell-based tooth and periodontal regeneration[J].Oral Dis, 2018, 24(5):696. doi: 10.1111/odi.12703 [12] TOBIAS DUARTE PC, GOMES-FILHO JE, ERVOLINO E, et al.Histopathological condition of the remaining tissues after endodontic infection of rat immature teeth[J].J Endod, 2014, 40(4):538. doi: 10.1016/j.joen.2013.09.015 [13] KAWABE M, OHYAMA H, KATO-KOGOE N, et al.Expression of interleukin-34 and colony stimulating factor-1 in the stimulated periodontal ligament cells with tumor necrosis factor-α[J].Med Mol Morphol, 2015, 48(3):169. doi: 10.1007/s00795-014-0094-8 [14] BOSTRÖM EA, LUNDBERG P.The newly discovered cytokine IL-34 is expressed in gingival fibroblasts, shows enhanced expression by pro-inflammatory cytokines, and stimulates osteoclast differentiationh[J].PLoS One, 2013, 8(12):e81665. doi: 10.1371/journal.pone.0081665 [15] SÉGALINY AI, MOHAMADI A, DIZIER B, et al.Interleukin-34 promotes tumor progression and metastatic process in osteosarcoma through induction of angiogenesis and macrophage recruitment[J].Int J Cancer, 2015, 137(1):73. doi: 10.1002/ijc.29376 [16] GUILLONNEAU C, BÉZIE S, ANEGON I.Immunoregulatory properties of the cytokine IL-34[J].Cell Mol Life Sci, 2017, 74(14):2569. doi: 10.1007/s00018-017-2482-4 [17] BATRA P, DAS S, PATEL P.Comparative evaluation of Gingival Crevicular Fluid(GCF)levels of Interleukin-34 levels in periodontally healthy and in patients with chronic and aggressive periodontitis- A cross-sectional study[J].Saudi Dent J, 2019, 31(3):316. doi: 10.1016/j.sdentj.2019.03.010 [18] HWANG SJ, CHOI B, KANG SS, et al.Interleukin-34 produced by human fibroblast-like synovial cells in rheumatoid arthritis supports osteoclastogenesis[J].Arthritis Res Ther, 2012, 14(1):R14. doi: 10.1186/ar3693 [19] CICCIA F, ALESSANDRO R, RODOLICO V, et al.IL-34 is overexpressed in the inflamed salivary glands of patients with Sjogren's syndrome and is associated with the local expansion of pro-inflammatory CD14(bright)CD16+ monocytes[J].Rheumatology(Oxford), 2013, 52(6):1009. doi: 10.1093/rheumatology/kes435 [20] LIU C, XIONG H, CHEN K, et al.Long-term exposure to pro-inflammatory cytokines inhibits the osteogenic/dentinogenic differentiation of stem cells from the apical papilla[J].Int Endod J, 2016, 49(10):950. doi: 10.1111/iej.12551 [21] YANG H, MA L, HAN X, et al.The effects of tumor necrosis factor-a on minerlization of human dental apical cells[J].J Endod, 2012, 38(7):960. doi: 10.1016/j.joen.2012.04.005 -




 下载:
下载: