-
哮喘是一种常见慢性呼吸道疾病,影响各年龄段人群的健康,是世界性的医学难题。哮喘的特征是喘息、胸闷、气短和咳嗽以及可逆性发作[1]。全球哮喘病人已多达3亿左右,在我国哮喘的发生率呈快速上升的趋势[2]。流行病学调查显示,我国哮喘病人在3 000万以上,儿童期病人大约占其中的一半,哮喘严重危害了儿童的身体健康。哮喘的病变过程有多种细胞参与,如嗜酸性粒细胞、中性粒细胞、肥大细胞、T淋巴细胞等,而Th1/Th2的失衡是哮喘慢性气道炎症发病的重要病理机制之一[3]。白细胞介素-4(IL-4)是Ⅱ型辅助T细胞(Th2)、嗜碱性粒细胞和肥大细胞分泌的特征性细胞因子之一,在大多数哮喘病人中,Th2相关细胞因子如IL-4、IL-5和IL-13的水平非常高。而Th2相关细胞因子受GATA结合蛋白3(GATA-3)的调节。有研究[4]表明,GATA-3能促使正在分化或已分化的Th细胞合成Th2细胞因子,导致Th2优势应答,进而调控释放如IL-4促炎因子,加重气道炎症反应。
山茶油从山茶科油茶树种子中获得,其中油酸含量80%以上。近年来的研究[5-6]表明,山茶油具有改善心脑血管疾病、抑制乳腺癌细胞的增殖与迁移、抗氧化、抗溃疡等生物活性。此外,有报道[7-9]指出,山茶油的主要成分油酸和共轭亚油酸等不饱和脂肪酸可通过清除自由基,缓解氧化应激反应,从而减缓多种物质引起的中毒反应。而关于山茶油在哮喘方面的作用研究尚鲜有报道。本研究观察山茶油对哮喘患儿的外周血单个核细胞(PBMCs)中Th2相关细胞因子IL-4分泌和GATA-3表达的影响,探讨山茶油在哮喘中的作用,以期为治疗哮喘的天然产品药物开发奠定基础。
-
选取2018年5-12月我院儿科收治的28例未治疗的过敏性哮喘患儿,其中男18例,女10例,年龄3~8岁。患儿的哮喘诊断符合国际哮喘指南[10]。所有研究对象的监护人签订知情同意书,本研究获得本院伦理委员会审批通过。
-
山茶油购自江西瑞金生物科技有限公司,L-谷氨酰胺、4-羟乙基哌嗪乙磺酸(HEPES)、青霉素、链霉素和β-巯基乙醇购自美国HyClone公司,RPMI-1640培养基和二甲基亚砜(DMSO)购自美国Sigma公司,兔抗人GATA3多克隆抗体、兔抗人GAPDH多克隆抗体和山羊抗兔IgG抗体购于美国Millipore公司,Trizol试剂盒、Prime ScriptTM RT试剂盒和TB GreenTM Premix Ex Taq Ⅱ试剂盒购自日本TaKaRa公司。
-
从未接受任何治疗的过敏性哮喘患儿静脉采血5 mL,获得肝素化血液,采用密度梯度离心法分离PBMCs。操作步骤:在肝素化血液中注入肝素溶液(每1 mL全血加0.1 mL 125~250 U/mL肝素溶液),使血液抗凝;加入等体积的HBSS稀释血液,将稀释血液缓慢加至淋巴细胞分离液上面(每10 mL稀释血加5 mL分层液);以2 000 r/min在室温下离心20 min;去除上层液体,将所得到的PBMCs悬液用5倍体积的HBSS洗涤2次,依次以2 000 r/min、1 500 r/min在室温下离心10 min,弃上清液;将细胞重新悬浮于RPMI-1640培养基中,补充有10%胎牛血清、2 mmol/LL-谷氨酰胺、10 mmol/L HEPES、100 U/mL青霉素、100 U/mL链霉素和5.78×10-5mol/L β-巯基乙醇。
-
将PBMCs浓度调整为1×106个/毫升,取100 μL接种于24孔板内。对照组细胞不用山茶油处理(即浓度为0 μmol/L),只加入RPMI-1640培养基培养;DMSO组细胞使用含0.5% DMSO的RPMI-1640培养基培养;实验组根据实验设计加入山茶油:将1 mg山茶油用含0.5% DMSO的RPMI-1640培养基充分溶解,随后稀释为不同浓度(10、50、100、200 μmol/L)作用于PBMCs,在37℃,5% CO2培养箱中培养24 h,用于后续实验。
-
取各处理组的PBMCs,去除培养基,用PBS洗涤1次,每孔加入20 μL用无血清培养基稀释的0.5%MTT混合均匀,于37 ℃、5%CO2培养箱中培养4 h后,弃去培养液,每孔加入150 μL DMSO,振荡至结晶物完全溶解,采用酶标仪检测OD570nm。每组设置3个复孔,实验重复3次。
-
收集各处理组的PBMCs培养液,用ELISA法检测IL-4分泌的水平。将待测样品加入96孔板内,在37℃下孵育2 h,去除板内液体,PBS洗涤4~6次,用滤纸印干;每孔加入一抗工作液,37℃孵育1 h,去除板内液体,再次洗涤4~6次后滤纸印干;每孔加羊抗兔IgG工作液,置37℃孵育1 h,洗板4~6次后印干;每孔加入底物工作液,置37℃暗处反应10 min,加入终止液,酶标仪检测OD490nm。
-
按Trizol试剂盒说明书提取各处理组PBMCs总RNA,按Prime ScriptTM RT试剂盒说明书进行逆转录合成cDNA。以人GAPDH为内参基因,通过荧光实时定量PCR检测IL-4 mRNA和GATA-3 mRNA表达。IL-4上游引物为:5′-ACA GGA GAA GGG ACG CCA T-3′,IL-4下游引物为:5′-GAA GCC CTA CAG ACG AGC TCA-3′;GATA-3上游引物为:5′-GAGA TGG CAC GGG ACA CTA C-3′,下游引物为:5′-GCC TTC GCT TGG GCT TAA TG-3′;GAPDH上游引物为:5′-GGT GTG AAC CAT GAG AAG TAT GAC A-3′,下游引物为:5′-GTC CTT CCA CGA TAC AAA GTT GT-3′。按照TB GreenTM Premix Ex Taq Ⅱ试剂盒说明书操作,反应体系为:上游引物1 μL、下游引物1 μL、cDNA 2 μL、TB GreenTM Premix Ex TaqTMⅡ 12.5 μL、无酶水8.5 μL。反应条件为:95℃ 3 min、95℃ 30 s、58℃ 30 s、58℃ 30 s,40个循环。采用2-ΔΔCt法计算mRNA表达水平。
-
使用RIPA裂解液抽提各组PBMCs总蛋白,BCA法测定蛋白浓度。SDS-PAGE电泳分离蛋白,切胶并转移至PVDF膜,5%脱脂奶粉室温封闭4 h。分别加兔抗人GATA3多克隆抗体(1:300)、兔抗人GAPDH多克隆抗体(1:2 000),4℃孵育过夜;辣根过氧化物酶标记的山羊抗兔IgG(1:5 000),室温孵育2 h;采用ECL发光显影,使用Image-Pro Plus 6.0分析蛋白质灰度值。
-
采用方差分析和q检验。
-
DMSO组细胞存活率与对照组差异无统计学意义(P>0.05);与对照组比较,10、50、100 μmol/L山茶油对PBMCs活力无明显影响(P>0.05),200 μmol/L山茶油能明显降低PBMCs活力(P < 0.01)(见表 1)。
分组 n 存活率/% 对照组 3 100.51±2.59 DMSO组 3 99.58±1.34 10 μmol/L山茶油组 3 99.61±1.53 50 μmol/L山茶油组 3 99.71±1.47 100 μmol/L山茶油组 3 98.85±2.59 200 μmol/L山茶油组 3 76.41±0.95**##▲▲■■++ F — 78.85 P — < 0.01 MS组内 — 3.436 q检验:与对照组比较**P < 0.01;与DMSO组比较##P < 0.01;与10 μmol/L山茶油组比较▲▲P < 0.01;与50 μmol/L山茶油组比较■■P < 0.01;与100 μmol/L山茶油组比较++P < 0.01 表 1 山茶油对PBMCs存活率的影响(x±s)
-
PBMCs IL-4分泌水平呈现先下降后略有上升的趋势。与对照组比较,不同浓度山茶油处理PBMCs后,IL-4分泌水平均明显降低(P < 0.01);当山茶油浓度为50 μmol/L时,IL-4分泌水平最低(P < 0.01)(见表 2)。
分组 n 含量/(pg/mL) 对照组 3 160.05±4.55 10 μmol/L山茶油组 3 90.08±3.52** 50 μmol/L山茶油组 3 82.27±1.43**▲▲ 100 μmol/L山茶油组 3 98.66±5.23**▲▲■■ 200 μmol/L山茶油组 3 125.48±7.45**▲▲■■++ F — 128.10 P — < 0.01 MS组内 — 23.599 q检验:与对照组比较**P < 0.01;与10 μmol/L山茶油组比较▲▲P < 0.01;与50 μmol/L山茶油组比较■■P < 0.01;与100 μmol/L山茶油组比较++P < 0.01 表 2 山茶油对PBMCs分泌IL-4的影响(x±s)
-
与对照组比较,10、50、100、200 μmol/L山茶油处理PBMCs后,GATA-3 mRNA和IL-4 mRNA的表达均被明显抑制(P < 0.05),在50 μmol/L处理后,GATA-3与IL-4的mRNA表达量最低(P < 0.05)(见表 3)。
分组 n GATA-3 IL-4 对照组 3 0.80±0.05 0.88±0.09 10 μmol/L山茶油组 3 0.32±0.03* 0.48±0.02* 50 μmol/L山茶油组 3 0.40±0.02*▲ 0.50±0.03* 100 μmol/L山茶油组 3 0.46±0.03*■ 0.56±0.03*▲ 200 μmol/L山茶油组 3 0.62±0.05*▲■+ 0.64±0.04*▲■+ F — 76.25 33.18 P — < 0.01 < 0.01 MS组内 — 0.001 0.002 q检验:与对照组比较*P < 0.05;与10 μmol/L山茶油组比较▲P < 0.05;与50 μmol/L山茶油组比较■P < 0.05;与100 μmol/L山茶油组比较+P < 0.05 表 3 山茶油对PBMCs中GATA-3、IL-4 mRNA表达的影响(x±s)
-
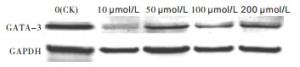
与对照组比较,10、50、100、200 μmol/L山油茶处理PBMCs后GATA-3蛋白表达均降低(P < 0.05),当山茶油浓度为10 μmol/L时,GATA-3蛋白的表达量达到最低水平(P < 0.05)(见图 1、表 4)。
分组 n GATA-3 对照组 3 1.92±0.39 10 μmol/L山茶油组 3 0.38±0.32* 50 μmol/L山茶油组 3 0.95±0.04*▲ 100 μmol/L山茶油组 3 0.48±0.03*▲■ 200 μmol/L山茶油组 3 1.26±0.05*▲■+ F — 22.71 P — < 0.01 MS组内 — 0.052 q检验:与对照组比较*P < 0.05;与10 μmol/L山茶油组比较▲P < 0.05;与50 μmol/L山茶油组比较■P < 0.05;与100 μmol/L山茶油组比较+P < 0.05 表 4 山茶油对PBMCs中GATA-3蛋白表达的影响(x±s)
-
哮喘是较常见的儿科慢性疾病,目前国内外医疗水平虽有了很大进步,但儿童哮喘发病率仍呈逐年增长的趋势,其发病机制也一直是国内外研究的热点[10]。在哮喘治疗过程中,有的药物会引起一些不良反应,如眼部问题、胃溃疡、血压升高以及中毒等[11-12]。因此,近年来从天然产品开发安全有效的抗哮喘药物的相关研究也在不断增加。
已有研究[13]结果显示,由哮喘导致的呼吸道炎症等一系列异常现象的发生可能与辅助性T细胞(Th细胞)反应失衡相关。Th细胞可分为Th1细胞和Th2细胞两个亚型,Th1/Th2细胞的失衡参与包括支气管哮喘等多种免疫性疾病的发生和发展[14]。其中,Th2细胞分泌以IL-4和IL-10为代表的细胞因子,参与介导体液免疫。本研究发现,采用不同浓度山茶油处理PBMCs后,细胞上清液中IL-4的分泌水平均低于对照组,说明山茶油可以抑制PBMCs中IL-4的分泌,以50 μmol/L山茶油处理下IL-4的分泌水平达到最低。而通过实时荧光定量PCR检测发现,同样在50 μmol/L山茶油处理的PBMCs中,IL-4mRNA的表达水平最低,提示山茶油抑制PBMCs分泌IL-4的最佳浓度为50 μmol/L。
GATA-3在内皮细胞、肾细胞和神经组织中表达,而表达GATA-3的唯一造血细胞是Τ谱系细胞,因此,该转录因子是T细胞发育中关键参与者的候选者[4]。同时,GATA-3是Th2细胞分化的关键转录因子,使Th2细胞具有产生IL-4、IL-13和IL-5的能力[15],有研究[16]表明哮喘病人的呼吸道或者PBMCs中GATA-3的表达增加。余圆圆等[17]通过检测哮喘病人PBMCs中ANP、IL-4含量及GATA-3的mRNA与蛋白表达变化,结果显示检测指标较正常组均明显升高。本研究中,未使用山茶油处理的PBMCs中,GATA-3 mRNA的表达量较高,而使用不同浓度山茶油处理后的PBMCs中GATA-3 mRNA的表达水平均下降;Western blotting结果同样显示,不同浓度山油茶处理PBMCs后GATA-3蛋白表达也均降低;10 μmol/L山茶油处理下,GATA-3 mRNA和蛋白的表达均为最低水平。
综上所述,山茶油能明显抑制PBMCs中GATA-3表达及IL-4分泌的水平,可能有助于哮喘患儿的治疗。但是,山茶油的应用浓度不宜过高(< 200 μmol/L),高浓度下PBMCs的活性可能会受到影响。此外,参与此过程的信号通路有待明确,而山茶油在患儿哮喘治疗方面具体的临床运用方式尚且需要进一步探索。
山茶油对哮喘患儿外周血单个核细胞GATA-3表达和IL-4分泌的影响
Effect of camellia oil on GATA-3 expression and IL-4 secretion in peripheral blood mononuclear cells of children with asthma
-
摘要:
目的探讨山茶油对哮喘患儿外周血单个核细胞(PBMCs)转录因子GATA结合蛋白3(GATA-3)表达和白细胞介素-4(IL-4)分泌的影响。 方法采用密度梯度离心法分离哮喘患儿肝素化血液中的PBMCs,以10、50、100、200 μmol/L的山茶油处理PBMCs 24 h。MTT法检测山茶油对PBMCs活性的影响;ELISA检测山茶油对PBMCs IL-4分泌的影响;实时荧光定量PCR检测山茶油处理PBMCs后GATA-3 mRNA和IL-4 mRNA的表达水平;Western blotting检测山茶油处理PBMCs中GATA-3蛋白表达水平。 结果与对照组比较,10、50、100 μmol/L山茶油对PBMCs活力无明显影响(P>0.05),200 μmol/L山茶油能明显降低PBMCs活力(P < 0.01);不同浓度山茶油处理PBMCs后,IL-4分泌水平均明显降低(P < 0.01),当山茶油浓度为50 μmol/L时,IL-4分泌水平最低(P < 0.01);不同浓度山茶油处理PBMCs后,GATA-3 mRNA和IL-4 mRNA的表达均被明显抑制(P < 0.05),当山茶油浓度为50 μmol/L时,GATA-3与IL-4的mRNA表达量最低(P < 0.05);不同浓度山油茶处理PBMCs后GATA-3蛋白表达均降低(P < 0.05),当山茶油浓度为10 μmol/L时,GATA-3蛋白的表达量达到最低水平(P < 0.05)。 结论山茶油可抑制哮喘患儿PBMCs中GATA-3表达及IL-4的分泌,对哮喘具有潜在的治疗作用。 Abstract:ObjectiveTo investigate the effect of camellia oil on GATA-binding protein 3(GATA-3)expression and interleukin 4(IL-4)secretion in peripheral blood mononuclear cells(PBMCs)of children with asthma. MethodsPBMCs in heparinized blood of asthmatic children were separated by density gradient centrifugation.PBMCs were treated with 10, 50, 100 and 200 μmol/L camellia oil for 24 h.MTT assay was used to detect the effect of camellia oil on the activity of PBMCs, ELISA was applied to determine the effect of camellia oil on the IL-4 secretion, real-time fluorescence quantitative PCR was employed to measure the expression of GATA-3 mRNA and IL-4 mRNA, and Western blotting was performed to analyze the expression of GATA-3 protein in PBMCs treated with camellia oil. ResultsCompared with control group, 10, 50 and 100 μmol/L camellia oil had no significant effect on the activity of PBMCs(P>0.05), but 200 μmol/L camellia oil could significantly reduce the activity of PBMCs(P < 0.01);the secretion level of IL-4 in PBMCs treated with different concentrations of camellia oil decreased significantly(P < 0.01), and 50 μmol/L camellia oil had the best effect(P < 0.01);the expression of GATA-3 mRNA and IL-4 mRNA in PBMCs treated with different concentrations of camellia oil were significantly inhibited(P < 0.05), and 50 μmol/L camellia oil had the best effect(P < 0.05);the expression of GATA-3 protein in PBMCs treated with different concentrations of camellia oil was decreased(P < 0.05), and 10 μmol/L camellia oil had the best effect(P < 0.05). ConclusionsCamellia oil can inhibit GATA-3 expression and IL-4 secretion in PBMCs of asthmatic children, and has potential therapeutic effect on asthma. -
Key words:
- asthma /
- camellia oil /
- peripheral blood mononuclear cells /
- GATA-binding protein 3 /
- interleukin 4
-
表 1 山茶油对PBMCs存活率的影响(x±s)
分组 n 存活率/% 对照组 3 100.51±2.59 DMSO组 3 99.58±1.34 10 μmol/L山茶油组 3 99.61±1.53 50 μmol/L山茶油组 3 99.71±1.47 100 μmol/L山茶油组 3 98.85±2.59 200 μmol/L山茶油组 3 76.41±0.95**##▲▲■■++ F — 78.85 P — < 0.01 MS组内 — 3.436 q检验:与对照组比较**P < 0.01;与DMSO组比较##P < 0.01;与10 μmol/L山茶油组比较▲▲P < 0.01;与50 μmol/L山茶油组比较■■P < 0.01;与100 μmol/L山茶油组比较++P < 0.01 表 2 山茶油对PBMCs分泌IL-4的影响(x±s)
分组 n 含量/(pg/mL) 对照组 3 160.05±4.55 10 μmol/L山茶油组 3 90.08±3.52** 50 μmol/L山茶油组 3 82.27±1.43**▲▲ 100 μmol/L山茶油组 3 98.66±5.23**▲▲■■ 200 μmol/L山茶油组 3 125.48±7.45**▲▲■■++ F — 128.10 P — < 0.01 MS组内 — 23.599 q检验:与对照组比较**P < 0.01;与10 μmol/L山茶油组比较▲▲P < 0.01;与50 μmol/L山茶油组比较■■P < 0.01;与100 μmol/L山茶油组比较++P < 0.01 表 3 山茶油对PBMCs中GATA-3、IL-4 mRNA表达的影响(x±s)
分组 n GATA-3 IL-4 对照组 3 0.80±0.05 0.88±0.09 10 μmol/L山茶油组 3 0.32±0.03* 0.48±0.02* 50 μmol/L山茶油组 3 0.40±0.02*▲ 0.50±0.03* 100 μmol/L山茶油组 3 0.46±0.03*■ 0.56±0.03*▲ 200 μmol/L山茶油组 3 0.62±0.05*▲■+ 0.64±0.04*▲■+ F — 76.25 33.18 P — < 0.01 < 0.01 MS组内 — 0.001 0.002 q检验:与对照组比较*P < 0.05;与10 μmol/L山茶油组比较▲P < 0.05;与50 μmol/L山茶油组比较■P < 0.05;与100 μmol/L山茶油组比较+P < 0.05 表 4 山茶油对PBMCs中GATA-3蛋白表达的影响(x±s)
分组 n GATA-3 对照组 3 1.92±0.39 10 μmol/L山茶油组 3 0.38±0.32* 50 μmol/L山茶油组 3 0.95±0.04*▲ 100 μmol/L山茶油组 3 0.48±0.03*▲■ 200 μmol/L山茶油组 3 1.26±0.05*▲■+ F — 22.71 P — < 0.01 MS组内 — 0.052 q检验:与对照组比较*P < 0.05;与10 μmol/L山茶油组比较▲P < 0.05;与50 μmol/L山茶油组比较■P < 0.05;与100 μmol/L山茶油组比较+P < 0.05 -
[1] TIAN D, YANG L, WANG S, et al.Double negative T cells mediate Lag3-dependent antigen-specific protection in allergic asthma[J].Nat Commun, 2019, 10(9):12 [2] DOUROS K, THANOPOULOU MI, BOUTOPOULOU B, et al.Adherence to the Mediterranean diet and inflammatory markers in children with asthma[J].Allergol Immunopath, 2019, 47(3):209 doi: 10.1016/j.aller.2018.04.007 [3] 幸鹏, 刘志刚, 喻海琼, 等.表观遗传机制和哮喘的发生[J].中国免疫学杂志, 2016, 32(5):757 doi: 10.3969/j.issn.1000-484X.2016.05.036 [4] YAGI R, ZHU J, PAUL WE.An updated view on transcription factor GATA3-mediated regulation of Th1 and Th2 cell differentiation[J].Int Immunol, 2011, 23(7):415 doi: 10.1093/intimm/dxr029 [5] LEE HS, CHOI JH, CUI L, et al.Anti-inflammatory and anti-oxidative effects of Camellia japonica on human corneal epithelial cells and experimental dry eye:in vivo and in vitro study[J].Invest Ophthalmol Vis Sci, 2017, 58(2):1196 doi: 10.1167/iovs.16-20634 [6] LEE SY, BAE BS, CHOI YH, et al.Opuntiahumifusa modulates morphological changes charateristic of asthma via IL-4 and IL-13 in an asthma murine model[J].Food Nutr Res, 2017, 61:1. [7] WANG J, ZHANG Y, FANG Z, et al.Oleic acid alleviate scadmium-induced oxidative damage in rat by its radicals scavenging activity[J].Biol Trace Elem Res, 2018, 190(1):95. [8] 贺栋梁, 李小玲, 蒋湘莲, 等.共轭亚油酸对铅脂质过氧化损伤的保护作用[J].中南医学科学杂志, 2008, 36(4):430. doi: 10.3969/j.issn.2095-1116.2008.04.003 [9] YANG KM, HSU HL, CHEN CW, et al.Quality characterization and oxidative stability of Camellia seed oils produced with different roasting temperatures[J].J Oleo Sci, 2018, 67(4):389. doi: 10.5650/jos.ess17190 [10] 夏利, 贾钦尧, 朱书瑶, 等.支气管哮喘患儿外周血NF-κB及血清SAA表达与肺功能相关性分析[J].蚌埠医学院学报, 2018, 43(6):771. [11] NOUTSIOS GT, FLOROS J.Childhood asthma:causes, risks, and protective factors; a role of innate immunity[J].Swiss Med Wkly, 2014, 144:w14036. [12] 高洪芬.240例哮喘患儿临床预后分析[J].河北医科大学学报, 2016, 37(11):1337. doi: 10.3969/j.issn.1007-3205.2016.11.025 [13] CIRIACO M, VENTRICE P, RUSSO G, et al.Corticosteroid-related central nervous system side effects[J].J Pharmacol Pharmacother, 2013, 4:S94. doi: 10.4103/0976-500X.120975 [14] 陈凌, 张建华.Th17细胞的分化调控机制及其在支气管哮喘呼吸道炎症中的作用[J].中华实用儿科临床杂志, 2016, 31(16):1275. doi: 10.3760/cma.j.issn.2095-428X.2016.16.022 [15] GHASEMNEJAD-BERENJI H, GHAFFARI NM, HAJSHAFIHA M, et al.Immunomodulatory effects of hydroxychloroquine on Th1/Th2 balance in women with repeated implantation failure[J].Biomed Pharmacother, 2018, 107:1277. doi: 10.1016/j.biopha.2018.08.027 [16] MUEHLING LM, LAWRENCE MG, WOODFOLK JA.Pathogenic CD4+T cells in patients with asthma[J].J Allergy Clin Immun, 2017, 140(6):1523. doi: 10.1016/j.jaci.2017.02.025 [17] 余圆圆, 曾锦荣, 孙亚冰, 等.不同程度过敏性哮喘患者外周血ANP信号变化及其与哮喘8发病的关系[J].中南大学学报(医学版), 2016, 42(7):684. -




 下载:
下载:


