-
卵巢癌发病隐匿、不易察觉,多数病人发现时处于中晚期且伴随转移[1],导致多数病人预后不佳[2]。因此提高卵巢癌的早期诊断极为重要。但由于卵巢癌发病机制不明确,要提高早期诊断,还需从卵巢癌的发生机制入手。炎症在卵巢癌发生、发展中发挥重要作用[3]。白细胞介素(interleukin,IL)是炎性细胞因子重要组成部分,对免疫细胞成熟、增殖、分化等一系列过程具有调节作用。IL-33是IL-1的家族成员,以前体蛋白的形式存在于多种组织细胞核中,磺基转移酶(sulfotransferase,ST2)是IL-33的高亲和力受体[4]。IL-33/ST2信号通路可诱导免疫效应细胞活化,使促癌或抗癌细胞向肿瘤微环境中募集[5]。然而,IL-33在卵巢癌发生、发展的进程机制仍未清楚,是否通过ST2受体发挥作用也未明确。本研究从IL-33从发,探究IL-33/ST2对卵巢癌细胞增殖、凋亡、迁移和侵袭的影响,旨在进一步揭示卵巢癌发生、发展的分子机制,为卵巢癌的临床基础研究提供参考。
-
人卵巢癌细胞系ES-2细胞购自上海生命科学研究院细胞所;IL-33购自英国Abcam公司;DMEM培养基和胎牛血清均购自美国GIBCO公司;胰蛋白酶、脂质体2000均购自赛默飞世尔有限公司;二甲基亚砜购自美国sigma公司;MTT、Transwell小室、Matrigel基质胶均购自美国Millipore公司;双染细胞凋亡检测试剂购自美国Biolegend公司;青链霉素双抗溶液购自江苏恩莫阿赛生物公司;多聚甲醛和结晶紫染色液均购自碧云天生物公司。
-
将卵巢癌ES-2细胞培养于DMEM培养基(含10%胎牛血清-青链霉素双抗溶液),置于5%CO2、37 ℃的培养箱内培养,据细胞的生长速率每2天更换培养基,用0.25%的胰蛋白酶每隔2~3 d进行消化、传代,收集对数生长期ES-2细胞。
-
MTT法检测IL-33和si-ST2对ES-2人卵巢癌细胞后的存活率的影响:取处于对数生长期ES-2细胞,用0.25%胰酶消化后,细胞计数,将ES-2细胞种到6板孔中,密度为3×105/孔,分组为:对照组、IL-33组、IL-33+si-ST2组、si-ST2组,IL-33质量浓度60 ng/L、si-ST2用量为每孔50 pmol。转染的步骤按照Lipofectamine 2000的说明书进行操作,24 h后消化细胞,计数,将细胞铺板到96孔板,加入浓度为60 ng/L的IL-33,在检测时间点时,每孔加20 μL MTT溶液(5 mg/mL),在37 ℃、5%CO2培养箱中培养4 h,避免吸去紫色结晶,每孔加150 μL二甲基亚砜,进行10 min低速振荡,使结晶物充分溶解,采用酶联免疫监测仪对波长490 nm时每个孔的吸光度实施测定,每组重复3次,取平均值。
-
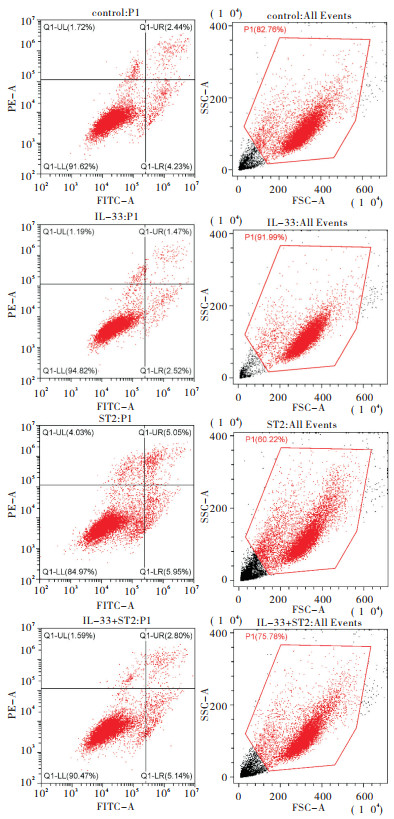
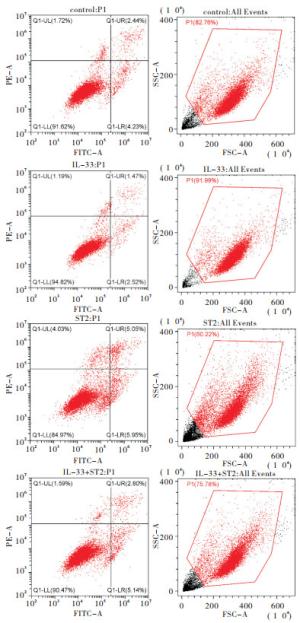
取对数生长期ES-2细胞,0.25%胰蛋白酶消化细胞,调整细胞密度,将ES-2细胞种到6孔板中,孔密度2.5×105,按照分组进行转染si-ST2,转染的步骤按照Lipofectamine 2000的说明书进行操作。转染24 h后,加入60 ng/L的IL-33。48 h后收集细胞,4 ℃预冷PBS洗涤2次,然后用500 μL结合缓冲液重悬细胞,调节其浓度为106/mL,取100 μL细胞悬浮于5 mL流式管中,加入5 μL Annexin V-APC混匀后,加入5 μL Propidiμm Iodide(PI)混匀,于室温避光孵育15 min,采用流式细胞术检测细胞凋亡率。
-
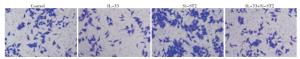
接种ES-2细胞至24孔板,待细胞贴壁铺满后利用枪头划痕,分别加入IL-33(60 ng/L)、si-ST2(每孔50 pmol)刺激后,分别在0、24 h时间点取样,拍照。在Adobe Illustrator(AI)软件里面量出不同时间不同分组划痕的宽度;细胞迁移率=(0 h细胞间距-24 h细胞间距)/0 h细胞间距×100%。
-
接种ES-2细胞至Matrigel基质胶(9:1),Matrigel稀释液平铺于Transwell小室上室,下室加入含有10%胎牛血清的培养液(600 μL),上室分别加入IL-33(60 ng/L)、si-ST2(每孔50 pmol)刺激10 h后,去除上层未穿过滤膜的细胞,保留滤膜下层细胞,甲醇固定,结晶紫染色,显微镜视野下拍照细胞计数。
-
采用t检验和方差分析。
-
IL-33组、si-ST2组、IL-33+si-ST2组以及对照组的细胞存活率的比较,差异有统计学意义(P < 0.01)。其中IL-33组细胞存活率高于对照组(P < 0.01),si-ST2组细胞存活率低于对照组(P < 0.01);但IL-33+si-ST2组细胞存活率与对照组相比差异无统计学意义(P>0.05)。IL-33+si-ST2组细胞存活率显著高于si-ST2组;IL-33组细胞存活率显著高于si-ST2组(P < 0.01)(见表 1)。
分组 n OD值 对照组 3 0.75±0.08 IL-33组 3 1.36±0.04** si-ST2组 3 0.43±0.04**△△ IL-33+si-ST2组 3 0.75±0.02△△## F — 181.40 P — < 0.01 MS组内 — 0.003 q检验:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 表 1 不同组间细胞存活比较(x±s)
-
对照组、IL-33组、si-ST2组以及IL-33+si-ST2组流式细胞仪结果显示,在ES-2细胞中,IL-33组细胞凋亡率低于对照组;si-ST2组细胞凋亡率高于对照组和IL-33组;IL-33+si-ST2组细胞凋亡率低于si-ST2组,高于IL-33组(见图 1、表 2)。
分组 LL
(活细胞)UL
(碎片及损伤细胞)UR
(晚期凋亡)LR
(早期凋亡)凋亡率 对照组 91.62 1.72 2.44 4.23 6.67 IL-33组 94.82 1.19 1.47 2.52 3.99** si-ST2组 84.97 4.03 5.05 5.95 10.90**△△ IL-33+si-ST2组 90.47 1.59 2.80 5.14 7.90**△△## 注:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 表 2 ES-2凋亡数据表(%)
-
IL-33组、si-ST2组、IL-33+si-ST2组以及对照组的细胞迁移率、侵袭率的比较,差异有统计学意义(P < 0.01),其中IL-33组细胞迁移率、侵袭率均低于对照组,si-ST2组迁移、侵袭均高于对照组,IL-33+si-ST2组迁移、侵袭均高于IL-33组,低于si-ST2组,差异均有统计学意义(P < 0.01)(见图 2、图 3及表 3)。
分组 n 细胞迁移率/% 细胞侵袭率/% 对照组 3 45.83±4.15 43.06±2.64 IL-33组 3 22.88±2.36** 13.68±2.46** si-ST2组 3 73.71±3.08**△△ 66.59±1.78**△△ IL-33+si-ST2组 3 56.04±2.82**△△## 49.99±4.19**△△## F — 134.30 173.60 P — < 0.01 < 0.01 MS组内 — 10.058 8.436 q检验:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 表 3 不同组间细胞迁移率、侵袭率的比较(x±s)
-
肿瘤发展不仅包括癌细胞本身,还有其他相关组成部分,如基质细胞、炎症细胞,特别在卵巢癌腹水和基质交换过程中,会伴随淋巴细胞群的相关因子变化,促进癌细胞生长、扩散[6]。另外癌细胞本身产生的炎性细胞因子也能通过自分泌方式,促进其本身增长,抑制凋亡。可见,炎症似乎和肿瘤的每一步都有关联,包括肿瘤细胞增殖、调亡、迁移、侵袭[7]。因为炎性因子的刺激,会造成线粒体损伤,降低细胞内的抗氧化活性,增加活性氧的产生,破坏生物大分子(DNA、蛋白质),导致正常细胞转化为恶性细胞[8],当细胞的基因发生点突变、缺失或重组,即可诱发肿瘤[9]。IL-33作为新发现的促炎细胞因子,可通过IL-33/ST2信号通路,作用于含有ST2受体的细胞,诱导其分泌相关细胞因子和趋化因子,发挥促增殖作用。有文献[10]表明IL-33和ST2在卵巢肿瘤中表达上调。胡霞等[11]研究表明IL-33可促进食管腺癌细胞的增殖,其机制是IL-33通过IL-33/ST2信号通路,作用于含有ST2受体的细胞,诱导其分泌相关炎性因子,发挥促癌细胞增殖、迁移作用。LI等[12]研究表明IL-33可促进大肠癌细胞的增殖,其机制是IL-33通过其受体ST2发挥作用,同时经NF-κB信号上调环氧化酶2的表达,促进大肠癌细胞的增殖、迁移。这些研究均表明IL-33是通过ST2通路发挥促癌细胞发展作用, 但其在卵巢癌的作用尚不清楚。
本研究采用MTT实验发现IL-33组细胞存活率高于对照组,si-ST2组细胞存活率低于对照组,IL-33+si-ST2组细胞存活率显著高于si-ST2组;IL-33组细胞存活率显著高于si-ST2组(P < 0.01)。表明了IL-33促进ES-2卵巢癌细胞增殖,si-ST2抑制增殖,转染si-ST2后再加入IL-33处理后,细胞增殖能力恢复。在流式细胞术检测IL-33和si-ST2对ES-2卵巢癌细胞凋亡的影响结果发现,IL-33处理组细胞凋亡率低于对照组;si-ST2组细胞凋亡率高于对照组和IL-33组;IL-33+si-ST2组细胞凋亡率低于si-ST2组,高于IL-33组(P < 0.01)。表明了在卵巢癌ES-2细胞中,IL-33抑制细胞凋亡,si-ST2促进细胞凋亡。本研究的迁移、侵袭实验发现IL-33组细胞迁移率、侵袭率均低于对照组,si-ST2组迁移、侵袭均高于对照组,IL-33处理+si-ST2组迁移、侵袭均高于IL-33处理组,低于si-ST2组(P < 0.01)。IL-33可促进卵巢癌细胞增殖,并可抑制卵巢癌细胞凋亡、迁移和侵袭能力。而沉默ST2可抑制细胞增殖,并促进卵巢癌细胞凋亡、迁移和侵袭能力,ST2沉默处理后再加入IL-33处理,细胞增殖能力恢复,而细胞凋亡、迁移和侵袭能力受到抑制。说明在卵巢癌ES-2细胞中,IL-33对其生物学特性的影响是通过ST2受体途径而实现的。究其原因:IL-33在肿瘤微环境下,被分泌到胞外与受体ST2结合,通过IL-33/ST2信号通路作用于肿瘤微环境中的含有ST2受体的细胞,诱导其分泌相关细胞因子和趋化因子[13]。同时将信号转到细胞内,把MyD88蛋白招募过来[14],并通过MyD88通路的IRAK1、IRAK4和TRAF6,降解IκB蛋白(NF-κB的抑制性蛋白),随后激活NF-κB、MAPK、p38以及c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和细胞外调节激酶(extracellular regulated protein kinases, ERK)[13, 15],同时激活下游转录因子激活子蛋白-1(Activator protein 1, AP-1)。NF-κB是一种可与免疫球蛋白κ轻链基因增强子κB序列特异性结合的核蛋白因子[16],具有多向性转录调节作用,当活化的NF-κB与相应κB序列结合后,启动和调节增殖相关基因的转录;MAPK通路是细胞增殖、凋亡等信号的转导途径;而p38途径通过上调某些转录因子基因的表达,则会影响癌细胞的增殖,JNK途径中活化的JNK与激活转录因子2(ATF2)及c-Jun的氨基末端区域结合,使转录因子的活性区域发生磷酸化[17],JNK的同二聚体或异二聚体与基因启动子上的AP-1位点结合,提高AP-1转录活性,促进基因表达和蛋白质的合成,使内皮细胞活化,肿瘤细胞更容易穿透内皮,介导细胞与细胞间、或细胞与基质间相互接触或结合,从而参与肿瘤迁移、侵袭等过程。这也说明了IL-33是可促进卵巢癌细胞增殖,但ST2沉默后,IL-33无法与ST2受体结合发挥促增殖作用,因此si-ST2属促进卵巢癌细胞凋亡。
综上,IL-33可促进卵巢癌ES-2细胞增殖并抑制其凋亡、迁移、侵袭,沉默ST2可抑制卵巢癌ES-2细胞增殖并促进其凋亡, 使其迁移和侵袭能力下降,ST2沉默处理后再加入IL-33处理,细胞增殖能力恢复,但细胞凋亡、迁移和侵袭能力受到抑制。IL-33通过ST2途径参与影响卵巢癌ES-2细胞的增殖、凋亡、迁移和侵袭。
IL-33及其受体ST2对人卵巢癌ES-2细胞增殖、凋亡、迁移和侵袭的影响
Effect of IL-33 and its receptor ST2 on the proliferation, apoptosis, migration and invasion of human ovarian cancer ES-2 cells
-
摘要:
目的探讨白细胞介素-33(IL-33)及其受体磺基转移酶(ST2)对人卵巢癌ES-2细胞增殖、凋亡、迁移和侵袭的影响。 方法采用MTT实验检测IL-33和si-ST2对ES-2人卵巢癌细胞存活率的影响;分为对照组、IL-33组、si-ST2组以及IL-33+si-ST2组,检测各组吸光度值;用流式细胞术检测IL-33和si-ST2对ES-2人卵巢癌细胞凋亡的影响,统计各组细胞凋亡数目;用细胞迁移和侵袭实验检测IL-33和si-ST2对ES-2人卵巢癌细胞迁移、侵袭的影响。 结果IL-33组、si-ST2组、IL-33+si-ST2组以及对照组的细胞存活率的比较差异有统计学意义(P < 0.01)。其中IL-33组细胞存活率高于对照组,si-ST2组细胞存活率低于对照组,IL-33+si-ST2组细胞存活率显著高于si-ST2组,IL-33组细胞存活率显著高于si-ST2组,差异均有统计学意义(P < 0.01)。IL-33组细胞凋亡率低于对照组;si-ST2组细胞凋亡率高于对照组和IL-33组;IL-33+si-ST2组细胞凋亡率低于si-ST2组,高于IL-33组。IL-33组、si-ST2组、IL-33+si-ST2组以及对照组的细胞迁移率、侵袭率的比较,差异有统计学意义(P < 0.01)。其中IL-33组细胞迁移、侵袭均低于对照组,si-ST2组迁移、侵袭均高于空白对照组,IL-33+si-ST2组迁移、侵袭均高于IL-33组,低于si-ST2组,差异均有统计学意义(P < 0.01)。 结论IL-33可促进卵巢癌ES-2细胞增殖并抑制其凋亡、迁移、侵袭;沉默ST2可抑制卵巢癌ES-2细胞增殖并促进其凋亡,使其迁移和侵袭能力下降;IL-33通过ST2途径参与影响卵巢癌ES-2细胞的增殖、凋亡、迁移和侵袭。 Abstract:ObjectiveTo investigate the effects of interleukin-33(IL-33) and its receptor sulfotransferase(ST2) on the proliferation, apoptosis, migration and invasion of human ovarian cancer ES-2 cells. MethodsThe effects of IL-33 and si-ST2 on the survival rate of ES-2 cells were detected using MTT assay, and the cells were divided into the control group, IL-33 group, si-ST2 group and IL-33+si-ST2 group.The OD value in each group was detected.The effects of IL-33 and si-ST2 on the apoptosis of ES-2 cells were detected using flow cytometry, and the number of apoptotic cells in each group was counted.The effects of IL-33 and si-ST2 on the migration and invasion of ES-2 cells were detected using the cell migration and invasion experiments. ResultsThe differences of cell survival rates among the IL-33 group, si-ST2 group, IL-33+si-ST2 and control group were statistically significant(P < 0.01).The cell survival rate in IL-33 group was higher than that in control group, the cell survival rate in si-ST2 group was lower than that in control group, the cell survival rate in IL-33+si-ST2 group was significantly higher than that in si-ST2 group, and the cell survival rate in IL-33 group was significantly higher than that in si-ST2 group(P < 0.01).The cell apoptosis rate in IL-33 group was lower than that in control group, the cell apoptosis rate in si-ST2 group was higher than that in control group and IL-33 group, and the cell apoptosis rate in IL-33+si-ST2 group was lower than that in si-ST2 group, and higher than that in IL-33 group(P < 0.01).The differences of the cell migration rate and invasion rate among the IL-33 group, si-ST2 group, IL-33+si-ST2 group and control group were statistically significant(P < 0.01).The migration and invasion rates of cells in IL-33 group were lower than those in control group, the migration and invasion rates of cells in si-ST2 group were higher than those in control group, and the migration and invasion rates of cells in IL-33+si-ST2 group were higher than those in IL-33 group, and lower than those in si-ST2 group(P < 0.01). ConclusionsIL-33 can promote the proliferation, and inhibit the apoptosis, migration and invasion of ES-2 cells.Silencing ST2 can inhibit the proliferation, and promote the apoptosis, migration and invasion of ES-2 cells.IL-33 affects the proliferation, apoptosis, migration and invasion of ES-2 cells through ST2 pathway. -
Key words:
- ovarian neoplasms /
- interleukin-33 /
- sulfotransferase /
- ES-2 cells
-
表 1 不同组间细胞存活比较(x±s)
分组 n OD值 对照组 3 0.75±0.08 IL-33组 3 1.36±0.04** si-ST2组 3 0.43±0.04**△△ IL-33+si-ST2组 3 0.75±0.02△△## F — 181.40 P — < 0.01 MS组内 — 0.003 q检验:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 表 2 ES-2凋亡数据表(%)
分组 LL
(活细胞)UL
(碎片及损伤细胞)UR
(晚期凋亡)LR
(早期凋亡)凋亡率 对照组 91.62 1.72 2.44 4.23 6.67 IL-33组 94.82 1.19 1.47 2.52 3.99** si-ST2组 84.97 4.03 5.05 5.95 10.90**△△ IL-33+si-ST2组 90.47 1.59 2.80 5.14 7.90**△△## 注:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 表 3 不同组间细胞迁移率、侵袭率的比较(x±s)
分组 n 细胞迁移率/% 细胞侵袭率/% 对照组 3 45.83±4.15 43.06±2.64 IL-33组 3 22.88±2.36** 13.68±2.46** si-ST2组 3 73.71±3.08**△△ 66.59±1.78**△△ IL-33+si-ST2组 3 56.04±2.82**△△## 49.99±4.19**△△## F — 134.30 173.60 P — < 0.01 < 0.01 MS组内 — 10.058 8.436 q检验:与对照组比较**P < 0.01;与IL-33组比较△△P < 0.01;与si-ST2组比较##P < 0.01 -
[1] 朱连成, 郭骞, 勾睿, 等.转染人附睾蛋白4基因对人卵巢癌细胞基因表达的影响[J].中国医科大学学报, 2020, 49(5):385. [2] 张维维, 张正伟, 何朗.342例卵巢癌手术患者预后影响因素分析[J].中华肿瘤防治杂志, 2019, 26(17):1288. [3] 陈丽云, 郑丽华, 罗飞, 等.炎症在卵巢癌发病中的作用研究进展[J].现代中西医结合杂志, 2015, 24(32):3646. doi: 10.3969/j.issn.1008-8849.2015.32.043 [4] 胡霞, 单晶, 孙晓滨.IL-33/ST2途径在肿瘤发生和发展中作用的研究进展[J].肿瘤预防与治疗, 2019, 32(4):366. doi: 10.3969/j.issn.1674-0904.2019.04.014 [5] LI X, LV Q, FENG Y, et al.Interleukin-33, a potential cytokine expressed in tumor microenvironment involves in antitumor immunotherapy through facilitates cd8 T cells[J].J Interferon Cytokine Res, 2018, 38(11):491. doi: 10.1089/jir.2018.0069 [6] LI L, BAI H, YANG J, et al.Genome-wide DNA copy number analysis in clonally expanded human ovarian cancer cells with distinct invasive/migratory capacities[J].Oncotarget, 2017, 8(9):15136. doi: 10.18632/oncotarget.14767 [7] GAO X, WANG XF, YANG QT, et al.Tumoral expression of IL-33 inhibits tumor growth and modifies the tumor microenvironment through CD8+T and NK cells[J].J Immunol, 2015, 194(1):438. doi: 10.4049/jimmunol.1401344 [8] TRABERT B, PINTO L, HARTGE P, et al.Pre-diagnostic serum levels of inflammation markers and risk of ovarian cancer in the prostate, lung, colorectal and ovarian cancer(PLCO)screening trial[J].Gynecol Oncol, 2014, 135(2):200. [9] 赵薇, 徐鹏, 田亚楠, 等.白介素-33在妇科肿瘤中的研究进展[J].中华全科医学, 2020, 18(3):467. [10] TONG X, BARBOUR M, HOU K, et al.Interleukin-33 predicts poor prognosis and promotes ovarian cancer cell growth and metastasis through regulating ERK and JNK signaling pathways[J].Mol Oncol, 2016, 10(1):113. doi: 10.1016/j.molonc.2015.06.004 [11] 胡霞, 孙晓滨, 单晶.IL-33及其受体ST2在食管腺癌中的表达及其对肿瘤细胞增殖、迁移与侵袭的影响[J].四川医学, 2019, 40(1):32. [12] LI Y, SHI J, QI S, et al.IL-33 facilitates proliferation of colorectal cancer dependent on COX2/PGE2[J].J Exp Clin Cancer Res, 2018, 37(1):196. doi: 10.1186/s13046-018-0839-7 [13] KIM JY, LIM SC, KIM G, et al.Interleukin-33/ST2 axis promotes epithelial cell transformation and breast tumorigenesis via upregulation of COT activity[J].Oncogene, 2015, 34(38):4928. doi: 10.1038/onc.2014.418 [14] 朱熠, 黄建鸣, 张国楠.卵巢上皮性癌MyD88表达的潜在调控机制研究进展[J].中华妇产科杂志, 2019(2):139. doi: 10.3760/cma.j.issn.0529-567x.2019.02.016 [15] YU XX, HU Z, SHEN X, et al.IL-33 Promotes Gastric Cancer Cell Invasion and Migration Via ST2-ERK1/2 Pathway[J].Dig Dis Sci, 2015, 60(5):1265. doi: 10.1007/s10620-014-3463-1 [16] 杨淑梅, 曹蕾, 秦天洁, 等.卵巢癌细胞中RhoA和NF-κB表达与癌细胞增殖、侵袭能力的关系[J].现代生物医学进展, 2018, 18(24):4628. [17] TONG X, BARBOUR M, HOU K, et al.Interleukin-33 predicts poor prognosis and promotes ovarian cancer cell growth and metastasis through regulating ERK and JNK signaling pathways[J].Mol Oncol, 2016, 10(1):113. doi: 10.1016/j.molonc.2015.06.004 -




 下载:
下载: