-
脓毒败血症会导致病人发生急性肺损伤,继而引发重症监护室病人死亡风险增加[1-2]。丙泊酚对脓毒败血症诱发的急性肺损伤的保护作用已被证实[3],但其机制还未阐明。研究[4]显示,核苷酸结合结构域样受体蛋白3(nucleotide-binding domain-like receptor protein 3, NLRP3)炎症体参与急性肺损伤的形成和进展。氧化应激反应参与了急性肺损伤的形成和进展[5],硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)是关键的氧化应激衔接蛋白,TXNIP从硫氧还蛋白解离,结合NLRP3,激活NLRP3炎症体[6]。由于NLRP3具有促炎作用,抑制NLRP3能抑制炎症的形成和进展,而丙泊酚被认为主要通过抑制炎症反应发挥肺保护作用[3]。本研究观察抑制NLRP3信号通路对丙泊酚肺保护作用的影响,以探讨丙泊酚肺保护作用机制。现作报道。
-
ICR小鼠40只,雄性,体质量20~24 g,由浙江省医科院实验动物中心提供,实验前适应性喂养1周,自由进食水。小鼠随机分为对照组(腹腔注射pH 7.4磷酸缓冲液)、脂多糖(LPS)组(腹腔注射30 mg/kg脂多糖)、丙泊酚组(静脉注射40 mg/kg丙泊酚)、丙泊酚+LPS组(腹腔注射30 mg/kgLPS前20 min预静脉注射40 mg/kg丙泊酚),各10只。腹腔注射48 h后在七氟烷麻醉下颈椎脱位法处死小鼠。
-
制作小鼠肺组织石蜡切片,置于烘箱中60 ℃烤1~2 h,石蜡切片常规二甲苯、乙醇脱蜡至水,苏木素染10 min,流水冲洗,去余色,0.7%盐酸乙醇分化数秒,流水冲洗,切片变蓝约15 min,95%乙醇30 s,乙醇性伊红染30 s,95%乙醇30 s(2次),100%乙醇30 s(2次),石碳酸二甲苯(1∶4)30 s,二甲苯30 s,中性树胶封片。采用100倍光学显微镜对肺部组织进行观察,细胞染色呈棕色为阳性细胞。
-
取ICR小鼠右侧肺部组织与预冷0.9%氯化钠溶液(M∶M=1∶9)混合,充分匀浆,在4 ℃、1 000 r/min离心15 min,制备上清液,根据MDA、SOD试剂盒操作说明书进行实验操作,利用分光光度计比色法测定其含量。
-
(1) 总RNA提取:对20 mg肺组织匀浆处理,加入1 mL Trizol试剂裂解细胞,静置10 min,每毫升Trizol试剂中加入0.2 mL氯仿溶液,震荡15 s,静置3 min。在4 ℃、12 000 r/min离心15 min,吸取水样放置于EP管中,加入相同体积的异丙醇,混匀,常温放置50 min,在4 ℃、5 000 r/min离心3 min,吸出液体,常温下沉淀RNA,并用Rnase-free水对RNA沉淀进行溶解。(2)逆转录合成cDNA。采用SYBR Premix EX Taq Ⅱ预混酶(TakaRa公司),按下列步骤操作。预混酶10 μL,上述cDNA模板1 μL,上、下游引物各10 pmol/L,加纯水至20 μL;AB 7300型实时荧光定量PCR仪(AB公司),反应条件为:50 ℃ 2 min,95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,50个循环,采用溶解曲线分析程序分析产物的溶解曲线,以确认引物的特异性。
-
取肺部组织用液氮均匀研磨至粉末状,加入蛋白裂解液分解40 min,在冰浴条件下匀浆15 min,在4 ℃、14 000 r/min离心20 min,吸取上清液,Bradford法进行蛋白定量,将样品放置于-80 ℃冰箱中保存。取30 μg蛋白样品进行SDS-PAGE凝胶电泳,电转至PVDF膜,一抗(Nrf2和HO-1稀释比例均为1∶ 100)在4 ℃封闭过夜;利用Tris缓冲盐对膜进行冲洗,约5 min,共冲洗3次,向反应体系中加入辣根过氧化物酶对二抗IgG(1∶2 000)进行标记,在常温下孵育60 min,采用Tris缓冲盐对膜进行冲洗,约5 min,共冲洗3次。利用β-actin作为内参,通过化学发光试剂进行显影,暗室曝光冲片,经胶片经凝胶成像系统确定TXNIP和NLRP3蛋白的相对表达量。
-
采用方差分析和q检验。
-
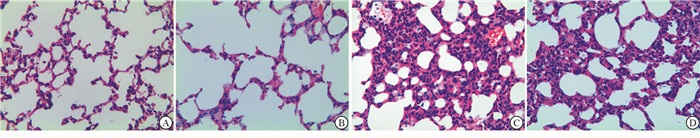
注射48 h后,对照组与丙泊酚组10只小鼠全部存活,LPS组4只、LPS+丙泊酚组6只存活。对照组与丙泊酚组小鼠肺组织结构较为正常,LPS组小鼠肺泡壁严重破坏,肺部组织毛细血管发生充血、扩张等现象,肺间质发生水肿,肺泡间隔变宽;丙泊酚+LPS组小鼠肺泡间隔轻度变宽,肺部组织损伤较LPS组减轻(见图 1)。
-
腹腔注射48 h后,LPS组小鼠MDA明显高于对照组,SOD活性明显低于对照组(P < 0.01)。丙泊酚组MDA、SOD与对照组差异均无统计学意义(P>0.05)。丙泊酚+LPS组MDA明显低于LPS组(P < 0.01),与对照组差异无统计学意义(P>0.05);SOD活性明显高于LPS组(P < 0.01),但均明显低于对照组和丙泊酚组(P < 0.01)(见表 1)。
分组 MDA/(μmol/g) SOD/(kU/g) 对照组 1.37±0.28 372.84±7.42 LPS组 2.39±0.38** 304.23±6.21** 丙泊酚组 1.42±0.25## 377.2±7.83## 丙泊酚+LPS组 1.68±0.34## 355.4±6.93**##ΔΔ F 11.02 100.44 P < 0.01 < 0.01 MS组内 0.100 50.739 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 表 1 各组小鼠右侧肺部组织SOD、MDA比较(ni=5;x±s)
-
丙泊酚组TXNIP mRNA和NLRP3 mRNA与对照组差异均无统计学意义(P>0.05);LPS组TXNIP mRNA和NLRP3 mRNA表达均较对照组和丙泊酚组明显上调(P < 0.01);丙泊酚+LPS组TXNIP mRNA和NLRP3 mRNA表达均明显低于LPS组(P < 0.01),但仍均明显高于对照组和丙泊酚组(P < 0.01)(见表 2)。
分组 TXNIP mRNA NLRP3 mRNA 对照组 1.01±0.03 1.02±0.02 LPS组 4.73±0.24** 7.64±0.22** 丙泊酚组 1.18±0.02## 1.15±0.06## 丙泊酚+LPS组 2.01±0.06**##ΔΔ 2.72±0.05**##ΔΔ F 948.19 3 507.06 P < 0.01 < 0.01 MS组内 0.016 0.014 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 表 2 各组小鼠肺组织TXNIP mRNA、NLRP3 mRNA表达比较(ni=5;x±s)
-
丙泊酚组TXNIP和NLRP3蛋白表达与对照组差异均无统计学意义(P>0.05);LPS组TXNIP和NLRP3蛋白表达均明显高于对照组和丙泊酚组(P < 0.01);丙泊酚+LPS组TXNIP和NLRP3蛋白表达均明显低于LPS组(P < 0.01)(见表 3)。
分组 TXNIP NLRP3 对照组 0.020±0.003 0.017±0.003 LPS组 0.132±0.021** 0.126±0.030** 丙泊酚组 0.020±0.002## 0.19±0.005**## 丙泊酚+LPS组 0.025±0.003## 0.024±0.003**##ΔΔ F 70.99 148.31 P < 0.01 < 0.01 MS组内 0.000 0.000 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 表 3 各组小鼠肺组织TXNIP、NLRP3表达水平比较(ni=5;x±s)
-
炎症调节的细胞因子在急性肺损伤发生和进展中扮演着重要作用[7],大量的肺泡巨噬细胞是肺组织天然的免疫细胞,急性呼吸窘迫综合征病人肺泡巨噬细胞产生过量的白细胞介素(IL)-1β和IL-18,应用IL-1β和IL-18中和抗体和IL-1受体拮抗剂能显著减弱机械通气诱发的急性肺损伤, 机械通气激活NLRP3炎症体,NLRP3炎症体进一步诱发了肺泡IL-1β和IL-18的释放,因此NLRP3信号通路可能有助于机械通气诱发的急性肺损伤的发生[8-9]。
在LPS诱发的急性肺损伤模型中,LPS通过激活氧化应激反应间接激活NLRP3信号通路,氧化应激产物被证实参与了NLRP3信号通路的调节[10]。本研究结果显示,LPS明显上调小鼠肺组织TXNIP和NLRP3 mRNA及蛋白表达。丙泊酚是临床常用全麻药物,在急性肺损伤气管插管病人镇静中的应用较广。丙泊酚在临床上可显著降低急性肺损伤发生风险,有学者指出丙泊酚对肺组织保护作用与氧化应激、炎性反应等有关,丙泊酚可清除羟基自由基与H2O2,诱导HO-1表达,抑制IL-6、TNF-α等炎性因子的表达,对脏器起到保护作用[11-13]。LUO等[14]研究表明丙泊酚对原位肝移植大鼠致急性肺损伤保护与抑制NADPH氧化酶相关,丙泊酚通过降低炎症反应与氧化应激反应实现肺组织保护效果。本研究结果显示,丙泊酚能明显减弱LPS诱发的肺组织氧化应激反应,虽然对正常肺组织TXNIP和NLRP3表达没有影响,但对LPS激活的NLRP3信号通路有显著抑制作用,提示丙泊酚抑制LPS激活的NLRP3信号通路可能与抑制LPS诱发的氧化应激反应有关。
综上,丙泊酚对LPS诱导的急性肺损伤的保护作用可能与抑制NLRP3信号通路有关。
丙泊酚对小鼠急性肺损伤NLRP3信号通路的影响
Effect of the propofol on the NLRP3 signaling pathway in mice with acute lung injury
-
摘要:
目的分析丙泊酚对脂多糖(LPS)诱导的急性肺损伤的保护作用及对硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)、核苷酸结合结构域样受体蛋白3(nucleotide-binding domain-like receptor protein 3,NLRP3)表达的影响,探讨丙泊酚肺保护的可能机制。 方法ICR小鼠40只,随机分为对照组(腹腔注射pH 7.4磷酸缓冲液)、LPS组(腹腔注射30 mg/kgLPS)、丙泊酚组(静脉注射40 mg/kg丙泊酚)和丙泊酚+LPS组(静脉注射40 mg/kg丙泊酚后20 min腹腔注射30 mg/kg脂多糖),各10只。分别在光镜下对肺组织进行病理分析,检测MDA含量、SOD活性和肺上皮细胞核内TXNIP和NLRP3表达水平。 结果肺组织病理学显示,丙泊酚明显减弱LPS诱发的小鼠急性肺损伤。与对照组比较,LPS组小鼠肺组织MDA含量明显升高,SOD活性明显下降(P < 0.01),TXNIP、NLRP3 mRNA和蛋白表达均明显上调(P < 0.01);与LPS组比较,丙泊酚+LPS组MDA含量明显降低,SOD活性明显升高(P < 0.01),肺组织TXNIP、NLRP3 mRNA和蛋白表达均明显下调(P < 0.01)。 结论静脉预注丙泊酚可通过抑制TXNIP、NLRP3 mRNA和蛋白表达水平,有效缓解LPS诱导的急性肺损伤,对肺部组织起到保护作用。 -
关键词:
- 急性肺损伤 /
- 丙泊酚 /
- 核苷酸结合结构域样受体蛋白3 /
- 硫氧还蛋白相互作用蛋白 /
- 小鼠
Abstract:ObjectiveTo analyze the protective effects of propofol on the acute lung injury induced by lipopolysaccharide(LPS)and expression levels of thioredoxin-interacting protein(TXNIP)and nucleotide-binding domain-like receptor protein 3(NLRP3), and explore the possible mechanisms of lung protection with propofol. MethodsForty ICR mice were divided into the control group(treatment with intraperitoneal injection of pH 7.4 phosphate buffer), LPS group(treatment with intraperitoneal injection of 30 mg/kg LPS), propofol group(treatment with intravenous injection of 40 mg/kg propofol)and propofol +LPS group(treatment with intraperitoneal injection of 30 mg/kg LPS after 20 min of intravenous injection of 40 mg/kg propofol)(10 mice in each group).The pathological analysis of lung tissue was conducted under light microscope, and the MDA content, SOD activity and expression levels of TXNIP and NLRP3 in pulmonary epithelial cells were detected. ResultsThe lung histopathological results showed that propofol could significantly reduced the acute lung injury induced by LPS in mice.Compared with the control group, the MDA content and SOD activity in the lung tissues of LPS group were significantly increased and decreased, respectively(P < 0.01), and the expression levels of TXNIP, NLRP3 mRNA and protein were significantly up-regulated in LPS group(P < 0.01).Compared with the LPS group, the MDA content and SOD activity were significantly decreased and increased in the propofol+LPS group, respectviely(P < 0.01), and the expression levels of TXNIP and NLRP3 mRNA and protein in lung tissues of propofol+LPS group were significantly down-regulated(P < 0.01). ConclusionsThe intravenous preinjection of propofol can down-regulate the mRNA and protein expressions of TXNIP and NLRP3 in lung tissues, effectively alleviate the acute lung injury induced by LPS, and play a protective role in lung tissue. -
表 1 各组小鼠右侧肺部组织SOD、MDA比较(ni=5;x±s)
分组 MDA/(μmol/g) SOD/(kU/g) 对照组 1.37±0.28 372.84±7.42 LPS组 2.39±0.38** 304.23±6.21** 丙泊酚组 1.42±0.25## 377.2±7.83## 丙泊酚+LPS组 1.68±0.34## 355.4±6.93**##ΔΔ F 11.02 100.44 P < 0.01 < 0.01 MS组内 0.100 50.739 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 表 2 各组小鼠肺组织TXNIP mRNA、NLRP3 mRNA表达比较(ni=5;x±s)
分组 TXNIP mRNA NLRP3 mRNA 对照组 1.01±0.03 1.02±0.02 LPS组 4.73±0.24** 7.64±0.22** 丙泊酚组 1.18±0.02## 1.15±0.06## 丙泊酚+LPS组 2.01±0.06**##ΔΔ 2.72±0.05**##ΔΔ F 948.19 3 507.06 P < 0.01 < 0.01 MS组内 0.016 0.014 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 表 3 各组小鼠肺组织TXNIP、NLRP3表达水平比较(ni=5;x±s)
分组 TXNIP NLRP3 对照组 0.020±0.003 0.017±0.003 LPS组 0.132±0.021** 0.126±0.030** 丙泊酚组 0.020±0.002## 0.19±0.005**## 丙泊酚+LPS组 0.025±0.003## 0.024±0.003**##ΔΔ F 70.99 148.31 P < 0.01 < 0.01 MS组内 0.000 0.000 q检验:与对照组比较**P < 0.01;与LPS组比较##P < 0.01;与丙泊酚组比较ΔΔP < 0.01 -
[1] YU JB, YAO SL. Effect of heme oxygenase-endogenous carbon monoxide on mortality during septic shock in rats[J]. Ir J Med Sci, 2009, 178(4): 491. doi: 10.1007/s11845-008-0260-x [2] 吴丽丽, 余剑波, 宫丽荣, 等. 活化蛋白-1在大鼠内毒素性肺损伤时血红素加氧酶-1上调中的作用[J]. 中华麻醉学杂志, 2012, 32(9): 1146. doi: 10.3760/cma.j.issn.0254-1416.2012.09.033 [3] 王宏, 刘刚, 符炜. Nrf2在丙泊酚抑制内毒素性急性肺损伤中的作用[J]. 中国药理学通报, 2013, 29(9): 1286. doi: 10.3969/j.issn.1001-1978.2013.09.025 [4] GRAILER JJ, CANNING BA, KALBITZ M, et al. Critical role for the NLRP3 inflammasome during acute lung injury[J]. J Immunol, 2014, 192(12): 5974. doi: 10.4049/jimmunol.1400368 [5] LUO G, ZHU G, YUAN D, et al. Propofol alleviates acute lung injury following orthotopic autologous liver transplantation in rats via inhibition of the NADPH oxidase pathway[J]. Mol Med Rep, 2015, 11(3): 2348. doi: 10.3892/mmr.2014.2924 [6] ZHOU R, TARDIVEL A, THORENS B, et al. Thioredoxin-interacting protein links oxidative stress to inflammasome activation[J]. Nat Immunol, 2010, 11(2): 136. doi: 10.1038/ni.1831 [7] DOLINARY T, KIM YS, HOWRYLAK J, et al. Inflammasome-regulated cytokines are critical mediators of acute lung injury[J]. Am J Respir Crit Care Med, 2012, 185(11): 1225. doi: 10.1164/rccm.201201-0003OC [8] KUIPERS MT, ASLAMI H, JANCZY JR, et al. Ventilator-induced lung injury is mediated by the NLRP3 inflammasome[J]. Anesthesiology, 2012, 116(5): 1104. doi: 10.1097/ALN.0b013e3182518bc0 [9] WU J, YAN Z, SCHWARTZ DE, et al. Activation of NLRP3 inflammasome in alveolar macrophages contributes to mechanical stretch-induced lung inflammation and injury[J]. J Immunol, 2013, 190(7): 3590. doi: 10.4049/jimmunol.1200860 [10] TSCHOPP J, SCHRODER K. NLRP3 inflammasome activation: the convergence of multiple signaling pathways on ROS production?[J]. Nat Rev Immunol, 2010, 10(3): 210. doi: 10.1038/nri2725 [11] GULCIN I, ALICI HA, CESUR M. Determination of in vitro antioxidant and radical scavenging activities of propofol[J]. Chem Pharm Bull, 2005, 53(3): 281. doi: 10.1248/cpb.53.281 [12] KOBAYASHI K, YOSHINO F, TAKAHASHI SS, et al. Direct assessments of the antioxidant effects of propofol medium chain triglyceride/long chain triglyceride on the brain of stroke-prone spontaneously hyperternsive rats using electron spin resonance spectroscopy[J]. Anesthesiology, 2008, 109(3): 423. [13] XU JJ, WANG YL. Propofol attenuation of hydrogen peroxide-mediated oxidative stress and apoptosis in cultured cardiomyocytes involves haeme oxygenase-1[J]. Eur J Anaesthesiol, 2008, 25(5): 395. doi: 10.1017/S0265021508003542 [14] LUO G, ZHU G, YUAN D, et al. Propofol alleviates acute lung injury following orthotopic autologous liver transplantation in rats via inhibition of the NADPH oxidase pathway[J]. Mol Med Rep, 2015, 11(3): 2348. doi: 10.3892/mmr.2014.2924 -





 下载:
下载: