-
宫颈癌是最常见的妇科恶性肿瘤。全世界每年大约有53万宫颈癌新发病例和27万死亡病例,约85%死亡病例发生在发展中国家[1]。宫颈癌发病逐年呈年轻化、上升趋势。尽管宫颈癌现在治疗方法上有手术治疗、化疗、放疗、靶向治疗等多种治疗方式,但宫颈癌发生浸润、转移率仍较高。因此有必要对宫颈癌进行深入研究。明确宫颈癌的浸润、转移发生机制,并采取恰当的治疗措施对宫颈癌病人的治疗有着重要意义。
高尔基体磷酸化蛋白(Golgi phosphoprotein3,GOLPH3)最初在小鼠的高尔基体蛋白质分析时发现,被称为GMx33、GPP34和MIDAS,与酵母Vps74同源。后来经研究[2]发现,它可以调节高尔基质蛋白磷酸化,又命名为高尔基磷酸化蛋白3。GOLPH3是一种高尔基基质蛋白,相对分子质量约34 000,该蛋白由5p13基因编码,从酵母到人类高度保守[3]。GOLPH3基因是新发现的致癌基因。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种可通过旁分泌方式作用于血管内皮细胞的糖蛋白,可以通过诱导血管内皮细胞的分化和成熟,促进新生血管的形成,增加血管的通透性,从而促进癌细胞通过血管进行转移[4],还可促进淋巴管内皮细胞增生,在多种肿瘤的生长、转移中具有重要作用[5]。目前针对GOLPH3和VEGF两者在宫颈癌中的表达关系国内鲜见报道。本研究通过免疫组织化学的方法检测宫颈癌组织中GOLPH3和VEGF蛋白表达情况,探讨两者在宫颈癌组织中表达的相关性,从而为宫颈癌发生、发展、浸润、转移、治疗提供理论依据和新的思路。
-
随机选取2018年3月至2019年8月蚌埠医学院第二附属医院妇产科宫颈癌病人行改良广泛全子宫切除术/广泛行全子宫切除术+盆腔淋巴结清扫术病人术后病理标本43例。所有病人术前均未进行化疗和放疗,术前、术后均行病理检查,术后病理报告证实肿瘤大小、病理类型、分化程度、手术病理分期、淋巴结是否转移。43例病人年龄36~68岁;其中鳞癌40例,腺癌3例;病理分级:高、中分化20例,低分化23例。临床分期:ⅠA2期~ⅠB2期27例,ⅡA1期~ⅡA2期16例,术后经病理证实淋巴结转移31例,无淋巴结转移12例。临床病理分期根据2009年国际妇产科联盟(FIGO)分期。病人临床病理资料均完整。
-
兔抗人GOLPH3多克隆抗体、兔抗人VEGF单克隆抗体购自proteintech公司,生物素标记的羊抗兔IgG抗体,链霉素抗生物素蛋白-过氧化物酶免疫组织化学试剂盒、二氨基联苯显色剂购自北京中杉金桥生物有限公司。
-
所有标本术后均经10%甲醛液固定,石蜡包埋,连续切片,切片厚度4 μm,切片经脱蜡、脱水、水化、热抗原修复,阻断内抗原性过氧化酶活性,滴加非免疫动物血清、一抗、二抗、链霉素抗生物素蛋白-过氧化物酶溶液,经DAB溶液染色、苏木精复染乙醇脱水干燥后,后经二甲苯透明、中性树胶封片,在显微镜下观察结果。
-
由2名经验丰富的病理医生在双盲的情况下,对每张病理切片进行染色和细胞阳性率评分。在400倍镜下每张切片随机选取5个视野进行观察,计数至少500个肿瘤细胞中阳性细胞的表达率。GOLPH3、VEGF阳性蛋白表达在细胞质或细胞核染色,评分标准:不着色为0分,淡黄色为1分,棕黄色为2分,棕色为3分。阳性细胞比例:不着色为0分, < 10%为1分,10%~35%为2分,36%~70%为3分,70%为4分,两者得分相乘>4分为阳性表达,≤4分为阴性表达。
-
采用χ2检验和Pearson相关性分析。
-
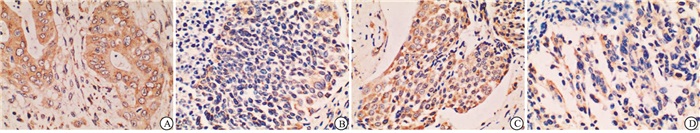
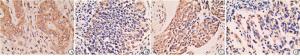
和VEGF的表达情况GOLPH3主要定位于细胞质呈棕黄色颗粒(见图 1A),在宫颈癌组织中阳性表达率72.09%,明显高于宫颈癌旁组织的37.21%(P < 0.01)。VEGF主要定位于细胞质,呈棕黄色颗粒(见图 1C),在宫颈癌组织中阳性表达74.42%,明显高于宫颈癌旁组织中阳性表达率32.56%(P < 0.01)(见表 1)。
分组 n GOLPH3 χ2 P VEGF χ2 P + - + - 宫颈癌组织 43 31 12 32 11 宫颈癌旁组织 43 16 27 10.56 < 0.01 14 29 15.14 < 0.01 合计 86 47 39 46 40 表 1 GOLPH3、VEGF在子宫颈癌及癌旁组织中的表达情况(n)
-
宫颈癌组织中GOLPH3和VEGF的表达与病人的年龄、肿瘤病理类型无相关性(P>0.05),与宫颈癌病人的肿瘤大小、分化程度、手术病理分期、淋巴结转移有相关性(P < 0.05~P < 0.01)。GOLPH3、VEGF在肿瘤直径>4 cm阳性表达率明显高于肿瘤直径≤4 cm(P < 0.05~P < 0.01),GOLPH3、VEGF在低分化宫颈癌组织中阳性表达率高于高、中分化宫颈癌组织(P < 0.05);GOLPH3、VEGF在宫颈癌ⅡA1期~ⅡA2期中的阳性表达率高于宫颈癌ⅠA2期~ⅠB2期(P < 0.05);GOLPH3、VEGF在有淋巴结转移组的阳性表达率明显高于无淋巴结转移组(P < 0.05~P < 0.01)(见表 2)。
临床病理因素 n GOLPH3 χ2 P VEGF χ2 P + - + - 年龄/岁 ≥40
4033
1025
68
4>0.05 1.56 23
810
20.03 >0.05 病理类型 鳞癌
腺癌40
325
215
10.23* >0.05 26
314
00.54# >0.05 肿瘤大小/cm ≤4
>419
249
2210
210.34 < 0.01 10
209
44.74 < 0.05 病理分期 ⅠA2~ⅠB2
ⅡA1~ⅡA227
1615
1412
24.67 < 0.05 12
1215
35.59 < 0.05 分化程度 中、高级
低级20
2311
209
35.43 < 0.05 11
199
43.87 < 0.05 淋巴转移 有
无31
1226
55
75.71* < 0.05 25
46
86.80* < 0.01 *示校正χ2值;#示确切概率法 表 2 GOLPH3和VEGF与宫颈癌各临床病理因素的关系
-
免疫组织化学法显示,在GOLPH3阳性表达组的宫颈癌组织中VEGF阳性表达率为83.87 %(26/31),明显高于GOLPH3阴性表达组33.33%(4/12)(P < 0.01)。Pearson相关性分析显示,GOLPH3蛋白的表达与VEGF的表达呈正相关性(r=0.494, P < 0.01)(见表 3)
GOLP3 n VEGF χ2 P + - + 31 26 5 - 12 4 8 8.22* < 0.01 合计 43 30 13 *示校正χ2值 表 3 GOLPH3、VEGF在子宫颈癌组织中表达的相关性
-
SCOTT等[6]对多种实体肿瘤的5p13基因拷贝数增加进行系统分析,并通过基因敲除实验发现GOLPH3是新的致癌基因,具有影响肿瘤细胞分化、增殖的作用,促进细胞增殖,抑制细胞凋亡的作用。GOLPH3通过参与高尔基体囊泡的转运、蛋白质的糖基化等参与肿瘤的形成。研究[7-9]表明GOLPH3在正常组织中无表达或低表达,而在宫颈癌、子宫内膜癌、卵巢癌中呈高表达。其高表达与相关恶性肿瘤的肿瘤大小、病理分级、临床分期、淋巴结转移有关。SCOTT等[6]研究亦发现GOPLH3过表达时肿瘤体积变大、细胞周期缩短,基因敲除降低GOLPH3表达时,肿瘤体积缩小。抑制GOLPH3表达,可降低细胞的增殖活力和迁移能力。证实GOLPH3具有促进肿瘤细胞增殖,抑制细胞凋亡的作用。正常细胞失去凋亡功能,会导致细胞异常增殖,从而导致肿瘤的发生、发展、浸润、转移。本研究结果显示,GOLPH3在宫颈癌组织中阳性表达率72.09%,明显高于宫颈癌旁组织37.21%,GOLPH3的高表达与宫颈癌的肿瘤大小、分化程度、手术病理分期、淋巴结转移呈正相关性。
VEGF是已知的在肿瘤血管生成中作用最强的血管生成诱导因子。VEGF是一种通过旁分泌方式作用于血管内皮细胞的糖蛋白,可促进血管内皮细胞的增殖、迁移、血管生长,并促进淋巴管内皮细胞增殖和淋巴管增生,在多种恶性肿瘤的生长、转移中具有重要作用[4-5]。VEGF受多种因素的调控,缺氧是导致VEGF分泌的重要因素[10]。宫颈癌细胞的增殖、生长会消耗大量的氧气与营养,从而导致缺氧和供血不足,宫颈癌血管组织紊乱,导致缺氧微环境形成,宫颈癌细胞在缺氧环境时,会引起缺氧诱导因子1α(HIF-1α)的释放,使HIF-1α高表达,引起其下游靶基因VEGF的表达增加,促进宫颈癌新生血管生成、增加血管通透性,侵袭能力增强,造成宫颈癌的侵袭、转移。本研究结果显示,VEGF的表达在宫颈癌组织的阳性表达率明显高于宫颈癌旁组织的阳性表达率,VEGF的高表达与宫颈癌病人的肿瘤大小、病理分级、手术病理分期、淋巴结转移有关,VEGF的高表达促进了宫颈癌的浸润、转移。
本研究结果显示GOLPH3和VEGF与宫颈癌的肿瘤大小、分化程度、手术病理分期、淋巴结转移有关,二者在宫颈癌的浸润、转移中有协同作用。经相关性分析GOLPH3、VEGF在宫颈癌中呈正相关性。其机制GOLPH3通过调节PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target ofrapamycin, mTOR)通路,促进了VEGF表达。PI3K/AKT/mTOR信号通路是细胞调节增殖、侵袭的关键信号通路,宫颈癌病情进展过程中PI3K/AKT/mTOR信号通路的过度激活能改变多种增殖侵袭基因的表达,进而促进癌细胞的增殖、侵袭[11]。细胞外基质的水解是促进癌细胞侵袭的基本环节,细胞外基质的水解及细胞运动均需要肿瘤新生血管来提供营养及能量。GOLPH3有促进细胞增殖,抑制细胞凋亡的作用。细胞异常增殖,凋亡减少时会发生癌变,宫颈癌细胞生长时会消耗氧气与营养,从而导致缺氧和供血不足,缺氧时会刺激HIF-1α的表达,HIF-1α在氧浓度低于6%时才表达,HIF-1α在肿瘤缺氧环境中促进VEGF对肿瘤内环境稳态的调节,刺激肿瘤血管生长,促进肿瘤细胞大量生长与增殖[12]造成宫颈癌细胞的浸润、转移。
综上所述,宫颈癌组织中GOLPH3、VEGF的阳性表达与宫颈癌的浸润、转移密切相关,提示二者在宫颈癌的浸润、转移中有协同作用,在宫颈癌组织中过表达的GOLPH3能上调VEGF的表达,从而促进宫颈癌组织中新生血管形成,促进宫颈癌的浸润、转移。中断肿瘤血管的血供、阻止血管形成可导致肿瘤细胞的坏死、抑制肿瘤细胞生长。VEGF现被认为是肿瘤治疗的抗血管治疗靶点。VEGF拮抗剂如: 伐珠单抗、舒尼替尼、索拉非尼、阿帕替尼已在临床应用,并对治疗肿瘤的浸润、转移取得了较好的治疗效果。因此,联合检测GOLPH3和VEGF的表达,对明确宫颈癌浸润、转移机理,临床预后的判断及丰富宫颈癌的靶向治疗有一定的临床指导意义。
GOLPH3和VEGF在宫颈癌组织中的表达及临床意义
Expression level and clinical significance of GOLPH3 and VEGF in cervical cancer
-
摘要:
目的通过检测宫颈癌组织中高尔基体鳞酸化蛋白3(GOLPH3)与血管内皮生长因子(VEGF)表达水平,探讨二者在宫颈癌组织中浸润、转移的相互关系。 方法通过免疫组织化学SP法检测43例手术切除的宫颈癌组织及宫颈癌旁组织中GOLPH3和VEGF蛋白表达情况。GOLPH3与VEGF在宫颈癌组织表达的相关性用Pearson相关性分析。 结果GOLPH3和VEGF在宫颈癌组织中的阳性表达率为72.1%、74.42%,显著高于宫颈癌旁组织的37.21%、32.56%(P < 0.01)。GOLPH3、VEGF在宫颈癌组织中的表达与病人的肿瘤大小、分化程度、手术病理分期、淋巴结转移有显著相关性(P < 0.05~P < 0.01),与病人年龄、病理类型无明显相关性(P>0.05)。免疫组织化学结果显示,在GOLPH3阳性表达组的宫颈癌组织中VEGF阳性表达率为83.87%,明显高于GOLPH3阴性表达组的33.33%(P < 0.01),宫颈癌组织中GOLPH3表达与VEGF的表达呈正相关性(r=0.494, P < 0.01)。 结论GOLPH3过表达通过上调VEGF的表达促进宫颈癌的癌组织中血管生成,从而促进了宫颈癌的浸润和转移。 -
关键词:
- 宫颈肿瘤 /
- 高尔基体磷酸化蛋白3 /
- 血管内皮生长因子
Abstract:ObjectiveTo detect the expression levels of Golgi phosphoprotein 3(GOLPH3)and vascular endothelial growth factor(VEGF)in cervical cancer tissues, and explore their relationship in invasion and metastasis of cervical cancer. MethodsThe expression levels of GOLPH3 and VEGF proteins in cervical carcinoma tissues and para-cervical cancer tissues of 43 patients were detected using immunohistochemical SP method.The correlations of GOLPH3 and VEGF levels in cervical cancer tissues were analyzed using Pearson correlation analysis. ResultsThe positive expression rates of GOLPH3 and VEGF in cervicer cancer tissues were 72.1% and 74.42%, respectively, which were significantly higher than those in para-cervical cancer tissues(37.21% and 32.56%)(P < 0.01).The expression levels of GOLPH3 and VEGF in cervical cancer tissue were significantly correlated with the tumor size, differentiation, surgical and pathological stage, and lymph node metastasis(P < 0.05 to P < 0.01), and not significantly correlated with the age and pathological type of patients(P>0.05).The results of immunohistochemistry showed that the positive expression rate of VEGF in cervical cancer tissues with positive GOLPH3 expression group(83.87%)was significantly higher than that in negative GOLPH3 expression group(33.33%)(P < 0.01).The expression rate of GOLPH3 was positively correlated with VEGF expression in cervical cancer tissues(r=0.494, P < 0.01). ConclusionsThe overexpression of GOLPH3 promotes the angiogenesis in cervical cancer tissues by upregulating the expression of VEGF, which leads to the invasion and metastasis of cervical cancer. -
表 1 GOLPH3、VEGF在子宫颈癌及癌旁组织中的表达情况(n)
分组 n GOLPH3 χ2 P VEGF χ2 P + - + - 宫颈癌组织 43 31 12 32 11 宫颈癌旁组织 43 16 27 10.56 < 0.01 14 29 15.14 < 0.01 合计 86 47 39 46 40 表 2 GOLPH3和VEGF与宫颈癌各临床病理因素的关系
临床病理因素 n GOLPH3 χ2 P VEGF χ2 P + - + - 年龄/岁 ≥40
4033
1025
68
4>0.05 1.56 23
810
20.03 >0.05 病理类型 鳞癌
腺癌40
325
215
10.23* >0.05 26
314
00.54# >0.05 肿瘤大小/cm ≤4
>419
249
2210
210.34 < 0.01 10
209
44.74 < 0.05 病理分期 ⅠA2~ⅠB2
ⅡA1~ⅡA227
1615
1412
24.67 < 0.05 12
1215
35.59 < 0.05 分化程度 中、高级
低级20
2311
209
35.43 < 0.05 11
199
43.87 < 0.05 淋巴转移 有
无31
1226
55
75.71* < 0.05 25
46
86.80* < 0.01 *示校正χ2值;#示确切概率法 表 3 GOLPH3、VEGF在子宫颈癌组织中表达的相关性
GOLP3 n VEGF χ2 P + - + 31 26 5 - 12 4 8 8.22* < 0.01 合计 43 30 13 *示校正χ2值 -
[1] WRDAK S.Human Papillomavirus(HPV)and cervical cancer[J]. Med Dosw Mikrobiol, 2016, 68(1): 73. [2] SNYDER CM, MARDONES GA, LADINSKY MS, et al. GMx33 associates with the trans-Golgi matrix in a dynamic manner and sorts within tubules exiting the Golgi[J]. Mol Biol Cell, 2006, 17(1): 511. doi: 10.1091/mbc.e05-07-0682 [3] MARSH BJ, HOWELL KE.The mammalian Golgi——complex debates[J]. Nat Rev Mol Cell Biol, 2002, 3(10): 789. doi: 10.1038/nrm933 [4] 任志, 马振增, 王启之, 等. 幽门螺杆菌感染病人胃癌组织中MMP-7、VEGF的表达及相关性研究[J]. 蚌埠医学院学报, 2020, 45(6): 739. [5] YANG GL, LI LY.Counterbalance: modulation of VEGF/VEGFR activities by TNFSF15[J]. Signal Transduct Target Ther, 2018, 3: 21. doi: 10.1038/s41392-018-0023-8 [6] SCOTT KL, KABBARALL O, LIANG MC, et al. GOLPH3 modulates mTOR signalling and rapamycin sensitivity in cancer[J]. Nature, 2009, 459(7250): 1085. doi: 10.1038/nature08109 [7] 王莉, 孙云燕, 李冬冬, 等. GOLPH3通过P13k/Akt信号通路调控上皮性卵巢癌细胞增殖与凋亡的研究[J]. 现代妇产科进展, 2018, 27(9): 648. [8] 于莉娜, 田燕, 赵佩佩, 等. GOLPH3在6种肿瘤中的表达特点[J]. 贵州医科大学学报, 2019, 44(5): 530. [9] 王镇南, 黄海丽, 黄颢, 等. GOLPH3基因对宫颈癌细胞Hela迁移和侵袭能力的影响[J]. 广东医科大学学报, 2017, 35(2): 136. doi: 10.3969/j.issn.1005-4057.2017.02.009 [10] 张诗武, 孙保存, 张丹芳, 等. 不同微环境对黑色素瘤细胞侵袭能力和局部微循环模式形成的影响[J]. 中华病理学杂志, 2007, 36(12): 832. doi: 10.3760/j.issn:0529-5807.2007.12.009 [11] 陈凤霞. 宫颈癌病情进展过程中PI3K/AKT/mTOR信号通路的变化及靶基因的探究[J]. 海南医学院学报, 2018, 24(19)1757. [12] 夏一丹, 谢兰, 何文静, 等. HIF-1α和VEGF在宫颈癌变过程中的表达及临床意义[J]. 医学理论与实践, 2018, 31(1): 18. -




 下载:
下载: