-
主动脉瓣狭窄(AS)为常见主动脉瓣疾病之一, 多种原因均可以引发AS,如风湿性心脏病、老年型退行性变、先天性畸形等[1]。退行性AS是最常见的获得性瓣膜性心脏病,随着人口老龄化,其患病率逐渐增加[2]。肺动脉高压(PH)在严重AS病人中出现率达75%,它预示着更严重的疾病和主要的心血管不良事件,以及无论手术或介入治疗都会增加其死亡率[3]。有研究[4-5]发现,AS病人心血管长期慢性压力超负荷,反映心肌结构和生物学变化的生物标志物可以预测病人是否存在心血管事件的风险。然而,关于生物标志物对严重AS病人PH发展影响的数据还很缺乏。本研究旨在探讨生物标志物N端pro B型钠尿肽(NT-proBNP)和生长分化因子-15(GDF-15)与常规超声心动图参数对预测重度AS病人PH发生发展的影响。现作报道。
-
选择2016年6月至2018年10月重度AS病人60例,根据有无PH将60例病人分为PH组和无PH组。60例病人主动脉瓣有效瓣口面积 < 1 cm2,在主动脉瓣置换(AVR)前进行二维多普勒超声心动图评价及NT-proBNP、GDF-15检测。入选标准排除冠心病、慢性肺部疾病、心房纤颤和中度-重度二尖瓣返流及肝肾功能异常的病人。PH组18例,平均术前肺动脉收缩压(PSP)(58.6±11.5)mmHg,无PH组42例,平均PSP(34.5±4.9)mmHg。2组病人性别、年龄等一般资料差异均无统计学差异(P>0.05)(见表 1),具有可比性。
分组 n 男 女 年龄/岁 体质量指数/(kg/m2) 高血压 糖尿病 无PH组 42 22 20 67±9 27.8±4.5 34 4 PH组 18 8 10 70±10 26.9±5 14 2 t — 1.84* 2.10 0.16 1.19* 1.50* P — > 0.05 > 0.05 > 0.05 > 0.05 > 0.05 *示χ2值 表 1 2组病人一般资料比较(x±s)
-
设备采用飞利浦IE33型彩色多普勒超声诊断仪,配备X5-1探头。研究对象由经验丰富的超声心动图医生进行图像及数据采集,操作者对病人的临床资料不了解,以减少主观因素对超声检测结果的影响。主动脉瓣口面积(AVA)利用胸骨旁左心室长轴切面收缩中期测量左心室流出道宽度(LVOT)最大内径,利用连续方程法测定瓣口速度时间积分,即可得到AVA[6]。Simpson法计算左心室射血分数(LVEF)。心尖四腔观用频谱多普勒及组织多普勒分别测量二尖瓣口舒张期血流速度E、A峰和舒张早期二尖瓣环速度E′,并计算E/E′比值。并测量E峰减速时间(MVDT)。收缩末期双平面面积长度法计算左心房容积。于心尖四腔观,通过三尖瓣反流速度图,获取右房室瓣最大跨瓣压差PG=4V2,以下腔静脉内径变化率为依据估测右心房压(RAP),PSP=PG+RAP[7]。本研究PSP≥45 mmHg诊断为PH。
-
在AVR前24 h采集血浆,立即交检测,计算NT-proBNP。采用ELISA技术测定GDF-15。并检测病人肝肾功能。
-
采用t检验、χ2检验、logistic回归分析以及Pearson相关分析。
-
2组间主动脉瓣口面积及LVEF差异无统计学意义(P > 0.05)。PH组左心室内径较无PH组增大,但差异无统计学意义(P > 0.05),2组左心室心肌质量指数差异亦无统计学意义(P > 0.05)。PH组E/E′、左心房容积大于无PH组(P < 0.05和P < 0.01),MVDT小于无PH组(P < 0.05)(见表 2)。
分组 n 主动脉瓣口面积/cm2 左心室舒张末内径指数/(mm/m2) 左心室心肌质量指数/(g/m2) LVEF/% 左心房容积/mL PSP/mmHg E/E′ MVDT/ms 无PH组 42 0.81±0.18 24.2±3.8 130.3±35.5 51±9 89.9±25.6 34.5±4.9 13.5±5.2 236.7±51.4 PH组 18 0.79±0.21 28.1±2.8 141.6±42.8 49±8 115.1±34.7 58.6±12.5 18.5±8.7 190.6±53.8 t — 2.30 1.71 0.43 1.20 10.40 14.10 5.83 18.26 P — > 0.05 > 0.05 > 0.05 > 0.05 < 0.01 < 0.01 < 0.05 < 0.05 表 2 2组病人超声心动图参数比较(x±s)
-
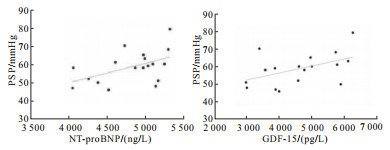
AS病人NT-proBNP和GDF-15均高于正常上限。PH组病人NT-proBNP、GDF-15均高于无PH组(P < 0.05)(见表 3)。2组病人NT-proBNP、GDF-15均随PSP的升高而升高(P < 0.01)(见图 1)。生物标志物GDF-15和NT-proBNP联合应用增强了与PSP的相关性(r=0.640, P < 0.01)。单因素logistic回归分析中发现,E/E′、MVDT、左心房容积、NT-proBNP、GDF-15是PSP>45 mmHg的影响因素,E/E′比值>14、MVDT>177.5 ms、左心房容积>100 mL是严重AS病人发生PH的独立预测因子,NT-proBNP、GDF-15升高是预测PH的可靠指标(P < 0.01)(见表 4)。
分组 n NT-proBNP/(ng/L) GDF-15/(pg/L) 无PH组 42 710.1±329.5 3 158.2±1 560.7 PH组 18 4 805.0±406.9 4 530.0±1 076.5 t — 42.83 5.81 P — < 0.05 < 0.05 表 3 2组病人生物标志物水平的比较
变量/阈值 B SE Waldχ2 P OR(95%CI) E/E′>14 1.78 0.74 2.40 < 0.01 6.102(1.421~25.581) DT≤176.5 ms 2.3 0.75 3.07 < 0.01 9.341(2.083-41.244) 左心房容积>100 mL 2.25 0.83 2.71 < 0.01 9.690(1.912~49.132) NT-proBNP>4 050 ng/L 2.6 0.77 3.78 < 0.01 12.643(2.828~56.012) GDF-15>3 403 pg/mL 2.8 1.04 2.69 < 0.01 18.429(2.409~140.403) 表 4 logistic回归分析重度AS病人PH风险率
-
本研究评估了重度AS病人PSP的水平,结果发现伴有重度AS的病人PSP值与左心室舒张功能障碍程度以及生物标志物水平升高有关。有研究[3, 8]报道,AS病人PH患病率高,PH的发展与经导管或手术AVR后临床结局差、预后不良显著相关,检测PH相关的参数具有重要意义。我们的研究中发现左心室舒张功能障碍是AS病人PH的预测因子,而不是左心室收缩功能。以往有研究[9]也同样认为,在AS病人中左心室收缩功能与PH无关。国内代雪等[10]研究认为, 当心脏收缩功能减低和舒张功能障碍并存时,左心室舒张功能障碍是反映PH严重性的决定因素。而在左心室收缩功能障碍或非AS病人的一些研究中可能存在不同[11]。本研究中PH组和无PH组病人LVEF差异无统计学意义(P>0.05)。LVEF在检测细微的心肌收缩功能障碍方面敏感性不够,因此在预测AS病人左心室收缩功能对PH的影响存在一定的限制或不足[12-13]。
另有研究[9, 14]认为PH与左心室舒张功能与更高的左心室充盈压力有关。AS病人PSP值并不总是与AS的严重程度密切相关,但与左心室舒张末压密切相关[15]。伴有中度或重度二尖瓣返流的AS病人左心房压力增高[16],而本研究将二尖瓣中重度反流病人排除在外。左心室舒张功能参数对严重AS病人主动脉瓣术前PSP水平升高的预后具有重要意义。在本研究中, 严重的左心室舒张功能障碍参数E/E′>14、MVDT≤176.5 ms、左心房容积>100 mL是重度AS病人AVR术前PH独立预测指标(P < 0.01)。而且,谭羽莹等[11]研究发现,E/E′及左心房容积在PH中度组及重度组中明显升高,而且左心房容积变化与舒张功能相关性优于E/E′,更能反映肺动脉压升高的变化。
除了超声心动图参数,本研究中生物标志物NT-proBNP和GDF-15数值的增加与PH也具有显著的相关性(P < 0.01)。NT-proBNP和GDF-15对于心力衰竭诊断、危险分层和预后评估等,已成为国内外心衰发病机制的研究热点[17-18]。尽管NT-proBNP并不是心脏病的特异性标志物,但其循环水平在PH病人中显著升高,与疾病严重程度和死亡率相关[19]。钠尿肽是唯一广泛应用于AS病人的生物标志物,但其在临床管理决策中的作用尚未明确。有指南表明[20],对于无症状的重症病人,如果血钠肽水平显著升高,可以考虑进行瓣膜置换术(Ⅱa级推荐)。NT-proBNP>4 050 ng/L的截断值仍然是本研究中严重AS病人PH的可靠预测指标,NT-proBNP正常范围值不适合于本组病人,因为所有入选病人左心室充血压力均长期升高,半数病人为NYHA功能3~4级,几乎所有病人NT-proBNP均高于正常范围。GDF-15是一种应激反应性细胞因子,其表达在心肌细胞中受到各种应激源的上调,包括压力负荷的不断增加[21]。越来越多的研究表明,GDF-15可用于心血管疾病危险分层和药物或心脏手术治疗预后评估的新的生物标志物[22-23]。有报道[24]认为,在经导管AVR病人中,GDF-15水平在预测风险方面优于NT-proBNP。本研究中,GDF-15值> 3 403 pg/mL是PH的独立预测因子(P < 0.01),GDF-15与PSP呈中度相关。无论是单独使用GDF-15或NT-proBNP,还是同时使用这两种生物标志物,都可以提高AS病人的诊断准确性。
尽管如此,本研究样本量相对较小,统计学难免存在偏差。另外,未使用无创心导管测量左心室充盈压和肺动脉压。综上,左心室舒张功能障碍和生物标志物水平升高在预测严重AS病人PH发生发展方面具有很重要价值。左心室舒张功能参数与生物标志物水平可用于寻找高危无症状的重度AS病人,为重度AS病人在发生PH前进行早期手术治疗提供依据。
重度主动脉瓣狭窄病人左心室舒张功能及生物标志物水平对预测肺动脉高压的价值
The value of left ventricular diastolic function and biomarker level in predicting pulmonary hypertension in patients with severe aortic stenosis
-
摘要:
目的探讨生物标志物联合左心室舒张功能常规超声心动图参数对重度主动脉瓣狭窄(AS)病人术前肺动脉收缩压(PSP)升高的预测价值。 方法选择60例重度AS(主动脉瓣面积 < 1 cm2)病人, PSP≥45 mmHg诊断为肺动脉高压(PH),根据有无PH分为PH组18例和无PH组42例。行常规超声心动图、N端pro B型钠尿肽(NT-proBNP)和生长分化因子-15(GDF-15)检测。超声心动图评价PSP、左心室射血分数(LVEF)、左心室舒张功能参数E/E'、二尖瓣减速时间(MVDT)、左心房容积。分析左心室舒张功能参数及生物标志物水平与PSP的相关性。 结果PH组E/E'、左心房容积大于无PH组(P < 0.05和P < 0.01),MVDT小于无PH组(P < 0.05)。AS病人NT-proBNP和GDF-15均高于正常上限。PH组病人NT-proBNP、GDF-15均高于无PH组(P < 0.05)。2组病人NT-proBNP、GDF-15均随PSP的升高而升高(P < 0.01)。E/E'比值>14、MVDT>177.5 ms、左心房容积>100 mL是严重AS病人发生PH的独立预测因子,NT-proBNP、GDF-15升高是预测PH的可靠指标(P < 0.01)。 结论左心室舒张功能障碍和生物标志物水平升高可预测重度AS病人PH的发生与发展,为临床早期干预提供依据。 Abstract:ObjectiveTo investigate the predictive value of biomarker combined with conventional echocardiographic parameters of left ventricular diastolic function in preoperative pulmonary systolic pressure(PSP)in patients with severe aortic stenosis(AS). MethodsSixty patients with severe AS(aortic valve area < 1 cm2)were selected.The PSP ≥ 45 mmHg was diagnosed as the pulmonary arterial hypertension(PH), and the patients were divided into the PH group(18 cases)and nonPH group(42 cases).The routine echocardiography, N-terminal Pro B natriuretic peptide(NT-proBNP)and growth differentiation factor-15(GDF-15)were analyzed.The PSP, left ventricular ejection fraction(LVEF), left ventricular diastolic function parameters E/E', mitral valve deceleration time(MVDT)and left atrial volume were evaluated.The correlation between left ventricular diastolic function parameters and biomarker level, and PSP were analyzed. ResultsThe E/E' and left atrial volume in PH group were larger than those in nonPH group(P < 0.05 and P < 0.01), and the MVDT in PH group was less than that in nonPH group(P < 0.05).The levels of NT-proBNP and GDF-15 in AS patient were above the normal upper limit.The levels of NT-proBNP and GDF-15 in PH group were higher than those in nonPH group(P < 0.05).The levels of NT-proBNP and GDF-15 in two groups increased with the increasing of PSP(P < 0.01).The ratio of E/E' >14, MVDT>177.5, left atrial volume >100 mL are the independent predictors of PH occurrence in severe patients, and the levels increasing of NT-proBNP and GDF-15 were the reliable predictors of predictive PH(P < 0.01). ConclusionsThe increasing of the levels of left ventricular diastolic dysfunction and biomarkers can predict the development of pulmonary hypertension in patients with severe AS, and it can provide a basis for early intervention in pulmonary hypertension. -
表 1 2组病人一般资料比较(x±s)
分组 n 男 女 年龄/岁 体质量指数/(kg/m2) 高血压 糖尿病 无PH组 42 22 20 67±9 27.8±4.5 34 4 PH组 18 8 10 70±10 26.9±5 14 2 t — 1.84* 2.10 0.16 1.19* 1.50* P — > 0.05 > 0.05 > 0.05 > 0.05 > 0.05 *示χ2值 表 2 2组病人超声心动图参数比较(x±s)
分组 n 主动脉瓣口面积/cm2 左心室舒张末内径指数/(mm/m2) 左心室心肌质量指数/(g/m2) LVEF/% 左心房容积/mL PSP/mmHg E/E′ MVDT/ms 无PH组 42 0.81±0.18 24.2±3.8 130.3±35.5 51±9 89.9±25.6 34.5±4.9 13.5±5.2 236.7±51.4 PH组 18 0.79±0.21 28.1±2.8 141.6±42.8 49±8 115.1±34.7 58.6±12.5 18.5±8.7 190.6±53.8 t — 2.30 1.71 0.43 1.20 10.40 14.10 5.83 18.26 P — > 0.05 > 0.05 > 0.05 > 0.05 < 0.01 < 0.01 < 0.05 < 0.05 表 3 2组病人生物标志物水平的比较
分组 n NT-proBNP/(ng/L) GDF-15/(pg/L) 无PH组 42 710.1±329.5 3 158.2±1 560.7 PH组 18 4 805.0±406.9 4 530.0±1 076.5 t — 42.83 5.81 P — < 0.05 < 0.05 表 4 logistic回归分析重度AS病人PH风险率
变量/阈值 B SE Waldχ2 P OR(95%CI) E/E′>14 1.78 0.74 2.40 < 0.01 6.102(1.421~25.581) DT≤176.5 ms 2.3 0.75 3.07 < 0.01 9.341(2.083-41.244) 左心房容积>100 mL 2.25 0.83 2.71 < 0.01 9.690(1.912~49.132) NT-proBNP>4 050 ng/L 2.6 0.77 3.78 < 0.01 12.643(2.828~56.012) GDF-15>3 403 pg/mL 2.8 1.04 2.69 < 0.01 18.429(2.409~140.403) -
[1] 刘瑞双, 徐原宁, 陈茂. 重度主动脉瓣狭窄行TAVR治疗方案临床效果的循证病案讨论[J]. 中国循证医学杂志, 2017, 17(2): 243. [2] 高健萱, 张恒. 经导管主动脉瓣置入术治疗老年退行性心脏瓣膜病研究进展[J]. 蚌埠医学院学报, 2019, 44(2): 279. [3] MAEDER MT, WEBER L, BUSER M, et al. Pulmonary hypertension in aortic and mitral valve disease[J]. Front Cardiovasc Med, 2018, 23, 5: 40. [4] SINNING JW, WOLLERT KC, SEDAGHAT A, et al. Risk scores and biomarkers for the prediction of 1-year outcome after transcatheter aortic valve replacement[J]. Am Heart J, 2015, 170(4): 821. doi: 10.1016/j.ahj.2015.07.003 [5] REDFORS B, FURER A, LINDMAN BR, et al. Biomarkers in aortic stenosis: a systematic review[J]. Structural Heart, 2017, 1: 18. doi: 10.1080/24748706.2017.1329959 [6] 任永凤, 王洲, 李健, 等. 2D-STI评价亚临床型重度主动脉瓣狭窄病人左心室功能及相关性研究[J]. 蚌埠医学院学报, 2019, 44(3): 366. [7] 王新房, 谢明星. 超声心动图学[M]. 5版. 北京: 人民卫生出版社, 2017: 711. [8] ALUSHI B, BECKHOFF F, LEISTNER D, et al. Pulmonary hypertension in patients with severe aortic stenosis: prognostic impact after transcatheter aortic valve replacement: Pulmonary hypertension in patients undergoing TAVR[J]. JACC Cardiovasc Imaging, 2019, 12(4): 591. doi: 10.1016/j.jcmg.2018.02.015 [9] AHN HS, CHANG SA, KIM HK, et al. Determinants of pulmonary hypertension development in moderate or severe aortic stenosis[J]. Int J Cardiovasc Imaging, 2014, 30(8): 1519. doi: 10.1007/s10554-014-0498-5 [10] 代雪, 王珂. 左心疾病相关性肺高压的病因研究和临床特征分析[J]. 中国心血管病研, 2018, 2(16): 163. [11] 谭羽莹, 王小丛, 徐晶, 等. 三维斑点追踪成像结合二维超声评价不同程度肺动脉高压病人左心功能[J]. 中国医学影像学杂志, 2017, 25(9): 678. doi: 10.3969/j.issn.1005-5185.2017.09.012 [12] 任永凤, 郑慧, 王洲. 二维斑点追踪技术评价维持性血液透析病人左心室整体收缩功能及肺动脉高压影响因素研究[J]. 中国全科医学, 2016, 19(3): 359. doi: 10.3969/j.issn.1007-9572.2016.03.026 [13] 刘文旭, 赵映, 何怡华, 等. 二维斑点追踪技术评价不同程度主动脉瓣狭窄患者左心室收缩功能[J]. 心肺血管病杂志, 2014, 33(3): 410. doi: 10.3969/j.issn.1007-5062.2014.03.026 [14] RAINA A, GERTZ ZM, O'DONNELL WT, et al. Pulmonary hypertension is a manifestation of congestive heart failure and left ventricular diastolic dysfunction in octogenarians with severe aortic stenosis[J]. Pulm Circ, 2015, 5(3): 521. doi: 10.1086/682226 [15] CASACLANG-VERZOSA G, NKOMO VT, SARANO ME, et al. E/Ea is the major determinant of pulmonary artery pressure in moderate to severe aortic stenosis[J]. J Am Soc Echocardiogr, 2008, 21(7): 824. doi: 10.1016/j.echo.2007.12.002 [16] KAPOOR N, VARADARAJAN P, PAI RG.Echocardiographic predictors of pulmonary hypertension in patients with severe aortic stenosis[J]. Eur J Echocardiogr, 2008, 9(1): 31. [17] 李文霞, 陈漠水, 张光星, 等. GDF-15在扩张型心肌病患者中的变化及其与NT-proBNP的关系[J]. 中国循证心血管医学杂志, 2017, 9(9): 1055. doi: 10.3969/j.issn.1674-4055.2017.09.09 [18] GAGGIN HK, SYMONIFKA J, BHARDWAJ A, et al. Head-to-head comparison of serial soluble ST2, growth differentiation factor-15, and highly- sensitive troponin T measurements in patients with chronic heart failure[J]. JACC Heart Fail, 2014, 2(1): 65. doi: 10.1016/j.jchf.2013.10.005 [19] CASSERLY B, KLINGER JR.Brain natriuretic peptide in pulmonary arterial hypertension: Biomarker and potential therapeutic agent[J]. Drug Des Devel Ther, 2009, 29(3): 269. [20] BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease[J]. Rev Esp cardiol(Engl Ed), 2018, 71(2): 110. [21] WOLLERT KC, KEMPF T.Growth differentiation factor 15 in heart failure: an update[J]. Curr Heart Fail Rep, 2012, 9(4): 337. doi: 10.1007/s11897-012-0113-9 [22] HERINGLAKE M, CHARITOS EI, GATZ N, et al. Growth differentiation factor 15: a novel risk marker adjunct to the Euroscore for risk stratification in cardiac surgery patients[J]. J Am Coll Cardiol, 2013, 61(6): 672. doi: 10.1016/j.jacc.2012.09.059 [23] IKEDA Y, KUMAGAI H, MOTOZAWA Y, et al. Growth differentiation factor 15(GDF-15)as a reliable biomarker for cardiovascular risk assessment[J]. Int Heart J, 2016, 57(1): 1. doi: 10.1536/ihj.15-324 [24] KRAU NC, LUNSTEDT NS, FREITAG-WOLF S, et al. Elevated growth differentiation factor 15 levels predict outcome in patients undergoing transcatheter aortic valve implantation[J]. Eur J Heart Fail, 2015, 17(9): 945. doi: 10.1002/ejhf.318 -




 下载:
下载: