-
原发性肝癌是临床上常见的恶性肿瘤,具有双重血供的特点,增长迅速,易转移,而肿瘤的异常微循环是肝癌发生、发展的重要因素,因此本研究使用GE Revolution CT对肝癌病人行CT灌注成像,了解肝癌组织、邻近肝组织及较远肝组织的微循环变化规律,并结合血清甲胎蛋白(AFP)、糖类抗原199(CA199)、谷氨酸氨基转移酶(GGT), 探讨它们与癌组织CT灌注参数间的相关性。现作报道。
-
2018年3月至2019年4月收集来蚌埠医学院第一附属医院住院的原发性肝癌病人20例,男17例,女3例,年龄46~78岁。入组标准:有完整的肝功能结果及影像学资料,经临床、实验室及影像学检查或肝脏活检证实为原发性肝癌病人;影像学检查证无门脉癌栓形成;病人对碘不过敏;无心血管疾病。排除标准:有严重黄疸、全身广泛转移、门静脉主干完全阻塞的。所有病人均自愿签署知情同意书后进行检查。
-
病人检查前4 h禁食禁水,扫描前进行碘过敏试验,嘱咐病人尽量平静呼吸,保持仰卧位,双手置于头枕两侧。采用GE revolution CT行上腹部CT增强扫描,采用高压注射器经肘正中静脉注射0.9%氯化钠溶液20 mL,速率5 mL/s,而后以相同速率注入碘佛醇(350 mgI/mL)90 mL,再跟注20 mL 0.9%氯化钠溶液。注射造影剂5 s后行CTP扫描,采用轴扫模式,管电压80 kV,管电流150 mA,矩阵512×512,SFOV 50 cm,旋转时间是0.5 s;扫描层厚和层间距5 mm,重建层厚和层间隔1.25 mm。注射对比剂后采用螺旋扫描获得肝脏静脉期及平衡期图像。图像分析与处理: 将扫描后的图像传输到后处理工作站GE AW 4.7,使用CT perfusion 4D软件进行处理,获得血容量(BV)、血流速(BF)、平均通过时间(MTT)、肝动脉分数(HAF)、表面通透性(PS)灌注伪彩图。
-
所有受检者CT灌注成像图像均由2名经验丰富影像医师评价,对病灶、近肿瘤肝组织及远离肿瘤肝组织画感兴趣区(ROI),避开肉眼可见的胆管及血管,分别记录参数数值;肝癌ROI从病灶实质部分选择,选取肿瘤面积最大部分进行分析;邻近肝组织ROI选择紧邻肿瘤的最大灌注区;较远肝组织ROI选择肿瘤相邻肝叶的肝组织区域。
-
采用方差分析和q检验、Pearson相关分析。
-
3组HAF、BV、BF、PS值的关系:A组>B组>C组(P < 0.01),3组MTT值的关系:A组 < B组 < C组(P < 0.01)(见表 1)。
分组 n HAF BV/(mL/100 g) BF/[mL·(100 g)-1·min-1] PS/[mL·(100 g)-1·min-1] MTT/s A组 20 0.81±0.12 23.34±4.19 187.34±16.33 25.58±3.77 5.47±0.88 B组 20 0.49±0.14** 12.68±2.36** 83.51±17.19** 14.05±3.32** 8.63±0.81** C组 20 0.25±0.08**△△ 8.49±1.61**△△ 54.54±12.77**△△ 7.95±1.5**△△ 15.46±2.72**△△ F — 118.74 136.66 403.79 174.88 176.88 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.013 8.577 241.527 9.173 2.946 q检验:与A组比较**P < 0.01;与B组比较△△P < 0.01 表 1 肝癌组织与周围肝组织CT灌注参数比较(x±s)
-
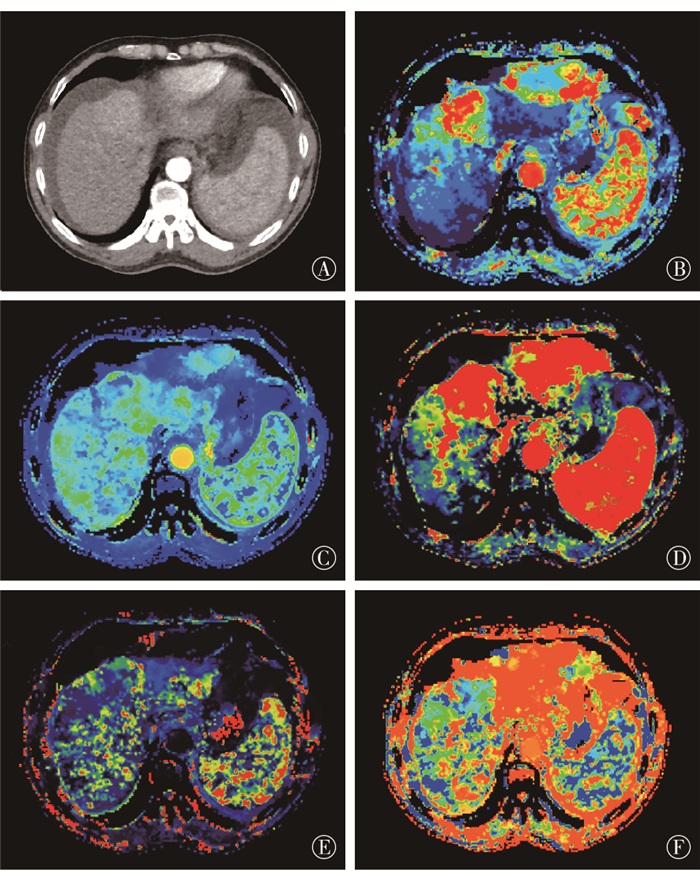
肝癌组织内各灌注参数与周围无肿瘤肝组织存在明显统计学差异,相对应全肝灌注伪彩图,发现如下特点:肝癌组织呈明显不均匀高灌注表现,病灶范围较普通增强检查稍大,病灶内部伪彩颜色深浅分布不均,说明了肝癌组织增殖速度快、各部分生长不平衡,符合其恶性肿瘤的特征;肿瘤周围肝组织由近及远可以发现伪彩颜色深浅的变化,说明距离肿瘤较远肝组织呈相对低灌注表现,距离病灶较近肝实质灌注量相对较高(见图 1)。
-
GGT与PS作直线相关分析,GGT与PS间存在正相关关系(r=0.639, P < 0.05)。GGT与MTT间存在负相关关系(r=-0.577, P < 0.05)。余参数间无明显相关性(见图 2、3)。
-
肝癌发病率和病死率在恶性肿瘤中分别位居第5和第2位[1],近年,随着早期诊断及肿瘤治疗技术的发展,其发病率和死亡率呈下降趋势,但由于肝脏的强大代偿功能和血运丰富的结构特点,肝癌生长迅速和易发生转移,病人的5年存活率并不理想,仅为20%~30%[2-3], 因此探明肝癌发生后进展及转移的机制,对控制其发展、针对性的治疗及预后疗效评价具有重要意义。
肿瘤指标 HAF BV BF PS MTT AFP 0.039 0.254 0.024 0.311 -0.344 CA199 -0.271 -0.170 0.003 -0.086 0.116 GGT -0.206 -0.003 0.116 0.639 -0.577 表 2 AFP、CA199、GGT与HAF、BV、BF、PS、MTT相关系数(r)
肝癌的微循环与肝癌的发生发展息息相关,异常的微循环能够为癌细胞的增殖提供持续的能量和营养[4-5]。而微血管生成的紊乱又是导致肝癌微循环异常的关键性因素, 因此肿瘤微血管生成是肿瘤所致的最重要的血运改变,对肿瘤的生长、分级、转移、预后等有非常重要的影响[6-7]。
随着科技的发展,影像医学已从单纯形态学检查向以形态学为基础,分子水平、微循环及代谢产物为特点的功能学检查方向发展[8];CT灌注成像就是一种功能成像,它能反映肿瘤血流动力学信息及血管生成情况[9-10],可通过灌注成像的伪彩图直观显示全肝的灌注情况,利用BV、BF、MTT、HAF、PS等灌注功能图像半定量分析病变血供状态及血流动力学改变[11-12]。HAF指肝动脉供血占肝组织所有供血的比例;本研究中肝癌病灶的HAF明显高于周围肝组织,这提示我们原发性肝癌病灶的肝动脉供血比重明显增大,符合原发性肝癌主要由肝动脉供血的病理学特征[13];MTT是指血流从动脉流入到静脉流出的时间, 我们知道供应肝脏的微循环单位是由门脉终支-肝动脉终支开始,经肝窦汇入肝静脉终支的微血管组成,是调节血流和物质交换的主要场所[14],研究发现肿瘤组织MTT低于周围肝组织,说明肿瘤组织内部正常肝窦的缓慢循环已被破坏,而且可能还发生了动、门静脉短路使得血液快速通过肿瘤组织,使得MTT缩短;BV指造影剂在单位肝组织内的分布容积;BF是指单位时间内流经局部区域定量组织的血容量。本研究结果显示肝癌组织BV、BF较周围肝组织升高,可能与肿瘤生长迅速导致异常血管增多,可容纳较多造影剂有关;PS为单位组织中造影剂经由毛细血管进入细胞间隙的单向传输速率,肿瘤血管的内皮发育异常,基底膜不完整,通透性明显增加[15],因此导致肝癌组织的PS高于周围正常组织。我们又对邻近肿瘤与远离肿瘤的肝组织CT参数进行了比较,发现各参数在两者间均有统计学意义,邻近肿瘤的肝组织HAF、BV、BF、PS数值均高于远离肿瘤的组织,MTT缩短,我们推测邻近肝癌病灶的肝组织更容易受到肿瘤细胞的侵犯,从而影响局部微循环状况,导致局部正常肝小叶结构的破坏、血管通透性的改变,不能排除局部已经有肿瘤细胞的种植;这就提示我们肝癌病人的治疗不仅局限于固有的病灶,还要综合考虑癌组织对周围肝组织甚至全肝的影响,这为临床医生手术方式的选择或者介入栓塞范围的确定提供了一定的依据,也为术后随访或复查评价疗效都有重要的参考价值。
血清AFP、CA199、GGT是临床常用的肿瘤检测指标。AFP是目前用于诊断肝癌的首选肿瘤标志物,但其特异性不高,有较高的假阴性率[16];CA199是一种黏蛋白型的糖类蛋白肿瘤标志物,在正常人胰腺、胃肠道和肝组织等细胞膜上均可表达,释放到细胞间质和血液中,主要用于胰腺癌诊断,在肝胆系肿瘤病人血清中也会有所升高[17]。正常人血清GGT主要来自肝脏,存在于肝细胞质和胆管上皮中,肝脏肿瘤生长时肝脏细胞受到挤压的刺激,GGT重新大量表达,表现出胎肝的特点,合成和分泌GGT增多并释放到外周血中[18]。本研究中我们对血清肿瘤学指标与CT灌注参数进行了相关分析,发现AFP、CA199与各灌注参数无相关性;GGT与PS呈正相关关系,与MTT呈负相关关系,这表明了GGT与肝癌的异常微循环有着密切的关系,肝癌发生后正常肝细胞被破坏侵蚀,造成胞质中的多种酶类分子释放进入血液循环,GGT升高,而GGT可能又会影响着肝癌的生长及进展,研究发现GGT通过转移酶-谷氨酰基参与谷胱甘肽(GSH)的代谢,GSH可以通过中和活性氧和自由基保护细胞免受氧化损伤[19]。因此,在氧化应激的病理状态下,GGT水平会升高。然而,当GGT表达过高时,会干扰抗氧化的平衡,导致肿瘤细胞持续的氧化应激,从而促进了肿瘤的发生过程[20],因此GGT可能会加速肝癌细胞的进展及分化,异常的肿瘤血管增多、血管内皮发育不良,通透性增加,导致PS的升高及MTT的缩短。由此可见,GGT与肝癌微循环的关系密切,对研究肝癌的发生及进展、术后复查评价疗效都有重要的意义。
综上,CT灌注确实能够反映肝癌及周围肝组织的血流灌注状态,提供相应的血流动力学信息,各灌注参数能敏感地反映肝癌组织异常的微循环,评估不同部位肝组织的微循环状况,一定程度上可以提示肝癌的进展程度,为临床治疗及评价预后提供了一定的参考依据。GGT与MTT、PS之间的相关性,证实了其在肝癌发生、发展中发挥的作用,这对未来深入研究肝癌发生、发展的机制有着重要的意义。
肝癌发生后全肝微循环的变化规律及与血清AFP、CA199、GGT的相关性研究
Study on the variation of whole liver microcirculation and its correlation with serum AFP, CA199 and GGT after hepatocellular carcinoma
-
摘要:
目的了解肝癌发生后全肝微循环的变化规律和肝癌CT灌注参数与血清甲胎蛋白(AFP)、糖类抗原199(CA199)谷氨酸氨基转移酶(GGT)的相关性。 方法肝癌病人行上腹部增强扫描获得原始图像,经后处理灌注软件分析得到CT灌注伪彩图及参数,比较20例病人肝癌病灶(A组)、邻近肝组织(B组)、较远肝组织(C组)的血容量(BV)、血流速(BF)、平均通过时间(MTT)、肝动脉分数(HAF)、表面通透性(PS)灌注参数数值。检测病人血液中的AFP、CA199及GGT含量,与癌组织灌注参数作相关性分析。 结果HAF、BV、BF、PS值:A组> B组> C组(P < 0.01),MTT值:A组 < B组 < C组,差异有统计学意义(P < 0.01)。GGT与PS呈正相关关系(r=0.639,P < 0.05),与MTT呈负相关关系(r=-0.577,P < 0.05)。 结论CT灌注能够反映肝癌及周围肝组织的血流灌注状态,一定程度上可以提示肝癌的进展程度,为临床治疗及评价预后提供了一定的参考依据。GGT与肝癌的异常微循环关系密切,在肝癌发生、发展中发挥重要作用。 Abstract:ObjectiveTo investigate the changes of liver microcirculation and correlation between CT perfusion parameters, and serum alpha-fetoprotein(AFP), carbohydrate antigen 199(CA199) and glutamate aminotransferase(GGT). MethodsThe original images of enhanced scan of upper abdomen in liver cancer patients were collected, and the pseudo-color CT perfusion images and parameters were obtained by post-processing perfusion software analysis.The blood volume(BV), blood flow(BF), mean passage time(MTT), hepatic artery fraction(HAF) and surface permeability(PS) perfusion parameters were compared among group A(liver cancer lesion), group B(adjacent liver tissue) and group C(distant liver tissue).The serum levels of AFP, CA199 and GGT in three groups were tested, and their correlation with perfusion parameters of cancer tissue were analyzed. ResultsThe value of HAF, BV, BF and PS in group A, group B and group C gradually decreased, the MTT value in group A, group B and group C gradually increased, and the differences of whose among three groups were statistically significant(P < 0.01).The GGT was positively correlated with PS(r=0.639, P < 0.05), and negatively correlated with MTT(r=-0.577, P < 0.05). ConclusionsCT perfusion can reflect the status of blood perfusion in liver cancer and surrounding liver tissues, indicate the progression of liver cancer to a certain extent, and provide a certain reference for clinical treatment and prognosis evaluation.GGT is closely related to the abnormal microcirculation of liver cancer, and plays an important role in the occurrence and development of liver cancer. -
Key words:
- hepatoma /
- microcirculation /
- serum glutamyltransferase /
- CT perfusion /
- alpha-fetoprotein /
- carbohydrate antigen 199
-
表 1 肝癌组织与周围肝组织CT灌注参数比较(x±s)
分组 n HAF BV/(mL/100 g) BF/[mL·(100 g)-1·min-1] PS/[mL·(100 g)-1·min-1] MTT/s A组 20 0.81±0.12 23.34±4.19 187.34±16.33 25.58±3.77 5.47±0.88 B组 20 0.49±0.14** 12.68±2.36** 83.51±17.19** 14.05±3.32** 8.63±0.81** C组 20 0.25±0.08**△△ 8.49±1.61**△△ 54.54±12.77**△△ 7.95±1.5**△△ 15.46±2.72**△△ F — 118.74 136.66 403.79 174.88 176.88 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.013 8.577 241.527 9.173 2.946 q检验:与A组比较**P < 0.01;与B组比较△△P < 0.01 表 2 AFP、CA199、GGT与HAF、BV、BF、PS、MTT相关系数(r)
肿瘤指标 HAF BV BF PS MTT AFP 0.039 0.254 0.024 0.311 -0.344 CA199 -0.271 -0.170 0.003 -0.086 0.116 GGT -0.206 -0.003 0.116 0.639 -0.577 -
[1] JEMAL A, BRAY F, CENTERR MM, et al. Global cancer statistics, 2011[J]. CA Cancer J Clin, 2011, 61(2): 69. doi: 10.3322/caac.20107 [2] PANG RW, JOH JW, JOHNSON PJ, et al. Biology of hepatocellular Carcinoma[J]. Ann Surg Oncol, 2008, 15(4): 962. [3] YANG LY, FANG F, OU DP, et al. Sol itary large hepatocellul arcar-cinoma: a specific subtype of hepatocellul arcarci nom a with good out come after hepatic resection[J]. Ann Surg, 2009, 249(1): 118. doi: 10.1097/SLA.0b013e3181904988 [4] HAN-MIN LI. Microcirculation of liver cancer, microenvironment of liver regeneration, and the strategy of Chinese medicine[J]. Chin J Integr Med, 2016, 22(3): 163. doi: 10.1007/s11655-016-2460-y [5] KARWOWSKIW, NAUMNIKB, SZCZEPANSKIM, et al. The mechanism of vascular calcification-a systematic review[J]. Med Sci Monit, 2012, 18: 1. [6] RENNERT J, WIESINGER I, BEYER LP, et al. Color coded perfusion analysis and microcirculation imaging with contrast enhanced ultrasound (CEUS) for post-interventional success control following thermal ablative techniques of primary and secondary liver malignancies[J]. Clin Hemorheol Microcirc, 2019, 73(1): 73. doi: 10.3233/CH-199224 [7] VERMEULEN PB, VAN GOLEN KL, DIRIX LY. Angiogenesis, lymphangiogenesis, growth pattern, and tumor emboli in in-flammatory breast cancer[J]. Cancer, 2010, 116(S11): 2748. doi: 10.1002/cncr.25169 [8] TAOULI B, VILGRALN, V, DUMONT E, et al. Evaluation of liver diffusion isotropy and characterization of focal hepatic lesions with two single-shot eho-planar MR imaging sequenees: prospective study in 66 patients[J]. Radiology, 2003, 226(1): 71. doi: 10.1148/radiol.2261011904 [9] LING S, DENG D, MO Y, et al. Correlations between CT perfusion parameters and vascular endothelial growth factor expression and microvessel density in implanted VX2 lung tumors[J]. Cell Biochem Biophys, 2014, 70(1): 629. doi: 10.1007/s12013-014-9966-8 [10] CAO X, JIANG X. Evaluating the effect of high-intensity focused ultrasound therapy on liver tumors using multislice CT perfusion[J]. Oncol Lett, 2013, 5(2): 511. doi: 10.3892/ol.2012.1068 [11] WONG YC, WANG LJ, WU CH, et al. Differences of liver CT perfusion of blunt trauma treated with therapeutic embolization and observation management[J]. Sci Rep, 2020, 10(1): 19612. doi: 10.1038/s41598-020-76618-w [12] FOURNIER LS, CUENOD CA, deBazelaire C, et al. Early modifications of hepatic perfusion measured by functional CT in a rat model of hepatocellular carcinoma using a blood pool contrast agent[J]. Eur Radiol, 2004, 14(11): 2125. doi: 10.1007/s00330-004-2339-8 [13] SOBIC SARANOVIC D, STOJILJKOVIC M, SUSNJAR S, et al. Metabolic activity of breast cancer metastatic lesions on positron emission tomography/computed tomography: comparison with histological and biological characteristics of primary tumor[J]. Neoplasma, 2016, 63(2): 313. [14] KAN Z, MADOFF DC. Liver anatomy: microcirculation of the liver[J]. Semin Intervent Radiol, 2008, 25(2): 77. doi: 10.1055/s-2008-1076685 [15] ZHANG DW, XU AX. Application of dual-source CT perfusion imaging and MRI for the diagnosis of primary liver cancer[J]. Oncol Lett, 2017, 14(5): 5753. [16] 俞禾涛, 张桢, 张永乐, 等. 甲胎蛋白、甲胎蛋白异质体及其比值检测在肝细胞癌诊断中的应用价值研究[J]. 中国卫生检验杂志, 2018, 28(16): 1980. [17] 张宁, 王颖娴, 胡健, 等. 血清CA199、C3、C4及脂类代谢水平在胰腺癌临床诊断中的应用[J]. 吉林大学学报, 2016, 42(2): 295. [18] LI Q, HAN P. CT assessment after radiofrequency ablation of hepatocellular carcinoma: From morphology to function[J]. Chin J Med Imaging Technol, 2013, 29(2): 314. [19] ZHANG LX, YANG L, XU AM, et al. The prognostic significance of serum gamma-glutamyltransferase levels and AST/ALT in primary hepatic carcinoma[J]. BMC Cancer, 2019, 19(1): 841. [20] YANG JG, HE XF, HUANG B, et al. Serum GGT levels and GGT/ALT and AST/ALT ratios in primary hepatic carcinoma with different AFP levels[J]. Cancer Biomark, 2018, 21(4): 743. -





 下载:
下载: