-
结直肠癌(colorectal cancer,CRC)是全世界常见的消化道恶性肿瘤之一。相关研究数据表明,近几年我国CRC的发病率和死亡率均保持上升趋势[1]。早期肿瘤病人可通过手术切除获得良好预后,其5年生存率可超过90%。然而多数CRC确诊时已为中晚期,无法达到理想的治疗效果,5年生存率不到10%[2]。CRC中常常有代谢失常的表现[3]。泛醌-细胞色素c还原酶复合物核心蛋白1(ubiquinol cytochrome c reductase core protein 1,UQCRC1)是线粒体复合体Ⅲ的重要结构亚基之一,参与组成线粒体氧化呼吸链,对维持正常线粒体功能和细胞代谢有着基础性作用[4]。国内外大量研究表明,UQCRC1在人类肿瘤中存在表达失调[5]。癌胚抗原(carcinoembryonic antigen,CEA)是目前应用最广泛的肿瘤标志物之一,经常用于肠癌的检测中。但因其特异性与敏感性欠佳,常与其他肿瘤标志物联合使用[6]。本研究通过检测CRC根治术后的组织标本中UQCRC1的表达,分析其和血清CEA的相关性,初步探讨UQCRC1在结肠癌发生、发展过程中的作用及意义。
-
随机选取2017-2018年蚌埠医学院第一附属医院初诊CRC手术切除得到的组织标本52例,并收集所选病例术前血清CEA值。其中男28例,女24例,年龄20~80岁。肿瘤大小:≤5 cm者27例,>5 cm者25例;组织学分型:腺癌49例,黏液癌3例;组织学分级:中分化及高分化共36例,低分化16例;TMN分期:Ⅰ期2例,Ⅱ期22例,Ⅲ期20例,Ⅳ期8例;并从其中选取37例临近癌旁组织作对照分析。纳入标准:所有病人均已完善相关检查(肠镜活检、临床病理切片等)确诊为原发性CRC,且为初诊;术前未接受化疗、放疗、靶向及其他特殊抗肿瘤治疗;所有病人均已在术前完善血清学CEA检测。排除标准:合并其他系统肿瘤;合并急慢性严重炎症、自身免疫性病;临床资料不全者。诊断及分期标准:参照《中国CRC诊疗规范(2017年版)》[7]中提到的诊断标准及TNM分期、组织学分级等。
-
本研究已通过本院伦理委员会批准。抗体UQCRC1购自美国Abcam有限公司(产品编号ab125882),免疫组织化学采用SP法染色。按照试剂盒说明书进行染色程序,主要步骤包括:石蜡切片二甲苯脱蜡,梯度乙醇脱水;自来水、蒸馏水各冲洗3遍;高压抗原修复2 min;过氧化物酶阻断10~15 min;蒸馏水冲洗3遍,PBS冲洗;加一抗温箱孵育1 h,PBS冲洗3遍;滴加二抗,温箱孵育30 min,PBS冲洗3遍;滴加DAB显色3~5 min,自来水冲洗;苏木精复染,水洗返蓝;常规脱水透明,中性树胶固定封片。
-
以细胞质出现棕黄色颗粒为阳性。显微镜下观察免疫组织化学染色结果,每张切片由本院2名病理科医生采用下述方法评定[8]:标志物根据显色深浅得到染色强度:0分(阴性)、1分(弱)、2分(中)、3分(强);根据阳性染色区域相对于整个癌区百分比得到染色程度: < 5%为0分、5%~25%为1分、>25%~50%为2分、>50%~75%为3分、>75%为4分。其结果为两项得分乘积:最终得分≤2分为阴性,最终得分≥3分为阳性。血清CEA值参考值范围为0~5 ng/mL, ≥5 ng/mL即为阳性。
-
采用χ2检验、Spearman等级相关性分析。
-
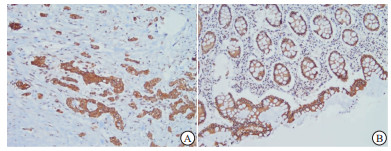
UQCRC1主要表达于细胞质(见图 1)。本次研究结果显示,52例癌组织中有16例(30.8%)UQCRC1低表达;37例癌旁正常组织中UQCRC1呈低表达的有4例(10.8%),在α < 0.05的水准上,两者差异具有统计学意义(χ2=4.94,P < 0.05)。Spearman等级相关性分析结果提示UQCRC1的表达与组织性质显著相关(r=-0.236, P < 0.05)。CRC病人术前血清CEA阳性率为40.4%(21/52)。
-
CRC组织中UQCRC1的表达与淋巴结转移情况有关(P < 0.05),在病人不同性别、年龄、肿瘤大小、分化程度、临床分期上的表达差异均无统计学意义(P>0.05) (见表 1)。
临床病理参数 n UQCRC1 χ2 P 低表达 高表达 性别 男
女28
247(25.0)
9(37.5)21(75.0)
15(62.5)0.95 >0.05 年龄/岁 ≤60
>6027
2510(37.0)
6(24.0)17(63.0)
19(76.0)1.04 >0.05 肿瘤大小/cm ≤5
>527
259(33.3)
7(28.0)18(66.7)
18(72.0)0.17 >0.05 分化程度 低分化
中+高分化16
363(18.8)
13(36.1)13(81.3)
23(63.9)0.86* >0.05 临床分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ24
285(20.8)
11(39.3)19(79.2)
17(60.7)2.07 >0.05 淋巴结转移 是
否22
3010(45.5)
6(20.0)12(54.5)
24(80.0)3.86 < 0.05 *示校正χ2值 表 1 CRC组织中UQCRC1的表达与临床及病理参数的关系[n; 百分率(%)]
-
52例结肠癌组织中,UQCRC1表达阴性同时CEA表达阳性者占62.5%(10/16)。运用Spearman等级相关分析得知,在α < 0.05的检验水准上,CRC病人癌组织中UQCRC1表达水平与术前血清CEA值呈显著负相关(r=-0.300)(P < 0.05)(见表 2)。
UQCRC1表达 n CEA表达 r P 阳性 阴性 阴性
阳性16
3610
116
25-0.300 < 0.05 表 2 CRC中UQCRC1、CEA表达的相关性(n)
-
CRC是全世界绝大多数国家的一个健康问题。据报道,全世界每年有超过100万人罹患CRC,遗传和环境因素是CRC发生的重要条件[9]。在我国,CRC发病率逐年上升,且随着一些危险因素如人口老龄化、不良饮食习惯等蔓延,其死亡率也处于明显的上升趋势[10],居民生命健康受到严重威胁。尽早诊断和判断癌变组织恶性程度对提高CRC病人的生存质量至关重要。
UQCRC1是一种核DNA编码蛋白,是参与合成线粒体呼吸链复合体Ⅲ的11个重要亚基之一。UQCRC1在胚胎存活和发育中起着关键作用,SHAN等[11]的实验发现敲除杂合子小鼠中的UQCRC1导致胚胎致死。而关于UQCRC1的表达与恶性肿瘤中的关系,KULAWIEC等[12]发现74%的乳腺癌病人UQCRC1阳性,仅34%的卵巢腺癌病人UQCRC1表达。后陆续有关于其在食管癌、胰腺导管腺癌中上调,在贲门癌、胃癌中表达下调的报道[13-14]。从目前考虑的机制上看,不可忽视的是UQCRC1表达与线粒体的关系。研究[11]证实UQCRC1对维持酵母中复合体Ⅲ的完整性至关重要。有关实验[15-16]显示,上皮来源的细胞和小鼠精母细胞中UQCRC1的缺失可导致线粒体功能障碍。YI等[17]的研究指出,UQCRC1有助于在心肌损伤期间维持H9c2细胞的线粒体功能。根据这些证据可推测,UQCRC1的异常表达可影响到人类线粒体功能正常状态的维持。正常线粒体功能中断会导致多种人类疾病的发生,其中就包括肿瘤的发生[18]。近年来,线粒体出现在癌症研究中的次数大大增多。线粒体可调节生物代谢,是癌细胞代谢变化的关键调节物[19]。目前线粒体功能障碍在多种癌症的转移进展中皆有报道发现[20],如结肠癌、前列腺癌、胃癌等。线粒体障碍常产生大量活性氧(reactive oxygen species,ROS),促进DNA损伤和遗传不稳定性[21]。ROS是线粒体呼吸链产生的主要来源于复合体Ⅲ的具有损伤作用的副产物[22],ROS失衡是线粒体功能障碍主要机制之一,其在癌症的发生、发展和生存表型中皆发挥重要作用[19, 23-24]。SHAN等[11]实验还发现,UQCRC1缺乏致使小鼠线粒体膜电位和ATP产量下降,而ROS产量增加,可能原因在于UQCRC1的缺乏导致复合物Ⅲ活性的降低。
本实验研究结果显示,UQCRC1在癌组织中的表达下调率(30.8%)高于癌旁正常组织(10.8%),差异有统计学意义(P < 0.05)。UQCRC1参与组成线粒体氧化呼吸链,推测在结直肠细胞中UQCRC1的下调表达使细胞中的线粒体出现功能障碍,细胞能量代谢发生改变,进而导致肿瘤的发生发展。进一步分析该蛋白表达水平与肿瘤的大小、分化程度、临床分期以及淋巴结转移的关系,发现CRC组织中UQCRC1的下调表达与肿瘤淋巴结转移有关,进一步提示UQCRC1的存在与CRC侵袭有着密切联系。LI等[25]通过研究证实UQCRC1表达下调与血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)表达升高之间存在正向相关关系,提出UQCRC1的下调可诱导VEGF-C的表达进而促进淋巴转移。这一考虑基于有关VEGF-C通过诱导淋巴管的生成促使淋巴结转移事件发生的相关报道[26]。
CEA是一种高分子糖蛋白,在人类的结肠、胃、汗腺等组织器官中存在。CEA在细胞的聚集、黏附、凋亡等过程中发挥作用,其与肿瘤的恶性程度密切相关。CEA增高可发生在多种恶性肿瘤中如胃肠道癌、乳腺癌、胰腺癌等,其中以结肠癌显著[27-28]。研究[29]显示CEA在CRC病人中的阳性率在40%~50%之间。此次研究结果显示,CRC病人术前CEA阳性率为40.4%,UQCRC1表达与血清CEA表达存在负相关性。这种负向关系考虑原因为:在结肠细胞中UQCRC1的表达下调或缺失,使得细胞线粒体失去正常功能,细胞代谢环境改变使得组织器官更易受到损伤,从而导致肠道细胞癌变。随着CRC的发生,CEA含量增多,充分发挥了其在肿瘤细胞免疫逃避及细胞聚集、黏附中的重要作用,使肿瘤细胞更易向周围组织器官扩散和转移[30],进一步促进了癌症的发展,使得UQCRC1的表达进一步下调。CEA作为标志物在肿瘤的检测中应用广泛,但因独立检测缺乏特异性,增加指标可使阳性可信度增加。本实验结果显示,CRC组织中UQCRC1表达阴性者其血清CEA阳性率明显高于UQCRC1表达阳性者,表明联合两种指标检测有助于评估结直肠肿瘤的状态。
综上所述,CRC中UQCRC1的表达下调与CRC的发生发展有密切关系,联合UQCRC1和CEA两个指标检测可为CRC的诊治及病情评估提供一定理论依据。
UQCRC1在结直肠癌组织中的表达及其与血清CEA的相关性
Expression of UQCRC1 in colorectal cancer tissue and its correlation with serum CEA
-
摘要:
目的探讨结直肠癌组织中泛醌-细胞色素c还原酶复合物核心蛋白1(UQCRC1)的表达及其与血清癌胚抗原(CEA)的相关性。 方法收集52例结直肠癌组织蜡块及37例癌旁组织蜡块,采用免疫组化SP法检测UQCRC1的表达水平,分析其表达与结直肠癌临床病理特征以及血清CEA值的相关性。 结果UQCRC1在癌组织中表达下调率为30.8%,在癌旁正常组织中表达下调率为10.8%,两者差异有统计学意义(χ2=4.94,P < 0.05)。且其表达与结直肠癌淋巴结转移有关,伴有淋巴结转移的病人阴性表达率(45.5%)高于不伴有淋巴有转移的病人(20.0%),两者差异有统计学意义(P < 0.05);癌组织中UQCRC1表达与术前血清CEA水平呈负相关(r=-0.300,P < 0.05)。 结论UQCRC1在结直肠癌中的表达下调在肿瘤发生、发展中发挥重要作用,联合血清CEA可为结直肠癌的病情评估提供理论依据。 -
关键词:
- 结直肠肿瘤 /
- 泛醌-细胞色素c还原酶复合物核心蛋白1 /
- 癌胚抗原 /
- 免疫组织化学
Abstract:ObjectiveTo investigate the expression levels of ubiquinol cytochrome c reductase core protein 1(UQCRC1) in colorectal cancer tissues, and its correlation with serum carcinoembryonic antigen(CEA) level. MethodsThe expression levels of UQCRC1 in 52 cases of colorectal cancer tissue and 37 cases of paracancer tissue were detected using the immunochemistry SP method, and the relationship between the expression levels of UQCRC1, and clinicological characteristics of colorectal cancer and serum level of CEA were analyzed. ResultsThe down-regulation rates of UQCRC1 in cancer tissue and normal tissue adjacent to cancer were 30.8% and 10.8%, respectively, and the difference of which was statistically significant(χ2=4.94, P < 0.05).The UQCRC1 expression was related to lymph node metastasis of colorectal cancer, and the negative expression rate in patients with lymph node metastasis(45.5%) was higher than that in patients without lymph node metastasis(20.0%)(P < 0.05).The UQCRC1 expression in cancer tissue was negatively correlated with the preoperative serum CEA level(r=-0.300, P < 0.05). ConclusionsThe down-regulation of UQCRC1 expression in colorectal cancer may play an important role in tumorigenesis and development, and UQCRC1 combined with serum CEA can provide the theoretical basis in the assessment of colorectal cancer. -
表 1 CRC组织中UQCRC1的表达与临床及病理参数的关系[n; 百分率(%)]
临床病理参数 n UQCRC1 χ2 P 低表达 高表达 性别 男
女28
247(25.0)
9(37.5)21(75.0)
15(62.5)0.95 >0.05 年龄/岁 ≤60
>6027
2510(37.0)
6(24.0)17(63.0)
19(76.0)1.04 >0.05 肿瘤大小/cm ≤5
>527
259(33.3)
7(28.0)18(66.7)
18(72.0)0.17 >0.05 分化程度 低分化
中+高分化16
363(18.8)
13(36.1)13(81.3)
23(63.9)0.86* >0.05 临床分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ24
285(20.8)
11(39.3)19(79.2)
17(60.7)2.07 >0.05 淋巴结转移 是
否22
3010(45.5)
6(20.0)12(54.5)
24(80.0)3.86 < 0.05 *示校正χ2值 表 2 CRC中UQCRC1、CEA表达的相关性(n)
UQCRC1表达 n CEA表达 r P 阳性 阴性 阴性
阳性16
3610
116
25-0.300 < 0.05 -
[1] 黄陈, 戎泽印. 结直肠癌诊治新进展[J]. 蚌埠医学院学报, 2018, 43(10): 1293. [2] 张政, 李鹏, 张澍田. 中国结直肠癌筛查的研究历史现状与展望[J]. 中国实用内科杂志, 2018, 38(9): 777. [3] 杨伟兴, 喻玉, 肖王, 等. 结肠癌中NMNAT2、p53的表达及三者相关性研究[J]. 现代生物医学进展, 2019, 19(14): 2735. [4] TORRICELLI F, SAXENA A, NUAMAH R, et al. Genomic analysis in short- and long-term patients with malignant pleura mesothelioma treated with palliative chemotherapy[J]. Eur J Cancer, 2020, 132: 104. doi: 10.1016/j.ejca.2020.03.002 [5] ZHAO X, WANG Q, LIN F, et al. RNA Sequencing of Osteosarcoma Gene Expression Profile Revealed that miR-214-3p Facilitates Osteosarcoma Cell Proliferation via Targeting Ubiquinol-Cytochrome c Reductase Core Protein 1(UQCRC1)[J]. Med Sci Monit, 2019, 25: 4982. doi: 10.12659/MSM.917375 [6] 谭杨波, 廖桂红, 陈龙, 等. 肿瘤标志物在结直肠癌诊断应用中的研究新进展[J]. 卫生职业教育, 2019, 37(6): 158. [7] 国家卫生计生委医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2017年版)[J]. 中华普通外科学文献, 2018, 38(10): 1089. [8] HU X, LI YQ, LI QG, et al. ITGAE Defines CD8+ Tumor-Infiltrating Lymphocytes Predicting a better Prognostic Survival in Colorectal Cancer[J]. EBioMedicine, 2018, 35: 178. doi: 10.1016/j.ebiom.2018.08.003 [9] TESTA U, PELOSI E, CASTELLI G. Colorectal cancer: genetic abnormalities, tumor progression, tumor heterogeneity, clonal evolution and tumor-initiating cells[J]. Med Sci (Basel), 2018, 6(2): 31. [10] 刘晓雪, 宇传华, 周薇, 等. 中国近30年间结直肠癌死亡趋势分析[J]. 中国癌症杂志, 2018, 28(3): 177. [11] SHAN W, LI J, XU W, et al. Critical role of UQCRC1 in embryo survival, brain ischemic tolerance and normal cognition in mice[J]. Cell Mol Life Sci, 2019, 76(7): 1381. doi: 10.1007/s00018-019-03007-6 [12] KULAWIEC M, ARNOUK H, DESOUKI MM, et al. Proteomic Analysis of Mitochondria-to-Nucleus Retrograde Response in Human Cancer[J]. Cancer Biol Ther, 2006, 5(8): 967. doi: 10.4161/cbt.5.8.2880 [13] WANG X, ZHI Q, LIU S, et al. Identification of specific biomarkers for gastric adenocarcinoma by ITRAQ proteomic approach[J]. Sci Rep, 2016, 6(1): 38871. doi: 10.1038/srep38871 [14] WANG Q, LI M, GAN Y, et al. Mitochondrial Protein UQCRC1 is Oncogenic and a Potential Therapeutic Target for Pancreatic Cancer[J]. Theranostics, 2020, 10(5): 2141. doi: 10.7150/thno.38704 [15] SHIBANUMA M, INOUE A, USHIDA K, et al. Importance of mitochondrial dysfunction in oxidative stress response: A comparative study of gene expression profiles[J]. Free Radic Res, 2011, 45(6): 672. doi: 10.3109/10715762.2011.564169 [16] HUANG S, WANG J, CUI Y. 2, 2', 4, 4'-Tetrabromodiphenyl ether injures cell viability and mitochondrial function of mouse spermatocytes by decreasing mitochondrial proteins Atp5b and Uqcrc1[J]. Environ Toxicol Pharmacol, 2016, 46: 301. doi: 10.1016/j.etap.2016.08.011 [17] YI T, WU X, LONG Z, et al. Overexpression of Ubiquinol-Cytochrome c Reductase Core Protein 1 May Protect H9c2 Cardiac Cells by Binding with Zinc[J]. Biomed Res Int, 2017, 2017: 1314297. [18] ZHU Y, DEAN AE, HORIKOSHI N, et al. Emerging evidence for targeting mitochondrial metabolic dysfunction in cancer therapy[J]. J Clin Invest, 2018, 128(9): 3682. doi: 10.1172/JCI120844 [19] GUERRA F, ARBINI AA, MORO L. Mitochondria and cancer chemoresistance[J]. Biochim Biophys Acta Bioenerg, 2017, 1858(8): 686. doi: 10.1016/j.bbabio.2017.01.012 [20] ZONG WX, RABINOWITZ JD, WHITE E. Mitochondria and Cancer[J]. Mol Cell, 2016, 61(5): 667. doi: 10.1016/j.molcel.2016.02.011 [21] IDELCHIK MDPS, BEGLEY U, BEGLEY TJ, et al. Mitochondrial ROS control of cancer[J]. Semin Cancer Biol, 2017, 47: 57. doi: 10.1016/j.semcancer.2017.04.005 [22] YANG S, LIAN G. ROS and diseases: role in metabolism and energy supply[J]. Mol Cell Biochem, 2020, 467(1/2): 1. doi: 10.1007/s11010-020-03697-8 [23] ZHUANG J, PAN ZJ, LI MQ, et al. BDE-47 induced apoptosis in zebrafish embryos through mitochondrial ROS-mediated JNK signaling[J]. Chemosphere, 2020, 258: 127385. doi: 10.1016/j.chemosphere.2020.127385 [24] MOLONEY JN, COTTER TG. ROS signalling in the biology of cancer[J]. Semin Cell Dev Biol, 2018, 80: 50. doi: 10.1016/j.semcdb.2017.05.023 [25] LI W, WUBULIKASIMU G, ZHAO X, et al. UQCRC1 downregulation is correlated with lymph node metastasis and poor prognosis in CRC[J]. Eur J Surg Oncol, 2019, 45(6): 1005. doi: 10.1016/j.ejso.2019.02.025 [26] ZONG S, LI H, SHI Q, et al. Prognostic significance of VEGF-C immunohistochemical expression in colorectal cancer: A meta-analysis[J]. Clin Chim Acta, 2016, 458: 106. doi: 10.1016/j.cca.2016.04.037 [27] LEE JH, LEE SW. The roles of carcinoembryonic antigen in liver metastasis and therapeutic approaches[J]. Gastroenterol Res Pract, 2017, 2017: 7521987. [28] 孙磊, 张守永, 广圣芳, 等. CA153、CEA与细针吸取细胞学联合检测在乳腺癌诊断中的价值[J]. 蚌埠医学院学报, 2018, 43(3): 391. [29] 曾艳, 张力, 贺帅. 结直肠癌患者血清CEA和CA19-9水平与肝转移的关系[J]. 癌症进展, 2019, 17(13): 1586. [30] 赵建峰, 李记彬, 石刚, 等. 结直肠癌AIM2和血清CEA表达水平及其临床意义[J]. 中华结直肠疾病电子杂志, 2019, 8(3): 257. doi: 10.3877/cma.j.issn.2095-3224.2019.03.009 -





 下载:
下载: