-
近年来,宫颈癌的发病率和死亡率仍呈上升趋势,且发病年龄呈年轻化趋势[1]。为了尽早发现癌前病变,降低宫颈癌的发病率,有必要找出宫颈癌早期诊断的生物标志物。理想的筛查方法应该识别更多的癌前病变,并尽可能减少阴道镜的转诊率。目前宫颈癌筛查方法主要有细胞学检测、人乳头瘤病毒(HPV)检测及两者联合检测,但细胞学检测缺乏敏感性,且易受阅片医师的主观影响;HPV检测缺乏特异性,不能甄别“持续性”高危型HPV(HR-HPV)感染这一宫颈癌发生的必要因素,较高的阳性率可能导致不必要的转诊和治疗。p16INK4a蛋白作为诱导细胞周期阻滞的一种细胞周期调节蛋白,被认为是HR-HPV持续感染的一个生物标志物,能够预测宫颈高级别上皮内病变的存在[2]。本研究以医院门诊人群为基础,同时行液基薄层细胞学(TCT)、HPV及p16检测,比较并探讨p16、HPV、TCT单独及联合检测对宫颈高级别上皮内瘤变和宫颈癌的诊断价值。
-
选取2020年5-8月于我院妇科门诊就诊要求行宫颈癌筛查的受检者790例,同时进行HPV、TCT和p16检查。纳入标准:年龄20~70岁,有性生活史,非妊娠状态,无宫颈手术史(如宫颈锥切术、宫颈切除术),同意采集用于本研究的宫颈上皮脱落细胞及宫颈组织。所有受检者均签署知情同意书,并通过我院伦理委员会审查。
-
采集标本前24 h内禁止性生活、阴道检查及阴道用药,先将宫颈表面分泌物拭净,将细胞刷置于子宫颈管内,旋转5~8圈后取出,将附着于小刷子上的标本置于保存液中。
-
HPV分型检测试剂盒(广州安必平医药科技有限公司),包括高危HPV分型:HPV16、18、31、33、35、39、45、51、52、53、56、58、59及66型,和低危HPV分型:HPV68、CP8304、6、11、43、73、82、26、40、42、44、54、61及83型。
-
采用全自动制片系统制作薄层涂片,由细胞学医生采用TBS分级法进行细胞学阅片,其结果判断为未见上皮内病变细胞和恶性细胞(NILM) 时定义为阴性,当判读为意义不明的不典型鳞状细胞(ASCUS)及以上时定义为阳性。
-
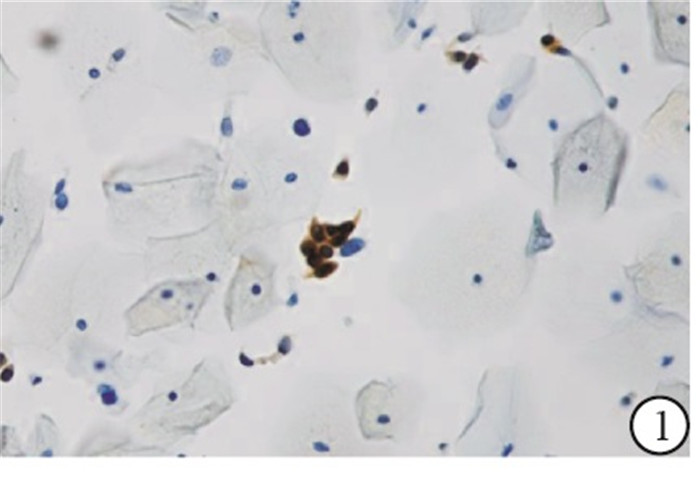
采用广州江元医疗科技有限公司生产的全自动免疫细胞独立温控单独滴染染色机和配套的p16抗体检测试剂盒(免疫细胞化学法), 按步骤依次完成。普通光学显微镜下, 整张涂片:上皮细胞细胞质(或伴细胞核)染为黄棕色5个及以上为阳性,上皮细胞的细胞质及细胞核未见黄棕色或染为黄棕色小于5个为阴性(见图 1、2)。所有标本均由2名经验丰富的细胞学诊断医师阅片诊断。
-
任一检测结果阳性以及检测均阴性但有明显临床症状高度怀疑宫颈病变者转诊阴道镜及定位活检。由有经验的妇科医生操作,在子宫颈和阴道壁的异常区域进行2~4点活检,未见病变则对在宫颈外鳞柱交界处的随机活检,对于细胞学提示腺体病变、鳞柱交界不完全可见或Ⅲ型转化区,则进行宫颈搔刮术(endocervical curettage, ECC)。活检或ECC标本送至我院病理科进行诊断。组织病理学分为宫颈慢性炎、宫颈低级别鳞状上皮内病变(LSIL)、宫颈高级别鳞状上皮内病变(HSIL)和宫颈癌;宫颈上皮内瘤变(CIN)1归为LSIL,CIN2-3归为HSIL。
-
灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%, 阳性预测值(PPV)=真阳性例数/(真阳性例数+假阳性例数)×100%, 阴性预测值(NPV)=真阴性例数/(真阴性例数+假阴性例数)×100%,准确率=(真阳性例数+真阴性例数)/总例数×100%, 假阳性率=假阳性例数/(真阴性例数+假阳性例数)×100%,约登指数=灵敏度+特异度-1。
-
采用χ2检验和χ2趋势检验,采用受试者工作特征(ROC) 曲线对各种筛查方法的诊断能力进行评价。
-
790例受检者中,HR-HPV阳性率为25.6%(202/790),TCT阳性率为16.3%(129/790),p16阳性率为14.6%(115/790),任一筛查阳性者共270例,三者均阴性但有明显临床症状者17例(均行阴道镜活检,其中16例病理诊断为慢性炎,1例为LSIL),共召回210例女性行阴道镜活检,组织病理诊断为慢性炎131例、LSIL 41例、HSIL30例及宫颈癌8例。在HSIL及以上病变中,HPV阳性34例(89.5%),TCT阳性29例(76.3%),p16阳性33例(86.8%)。其中HPV16/18阳性率(67.6%,23/34)与非HPV16/18阳性率(32.4%,11/34)比较,差异有统计学意义(χ2= 8.47,P < 0.05);在非HPV16/18阳性HSIL及以上病变中,HPV33(54.5%,6/11)和HPV52(36.4%,4/11)较多(见表 1)。
病理类型 HPV TCT p16 HPV16/18
阳性非HPV16/18
阳性阳性 阴性 阳性 阴性 阳性 阴性 慢性炎症 96(73.3) 35(26.7) 55(42.0) 76(58.0) 40(30.5) 91(69.5) 38(39.6) 58(60.4) LSIL 37(90.2) 4(9.8) 25(61.0) 16(39.0) 15(36.6) 26(63.4) 18(48.6) 19(51.4) HSIL 27(90.0) 3(10.0) 22(73.3) 8(26.7) 25(83.3) 5(16.7) 18(66.7) 9(33.3) 宫颈癌 7(87.5) 1(12.5) 7(87.5) 1(12.5) 8(100.0) 0(0.0) 5(71.4) 2(28.6) χ趋势2 6.11 15.86 34.57 7.70 P < 0.05 < 0.01 < 0.01 < 0.01 表 1 不同级别宫颈上皮内病变各指标阳性率比较[n;百分率(%)]
-
随着宫颈病变程度的加重,HPV、TCT和p16阳性率呈趋势性增加(P < 0.05~P < 0.01)(见表 1)。通过配对样本McNemar检验可知,在宫颈慢性炎及LSIL中,p16阳性率分别低于HPV阳性率和TCT阳性率,差异均有统计学意义(P < 0.05)。在HSIL及以上病变中,三者阳性率差异均无统计学意义(P>0.05)。
-
790例筛查女性中,去除筛查阳性但未行阴道镜检查者77例,最终纳入713例受检者进行宫颈癌筛查效能的比较。p16、HPV、TCT检测诊断HSIL及以上的灵敏度分别为86.8%、89.5%和76.3%,特异度分别为91.9%、80.3%和88.1%。p16+TCT、HPV+TCT、p16+HPV检测的灵敏度分别为92.1%、94.7%和97.4%,特异度分别为85.6%、77.5%和78.8%(见表 2)。
筛查方法 病理 灵敏度/% 特异度/% PPV/% NPV/% 准确率/% 假阳性率/% 约登指数 阳性 阴性 p16 阳性 33 55 86.8 91.9 37.5 99.2 91.6 8.1 0.79 阴性 5 620 TCT 阳性 29 80 76.3 88.1 26.6 98.5 87.5 11.9 0.65 阴性 9 595 HPV 阳性 34 133 89.5 80.3 20.4 99.3 80.8 19.7 0.70 阴性 4 452 p16+TCT 阳性 35 97 92.1 85.6 26.5 99.5 86.0 14.4 0.78 阴性 3 578 阳性 36 152 94.7 77.5 19.2 99.6 78.4 22.5 0.72 阴性 2 523 p16+HPV 阳性 37 143 97.4 78.8 20.6 99.8 79.8 21.2 0.76 阴性 1 532 表 2 以HSIL及以上为终点时,p16、HPV、TCT单独筛查以及两两联合筛查的临床效果评价
-
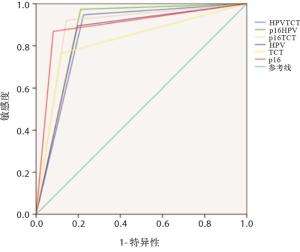
HPV、TCT、p16单独及联合诊断宫颈HSIL及以上病变的ROC曲线见图 3。由ROC曲线分析可知,HPV、TCT、p16、HPV+TCT、p16+HPV、p16+TCT诊断宫颈病变的曲线下面积分别为0.849、0.822、0.893、0.861、0.881、0.889,各指标对宫颈病变的诊断价值均有统计学意义(P < 0.01)(见表 3)。
指标 AUC SE P 95%CI HPV 0.849 0.030 < 0.01 0.789~0.908 TCT 0.822 0.041 < 0.01 0.742~0.902 p16 0.893 0.032 < 0.01 0.830~0.957 HPV+TCT 0.861 0.024 < 0.01 0.813~0.909 p16+HPV 0.881 0.020 < 0.01 0.842~0.920 p16+TCT 0.889 0.027 < 0.01 0.836~0.941 表 3 HPV、TCT、p16单独及联合筛查诊断宫颈HSIL及以上病变的ROC曲线分析
-
宫颈癌是世界范围内妇科常见的恶性肿瘤之一,同时它也是世界上唯一病因明确,可通过早期筛查、治疗消灭的恶性肿瘤。2019年WHO公共卫生项目提出到2030年实现90%HPV疫苗接种覆盖率、70%筛查覆盖率和90%宫颈病变治疗率的目标,到本世纪末,在全球范围内消除宫颈癌战略[3]。然而,目前宫颈癌筛查方式仍存在许多不足,有研究[4-5]发现p16INK4a蛋白作为一种分子生物标志物,对宫颈癌前病变和宫颈癌的诊断具有较高的灵敏度和特异度。在有HR-HPV感染的细胞中,病毒癌蛋白E7与宿主基因组整合并与pRb(视网膜母细胞瘤蛋白)结合,破坏其与E2F(转录因子)结合,从而加速细胞周期失调。pRb功能失活会通过负反馈作用机制导致p16蛋白过表达[6]。p16蛋白的高表达与E7蛋白的激活存在紧密的关系[7]。此外,PRIGENZI等[8]研究认为p16高表达与HR-HPV持续感染密切相关。本研究结果显示,p16阳性率随着宫颈病变的进展呈上升趋势,宫颈病变的程度越高,p16在细胞内表达越多,这与WENTZENSEN等[9]的研究结论相似。
MARIAM等[10]研究结果显示,P16/Ki-67双染检测诊断CIN2+和CIN3+的灵敏度为80.7%和86.8%,低于HPV检测(89.9%和92.3%),但特异度明显高于HPV检测(64.0%& 56.1%;54.0%& 44.4%)。本研究显示,在宫颈癌筛查中,在以宫颈HSIL和以上病变为终点时,p16检测的灵敏度、特异度、阳性预测值、阴性预测值、准确率和假阳性率分别为86.8%、91.9%、37.5%、99.2%、91.6%和8.1%,其特异度和准确率明显高于HPV检测,假阳性率明显低于HPV检测,其ROC曲线下面积为0.893,提示具有较好的诊断HSIL及以上病变的价值。本研究中,单独p16检测对筛查HSIL及以上的特异度和准确率均高于单独HPV和TCT检测,其敏感性近似于HPV与既往临床认知略有出入[5, 10-11],可能与研究样本量偏少有关,有待更大范围的研究验证。
HPV检测对宫颈癌初筛非常敏感,但特异性较低,需要提高特异性但保持高敏感性的分流检测。贾漫漫等[12]研究认为p16/Ki67双染检测用于HPV阳性妇女分流措施的效果优于HPV16/18检测和细胞学检测。越来越多的研究[13-15]表明,p16在区分HSIL和LSIL以及从HR-HPV的一过性感染和持续感染中的区分起着重要作用。CUZICK等[16]对1 091例HPV阳性妇女同时进行了细胞学、p16和基因分型检测,结果显示p16或细胞学阳性(≥LSIL)的妇女诊断CIN2+的敏感度高达97.8%,而两者均阴性的妇女,三年内CIN3+的风险低至0.2%。表明p16结合细胞学用于HPV阳性妇女的分流在保持很高敏感性的同时,降低阴道镜的转诊率,并使短期内需要重复进行检测的妇女人数大幅度降低。本文研究了p16联合TCT检测筛查CIN2+的灵敏度为92.1%,略低于HPV联合TCT检测(94.7%)、p16联合HPV检测(97.4%),但p16+TCT检测的特异度为85.6%,显著高于HPV联合TCT检测(77.5%)、p16联合HPV检测(78.8%)。提示细胞学联合p16检测可能作为一种宫颈癌初筛的方法。
细胞学p16检查作为一种新型宫颈癌筛查技术,操作简单,阳性细胞在显微镜下易于辨认,根据颜色差异即可快速识别异常细胞,受阅片医生主观因素影响小,具有更好的可重复性和准确性,用于宫颈癌筛查兼具高灵敏度和高特异度,适合在各个层级的医院开展,尤其适用于经济欠发达、严重缺乏细胞学医生的地区。WU等[17]报道,p16免疫化学染色在宫颈脱落细胞中不仅可以用作宫颈肿瘤细胞学诊断的辅助工具,而且还有助于对在LSIL以及良性反应性改变的病例中鉴别诊断出HSIL病变的病例。本研究结果显示,p16联合TCT检测在宫颈癌筛查中对于宫颈高级别病变及宫颈癌的诊断价值与HPV联合TCT检测相比,具有相似的敏感性和更高的特异性。细胞学p16检测不仅可以作为宫颈癌筛查的辅助诊断,与常规细胞学相结合,可弥补细胞学漏诊这一弊端,优化筛查策略,提高了筛查效率,降低阴道镜的转诊率,实现CIN的精准分级,具有在临床上推广使用的潜能。
宫颈细胞学p16INK4a蛋白检测联合细胞学检测在宫颈癌筛查中的价值
Value of cervical cytological p16INK4a protein detection combined with cytological test in screening cervical cancer
-
摘要:
目的探讨宫颈细胞学p16INK4a蛋白联合细胞学检测在宫颈癌筛查中对宫颈癌前病变和宫颈癌的诊断价值。 方法选取790例20~70岁自愿行宫颈癌筛查的女性,同时行高危型人乳头瘤病毒(HR-HPV)、液基薄层细胞学检查(TCT)以及细胞学p16INK4a蛋白检测。任一检测结果阳性以及检测均阴性但有明显临床症状高度怀疑宫颈病变者转诊阴道镜及活检,比较HPV、TCT及p16单独和两两联合筛查识别宫颈癌前病变及宫颈癌的检测效果。 结果所有筛查对象中,p16、TCT为不典型鳞状细胞以上(TCT≥ASCUS)和HR-HPV阳性率分别为14.6%、16.3%和25.6%。p16、HPV、TCT阳性率均随宫颈病变程度的加重呈趋势性增加(P < 0.05~P < 0.01)。p16+TCT、HPV+TCT、p16+HPV检测的灵敏度分别为92.1%、94.7%和97.4%,特异度分别为85.6%、77.5%和78.8%。HPV、TCT、p16、HPV+TCT、p16+HPV、p16+TCT诊断宫颈病变的曲线下面积分别为0.849、0.822、0.893、0.861、0.881、0.889,各指标对宫颈病变的诊断价值均有统计学意义(P < 0.01)。 结论与HPV联合TCT检测相比,p16联合TCT检测对宫颈高级别病变及宫颈癌的筛查效果具有相似的敏感性和更高的特异性,可作为一种新型宫颈癌初筛方法。 Abstract:ObjectiveTo explore the value of cervical cytological p16INK4a protein assay combined with cytological assay in screening precancerous lesions of uterine cervix and cervical cancer. MethodsA total of 790 women aged 20 to 70 who volunteered to undergo cervical cancer screening were selected, and the high-risk human papillomavirus(HR-HPV), thinprep cytologic test(TCT) and p16INK4a cytology detection in the subjects were implemented.The colposcopy and biopsy in patients with any positive test result or all negative test results complicated with obvious clinical symptoms with high suspicion of cervical lesions were examined.The detection effects of HPV, TCT and p16 alone, and combined screening for cervical precancerous lesions and cervical cancer were compared. ResultsAmong all screening subjects, the positive rates of p16, TCT diagnosed as ASCUS or higher grade and HR-HPV were 14.6%, 16.3% and 25.6%, respectively.The positive rates of p16, HPV and TCT gradually increased with the increasing of cervical lesions severity(P < 0.05 to P < 0.01).The sensitivities of p16+TCT, HPV+TCT and p16+HPV detection were 92.1%, 94.7% and 97.4%, respectively.The specificities of p16+TCT, HPV+TCT and p16+HPV detection were 85.6%, 77.5% and 78.8%, respectively.The area under the curve of HPV, TCT, p16, HPV+TCT, p16+HPV, and p16+TCT in the diagnosis of cervical lesions were 0.849, 0.822, 0.893, 0.861, 0.881, 0.889, respectively.The differences of the diagnostic value among each index to cervical lesions were statistically significant(P < 0.01). ConclusionsCompared with the results of HPV plus TCT, the p16 plus TCT has similar sensitivity and higher specificity for screening cervical precancerous lesions and cervical cance, and can be used as a new screening method for cervical cancer. -
表 1 不同级别宫颈上皮内病变各指标阳性率比较[n;百分率(%)]
病理类型 HPV TCT p16 HPV16/18
阳性非HPV16/18
阳性阳性 阴性 阳性 阴性 阳性 阴性 慢性炎症 96(73.3) 35(26.7) 55(42.0) 76(58.0) 40(30.5) 91(69.5) 38(39.6) 58(60.4) LSIL 37(90.2) 4(9.8) 25(61.0) 16(39.0) 15(36.6) 26(63.4) 18(48.6) 19(51.4) HSIL 27(90.0) 3(10.0) 22(73.3) 8(26.7) 25(83.3) 5(16.7) 18(66.7) 9(33.3) 宫颈癌 7(87.5) 1(12.5) 7(87.5) 1(12.5) 8(100.0) 0(0.0) 5(71.4) 2(28.6) χ趋势2 6.11 15.86 34.57 7.70 P < 0.05 < 0.01 < 0.01 < 0.01 表 2 以HSIL及以上为终点时,p16、HPV、TCT单独筛查以及两两联合筛查的临床效果评价
筛查方法 病理 灵敏度/% 特异度/% PPV/% NPV/% 准确率/% 假阳性率/% 约登指数 阳性 阴性 p16 阳性 33 55 86.8 91.9 37.5 99.2 91.6 8.1 0.79 阴性 5 620 TCT 阳性 29 80 76.3 88.1 26.6 98.5 87.5 11.9 0.65 阴性 9 595 HPV 阳性 34 133 89.5 80.3 20.4 99.3 80.8 19.7 0.70 阴性 4 452 p16+TCT 阳性 35 97 92.1 85.6 26.5 99.5 86.0 14.4 0.78 阴性 3 578 阳性 36 152 94.7 77.5 19.2 99.6 78.4 22.5 0.72 阴性 2 523 p16+HPV 阳性 37 143 97.4 78.8 20.6 99.8 79.8 21.2 0.76 阴性 1 532 表 3 HPV、TCT、p16单独及联合筛查诊断宫颈HSIL及以上病变的ROC曲线分析
指标 AUC SE P 95%CI HPV 0.849 0.030 < 0.01 0.789~0.908 TCT 0.822 0.041 < 0.01 0.742~0.902 p16 0.893 0.032 < 0.01 0.830~0.957 HPV+TCT 0.861 0.024 < 0.01 0.813~0.909 p16+HPV 0.881 0.020 < 0.01 0.842~0.920 p16+TCT 0.889 0.027 < 0.01 0.836~0.941 -
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115. doi: 10.3322/caac.21338 [2] SROLER MH, WRIGHT TC, FERENCZY A, et al. Routine use of adjunctive p16 immunohistochemistry improves diagnostic agreement of cervical biopsy interpretation: results from the certain study[J]. Am J Surg Pathol, 2018, 42(8): 1001. doi: 10.1097/PAS.0000000000001072 [3] MARC B, JANE JK, KAREN C, et al. Impact of HPV vaccination and cervical screening on cervical cancer elimination: a comparative modelling analysis in 78 low-income and lower-middle-income countries[J]. Lancet, 2020, 395(10224): 575. doi: 10.1016/S0140-6736(20)30068-4 [4] CAROZZI F, GILLIO-TOS A, CONFORTINI M, et al. Risk of high-grade cervical intraepithelial neoplasia during follow-up in HPV-positive women according to baseline p16-INK4A results: a prospective analysis of a nested substudy of the NTCC randomised controlled trial[J]. Lancet Oncol, 2013, 14(2): 168. doi: 10.1016/S1470-2045(12)70529-6 [5] YU LL, CHEN W, LEI XQ, et al. Evaluation of p16/Ki-67 dual staining in detection of cervical precancer and cancers: a multicenter study in China[J]. Oncotarget, 2016, 7(16): 21181. doi: 10.18632/oncotarget.8307 [6] KHLEIF SN, DEGREGORI J, YEE CL, et al. Inhibition of cyclin D-CDK4/CDK6 activity is associated with an E2F-mediated induction of cyclinkinase inhibitor activity[J]. Proc Natl Acad Sci USA, 1996, 93(9): 4350. doi: 10.1073/pnas.93.9.4350 [7] PAUCK A, LENER B, HOELL M, et al. Depletion of the cdk Inhibitor p16INK4a differentially affects proliferation of established cervical carcinoma cells[J]. J Virol, 2014, 88(10): 5256. doi: 10.1128/JVI.03817-13 [8] PRIGENZI KCK, HEINKE T, SALIM RC, et al. Dual p16 and Ki-67 expression in liquid-based cervical cytological samples compared to pap cytology findings, biopsies, and hpv testing in cervical cancer screening: a diagnostic accuracy study[J]. Acta Cytol, 2018, 62(2): 104. doi: 10.1159/000487504 [9] WENTZENSEN N, CLARKE MA, BREMER R, et al. Clinical evaluation of human papillomavirus screening with p16/ki76 dual stain triage in a large organized cervical cancer screening program[J]. JAMA Intern Med, 2019, 179(7): 881. doi: 10.1001/jamainternmed.2019.0306 [10] MARIAM EZ, WALTER G, LUCY G, et al. Dual staining for p16/Ki-67 to detect high-grade cervical lesions: results from the Screening Triage Ascertaining Intraepithelial Neoplasia by Immunostain Testing (STAIN-IT) study[J]. Int J Cancer, 2021, 148(2): 492. doi: 10.1002/ijc.33250 [11] IKENBERG H, BERGERO C, SCHMIDT D, et al. Screening for cervical cancer precursors with p16/ki-67 dual-stained cytology: results of the PALMS study[J]. J Natl Cancer Inst, 2013, 105(20): 1550. doi: 10.1093/jnci/djt235 [12] 贾漫漫, 赵冬梅, 郭珍, 等. p16/Ki-67双染监测在高危型人乳头瘤病毒阳性人群中的分流效果评价[J]. 中华预防医学杂志, 2020, 54(2): 192. doi: 10.3760/cma.j.issn.0253-9624.2020.02.015 [13] ZHANG G, YANG B, ABDUL-KARIM FW, et al. P16 immunohistochemistry is useful in confirming high-grade squamous intraepithelial lesions (HSIL) in women with negative HPV testing[J]. Int J Gynecol Pathol, 2015, 34(2): 180. doi: 10.1097/PGP.0000000000000112 [14] SHAIN AF, KWOK S, FOLKINS AK, et al. Utility of p16 immunohistochemistry in evaluating negative cervical biopsies following high-risk pap test results[J]. Am J Surg Pathol, 2018, 42(1): 69. doi: 10.1097/PAS.0000000000000960 [15] SHAIN AF, WILBUR DC, STOLER MH, et al. Test characteristics of specific p16 clones in the detection of high-grade squamous intraepithelial lesions (HSIL)[J]. Int J Gynecol Pathol, 2018, 37(1): 82. doi: 10.1097/PGP.0000000000000391 [16] CUZICK J, ADCOCK R, CAROZZI F, et al. Combined use of cytology, p16 immunostaining and genotyping for triage of women positive for high-risk human papillomavirus at primary screening[J]. Int J Cancer, 2020, 147(7): 1864. doi: 10.1002/ijc.32973 [17] WU MZ, WANG S, ZHENG M, et al. The diagnostic utility of p16 immunostaining in differentiating cancer and HSIL from LSIL and benign in cervical cells[J]. Cell Transplant, 2019, 28(2): 195. doi: 10.1177/0963689718817478 -





 下载:
下载: