-
肾癌(renal cell carcinoma, RCC)是我国常见的泌尿系统恶性肿瘤,发病率及死亡率呈现逐年增长趋势[1]。RCC的发生是多因素、多基因参与的复杂过程。微小RNA(micro-RNA, miRNA)是生物体内高度保守的单链RNA分子,在肿瘤细胞增殖、凋亡和侵袭等多种生物学进程中发挥重要作用[2]。miR-143是miRNA家族的重要成员,研究[3]发现,miR-143在RCC细胞中表达异常,其可能参与了RCC发生、发展过程。RCC的治疗以手术切除为主,但术后效果不理想,因此,寻找有效的靶向药物是近年来RCC治疗研究的热点。舒尼替尼作为RCC治疗的一线药物,可以阻断肿瘤的营养供给并直接攻击肿瘤细胞,临床作用明显[4]。已有证据[5]表明,舒尼替尼与肿瘤细胞中miR-143的表达相关。本研究将786-O细胞转染miR-143序列及用舒尼替尼处理后,观察细胞增殖、侵袭能力的改变,并检测舒尼替尼作用细胞后miR-143的表达变化,探讨miR-143在RCC细胞中的作用, 舒尼替尼对miR-143表达的影响及与细胞增殖、侵袭的关系,以期为RCC的治疗提供依据。
-
人RCC786-O细胞株购自中科院细胞研究所,舒尼替尼购自上海麦克林公司,RPMI-1640培养基购自美国Hyclone公司,胎牛血清购自美国Gibco公司,培养板、培养瓶及Transwell小室购自美国Corning公司,逆转录试剂盒购自日本Takara公司,总小RNA试剂盒、PCR试剂盒购自北京全式金公司,兔抗人单克隆抗体DNA甲基转移酶3B(DNMT3B)、兔抗人单克隆抗体p-Akt-S473、兔抗人单克隆抗体tubulin购自上海优宁维公司,miR-143及miR-NC慢病毒载体由上海吉玛公司设计并合成,miR-143引物由上海生工生物工程有限公司设计并合成。
-
实验分为对照组、miR-143组、舒尼替尼组、共同作用组。对照组细胞转染阴性对照序列,miR-143组细胞转染miR-143序列,舒尼替尼组细胞用舒尼替尼处理48 h,共同作用组细胞转染miR-143序列并用舒尼替尼处理48 h。
-
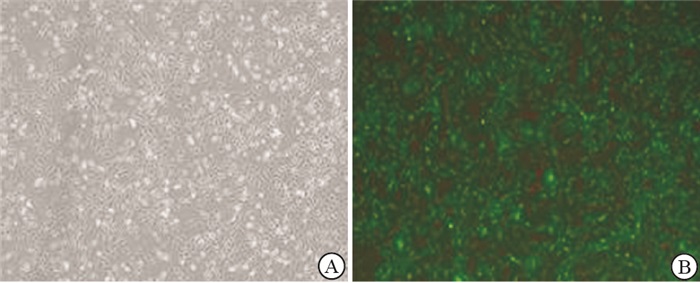
取对数生长期786-O细胞,5×104/孔接种24孔板,于37 ℃、5% CO2、饱和湿度的培养箱中过夜。次日移去培养液,向孔中加入含5 μg/mL聚凝胺的1640完全培养液480 μL,分别将miR-143、miR-NC慢病毒颗粒悬液20 μL加至对应孔中,混匀并孵育过夜。次日弃上清液,每孔加入0.5 mL 1640完全培养基,继续孵育细胞过夜。然后将细胞传至六孔板中,继续培养24 h后加入足够剂量的嘌呤霉素,筛选阳性克隆。qRT-PCR检测miR-143表达量。
-
将786-O细胞种至96孔板,每孔细胞数5×103,于37 ℃、5% CO2、饱和湿度的培养箱中培养过夜。次日加入不同浓度的舒尼替尼(2、4、6、8、10、12 μmol/L),每个浓度值设5个复孔,继续培养48 h后每孔加入5 mg/mL的MTT溶液20 μL,于培养箱中孵育4 h后吸弃液体,每孔加入200 μL DMSO,避光低速振荡10 min后酶标仪490 nm波长下测定各孔吸光度值。根据所测的吸光度值计算舒尼替尼作用于786-O细胞48 h的IC50值,并选取该值作为后续实验用药浓度。
-
取对照组和miR-143组细胞,消化离心后将细胞种至96孔板,每孔细胞数5×103,37 ℃、5% CO2、饱和湿度的培养箱中孵育过夜。次日向相应组中加入药物舒尼替尼,每组细胞均设5个复孔,其余操作与步骤1.4相同。
-
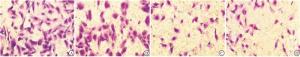
取各组细胞,消化离心后,用无血清1640培养基稀释至2.5×105/mL,每个小室加入200 μL细胞悬液,24孔板中加入800 μL含20%胎牛血清的1640培养基,于37 ℃、5% CO2、饱和湿度的培养箱中孵育24 h后取出小室,用棉签轻轻擦掉上层未迁移细胞,4%多聚甲醛室温固定30 min,0.1%结晶紫染液染色30 min,水洗,风干后,显微镜下随机取5个视野拍照(200倍)。
-
用总小RNA试剂盒提取对照组、miR-143组、舒尼替尼组RNA,利用逆转录试剂盒将RNA逆转录得cDNA,再用PCR试剂盒进行PCR操作。miR-143引物序列:上游5′- CGC GTG AGA TGA AGC ACT G-3′;下游5′-AGT GCA GGG TCC GAG GTA TT-3′。GAPDH引物序列:上游5′-CAA TGA CCC CTT CAT TGA CC-3′;下游5′-GAC AAG CTT CCC GTT CTC AG-3′。PCR扩增反应条件:95 ℃ 15 s,60℃ 1 min,40个循环。每组样品均设3个平行复孔。以GAPDH作为内参,计算各组细胞中miR-143表达量。
-
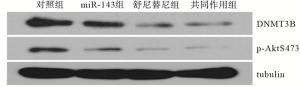
收集各组细胞,用RIPA蛋白裂解液提取蛋白,将适量蛋白经SDS-PAGE电泳分离,转移至PVDF膜,脱脂奶粉室温封闭2 h,加入兔抗人DNMT3B、兔抗人p-Akt-S473和兔抗人tubulin一抗,4 ℃摇床孵育过夜后TBST洗3次,加入HRP标记的羊抗兔二抗,室温摇床上孵育2 h后TBST洗3次,加入ECL显色液后于暗室曝光,经显影定影后,将底片扫描并分析。
-
采用方差分析和q检验。
-
786-O细胞转染miR-143慢病毒颗粒悬液48 h后,与显微镜明场下观察相比,荧光下可见几乎全部细胞内均有荧光分布(见图 1);qRT-PCR结果显示,miR-143转染组细胞miR-143表达量增高(P < 0.01),与对照组比较,舒尼替尼处理786-O细胞48 h后,miR-143表达量亦升高(见表 1)。786-O细胞经舒尼替尼处理48 h后,增殖明显受抑制,呈现剂量依赖性。舒尼替尼作用于786-O细胞48 h的IC50值为6 μmol/L,选取该值作为后续实验用药浓度。
分组 n miR-143 对照组 3 1.00±0.02 miR-143组 3 2.07±0.09 ** 舒尼替尼组 3 1.69±0.03 ** F — 50.92 P — < 0.01 MS组内 — 0.017 q检验: 与对照组比较**P < 0.01 表 1 qRT-PCR检测miR-143表达量(x±s)
-
miR-143组和舒尼替尼组细胞存活率、细胞侵袭数、DNMT3B和p-AktS473蛋白表达量均低于对照组,且高于共同作用组,差异均有统计学意义(P < 0.05~P < 0.01)(见图 2~3、表 2)。
分组 n 细胞存活率/% 细胞侵袭数/(个/视野) DNMT3B p-AktS473 对照组 3 100.00±0.00 183.80±3.54 0.44±0.03 0.22±0.02 miR-143组 3 83.75±2.45* 141.20±2.23** 0.31±0.02** 0.14±0.01** 舒尼替尼组 3 50.00±3.27**△△ 88.80±2.32**△△ 0.15±0.01**△△ 0.07±0.01**△△ 共同作用组 3 40.17±2.05**△△# 70.20±1.72**△△# 0.13±0.02**△△# 0.04±0.01**△△# F — 302.53 1 645.13 90.58 113.59 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 7.830 8.075 0.001 0.001 q检验:与对照组比较*P < 0.05, **P < 0.01;与miR-143组比较△△P < 0.01;与舒尼替尼组比较#P < 0.05 表 2 不同组细胞存活、侵袭、DNMT3B蛋白、p-AktS473蛋白表达比较(x±s)
-
RCC具有发现晚、进展快、异质性大、预后差等特点,需要对其进行综合治疗,化疗是重要方法之一。舒尼替尼作为一种受体酪氨酸激酶抑制剂,可以作用于人体内多个靶点抑制多条信号转导通路,在RCC的治疗中起重要作用[6]。
miRNA是近年来肿瘤研究的热点,舒尼替尼抑制肿瘤细胞活性的过程常常伴随miRNA表达情况的改变,这些改变的miRNA分子与肿瘤的发生发展关系密切[7]。miR-143位于人类第5号染色体,其在RCC、肺癌、宫颈癌等多种肿瘤细胞中低表达,可以通过与多个靶基因相互作用,在转录后水平调控基因的表达[8]。为了研究miR-143对786-O细胞增殖与侵袭的影响,本研究利用慢病毒介导miR-143过表达转染RCC 786-O细胞,qRT-PCR结果显示,与对照组相比,miR-143转染组细胞miR-143表达量明显增高(P < 0.01),说明成功将miR-143稳转入细胞。
本研究结果显示,与对照组相比,miR-143组细胞增殖与侵袭能力降低,提示miR-143可能参与了786-O细胞增殖与侵袭的过程,并在该过程中发挥重要作用。本研究还表明,靶向药物舒尼替尼作用786-O细胞48 h后能明显降低细胞的增殖活性与侵袭能力,显示出较好的抗肿瘤作用,药物与miR-143共同作用时抑制效果更明显,说明miR-143可以提高舒尼替尼的敏感性。本研究通过qRT-PCR技术,对舒尼替尼处理48 h后的细胞进行了miR-143表达量的测定,结果表明,与对照组相比,舒尼替尼上调了miR-143的水平,结合本研究证明了过表达miR-143能抑制786-O细胞的增殖与侵袭,因此推测舒尼替尼可能通过上调miR-143水平抑制786-O细胞的生物学活性。研究[9-11]发现,磷脂酰肌醇3激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)信号通路在RCC中异常高表达,该通路的持续激活能够促进癌细胞的增殖与侵袭,miR-143可通过抑制p-Akt的表达降低PI3K-Akt信号通路的活性进而抑制肿瘤的进展。DNA甲基转移酶(DNMTs)是调节DNA甲基化的关键酶,DNMT3B是DNMTs中的一种,在RCC中的表达水平明显升高[12]。目前认为,在RCC中,DNMT3B导致多种抑癌基因启动子区高甲基化降低了抑癌基因的功能,使肿瘤细胞易于增殖和转移,与RCC的发生发展密切相关,逆转RCC细胞中DNMT3B的高甲基化状态,可以起到抗肿瘤作用[13-15]。子宫内膜癌中的研究发现,miR-143可以直接调控DNMT3B表达[16]。本研究显示,miR-143组细胞DNMT3B、p-AktS473蛋白表达量明显低于对照组,说明过表达miR-143可以降低DNMT3B、p-Akt蛋白的表达,推测miR-143可能通过调控DNMT3B、p-Akt的表达影响786-O细胞的增殖与侵袭。同时本研究也发现,舒尼替尼也能降低DNMT3B、p-AktS473蛋白的表达,推测部分原因可能与舒尼替尼上调细胞miR-143含量有关。
综上所述,miR-143可以降低786-O细胞增殖、侵袭能力,这可能与miR-143降低DNMT3B、p-Akt的表达有关。舒尼替尼可能通过上调miR-143水平抑制786-O细胞的增殖与侵袭,但具体的分子机制并不清楚,仍需进一步研究。
舒尼替尼调控miR-143对人肾癌细胞增殖、侵袭的影响
Effect of regulation of miR-143 by sunitinib on the proliferation and invasion of human renal carcinoma cells
-
摘要:
目的探讨miR-143在肾癌细胞中的作用、舒尼替尼对miR-143表达的影响及与细胞增殖、侵袭的关系。 方法培养人肾癌786-O细胞株,分为对照组、miR-143组、舒尼替尼组、共同作用组。对照组细胞转染阴性对照序列,miR-143组细胞转染miR-143序列,舒尼替尼组细胞用舒尼替尼处理48 h,共同作用组细胞转染miR-143序列并用舒尼替尼处理48 h。MTT法检测细胞的增殖,Transwell检测其侵袭,qRT-PCR检测miR-143RNA表达水平,Western blotting检测DNA甲基转移酶3B(DNMT3B)、p-Akt-S473蛋白表达量。 结果成功构建稳定、高表达miR-143的人肾癌786-O细胞株,miR-143转染组细胞miR-143表达量增高(P < 0.01)。舒尼替尼作用于786-O细胞48 h的IC50值为6 μmol/L,选取该值作为后续实验用药浓度。786-O细胞经舒尼替尼作用48 h后miR-143表达量升高(P < 0.01)。miR-143组和舒尼替尼组细胞存活率、细胞侵袭数、DNMT3B和p-AktS473蛋白表达量均低于对照组,且高于共同作用组,差异均有统计学意义(P < 0.05~P < 0.01)。 结论miR-143可以降低786-O细胞增殖、侵袭能力,这可能与miR-143降低DNMT3B、p-Akt的表达有关。舒尼替尼可能通过上调miR-143水平抑制786-O细胞的增殖与侵袭。 Abstract:ObjectiveTo investigate the role of miR-143 in renal cell carcinoma, the effect of sunitinib on the expression of miR-143 and its association with cell proliferation and invasion. MethodsThe human renal carcinoma 786-O cells were divided into control group, miR-143 group, sunitinib group and co-action group.The negative control sequence was transfected into the cells of control group, the miR-143 sequence was transfected into the cells of miR-143 group, sunitinib group cells were treated with sunitinib for 48h, the co-acting group was transfected miR-143 sequence and treated with sunitinib for 48h.Proliferation and invasion of 786-O cells were detected by MTT and transwell experiment, miR-143 RNA expression was detected by qRT-PCR, DNA methyltrans-ferase3B(DNMT3B).The expressions of p-Akt-S473 protein were detected by Western blotting. ResultsThe human renal cancer 786-O cells with stable and high expression of miR-143 were successfully constructed.The expression of miR-143 was increased in the miR-143 transfected group(P < 0.01).The IC50 value in 786-O cells with the treatment of sunitinib for 48 h was 6 μmol/L, which was selected as the drug concentration in the subsequent experiment.The expression of miR-143 in 786-O cells was increased after the treatment of sunitinib for 48 h(P < 0.01).Cell survival rate, cell invasion number, expressions of DNMT3B and p-Akt-S473 protein in miR-143 and sunitinib group were all lower than control group and higher than co-action group(P < 0.05 to P < 0.01). ConclusionsmiR-143 reduced the proliferation and invasion capacity of 786-O cells, which may be related to the decreased expression of DNMT3B and p-Akt regulated by miR-143.Sunitinib may inhibit the proliferation and invasion of 786-O cells by upregulating miR-143. -
Key words:
- renal cell carcinoma /
- sunitinib /
- miR-143 /
- proliferation /
- invasion
-
表 1 qRT-PCR检测miR-143表达量(x±s)
分组 n miR-143 对照组 3 1.00±0.02 miR-143组 3 2.07±0.09 ** 舒尼替尼组 3 1.69±0.03 ** F — 50.92 P — < 0.01 MS组内 — 0.017 q检验: 与对照组比较**P < 0.01 表 2 不同组细胞存活、侵袭、DNMT3B蛋白、p-AktS473蛋白表达比较(x±s)
分组 n 细胞存活率/% 细胞侵袭数/(个/视野) DNMT3B p-AktS473 对照组 3 100.00±0.00 183.80±3.54 0.44±0.03 0.22±0.02 miR-143组 3 83.75±2.45* 141.20±2.23** 0.31±0.02** 0.14±0.01** 舒尼替尼组 3 50.00±3.27**△△ 88.80±2.32**△△ 0.15±0.01**△△ 0.07±0.01**△△ 共同作用组 3 40.17±2.05**△△# 70.20±1.72**△△# 0.13±0.02**△△# 0.04±0.01**△△# F — 302.53 1 645.13 90.58 113.59 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 7.830 8.075 0.001 0.001 q检验:与对照组比较*P < 0.05, **P < 0.01;与miR-143组比较△△P < 0.01;与舒尼替尼组比较#P < 0.05 -
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China[J]. CA Cancer J Clin, 2016, 66(2): 115. doi: 10.3322/caac.21338 [2] CAI Y, YU X, HU S, et al. A brief review on the mechanisms of miRNA regulation[J]. Gen Pro Bio, 2009, 7(4): 147. doi: 10.1016/S1672-0229(08)60044-3 [3] YOSHINO H, ENOKIDA H, ITESAKO T, et al. Tumor-suppressive microRNA143-145 cluster targets hexokinase-2 in renal cell carcinoma[J]. Cancer Sci, 2013, 104(12): 1567. doi: 10.1111/cas.12280 [4] MIHALY Z, SZTUPINSZKI Z, SUROWIAK P, et al. A comprehensive overview of targeted therapy in metastatic renal cell carcinoma[J]. Curr Cancer Drug Targets, 2012, 12(7): 857. doi: 10.2174/156800912802429265 [5] PAPADOPOULOS EI, YOUSEF GM, SCORILAS A, et al. Cytotoxic activity of sunitinib and everolimus in Caki-1 renal cancer cells is accompanied by modulations in the expression of apoptosis-related microRNA clusters and BCL2 family genes[J]. Biomed Pharmacother, 2015, 70: 33. doi: 10.1016/j.biopha.2014.12.043 [6] ESCUDIER B, PORTA C, SCHMIDINGER M, et al. Renal cell carcinoma: ESMO clinical practice guidelines for diagnosistreatment and follow-up[J]. Ann Oncol, 2016, 27: 58. [7] KOVACOVA J, POPRACH A, BUCHLER T, et al. MicroRNAs as predictive biomarkers of response to tyrosine kinase inhibitor therapy in metastatic renal cell carcinoma[J]. Clin Chem Lab Med, 2018, 56(9): 1426. doi: 10.1515/cclm-2017-0861 [8] 谭亚, 周贤. MicroRNA-143与常见肿瘤关系的研究进展[J]. 西南军医, 2016, 18(6): 555. doi: 10.3969/j.issn.1672-7193.2016.06.020 [9] 龚彬彬. 白花丹素通过PI3K/AKT、MCM5抑制肾细胞癌增殖和侵袭转移的分子机制研究[D]. 南昌: 南昌大学, 2019. [10] 牛荣, 王转兄, 白悦, 等. miR-143-3p在胃癌组织中的表达和临床意义研究以及生信分析[J]. 中国普外基础与临床杂志, 2019, 26(5): 538. [11] 陈超, 张伟丽, 冯长松. lncRNA PCAT19靶向miR-143-3p通过信号通路PI3K/Akt对甲状腺癌细胞增殖和凋亡的影响及机制[J]. 中国老年学杂志, 2020, 40(8): 1712. doi: 10.3969/j.issn.1005-9202.2020.08.043 [12] LI M, WANG Y, SONG Y, et al. Expression profiling and clinicopathological significance of DNA methyltransferase 1, 3A and 3B in sporadic human renal cell carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(11): 7597. [13] BRITTANY N, LASSEIGNE, JAMES D, et al. The role of DNA methylation in renal cell carcinoma[J]. Mol Diagn Ther, 2018, 22(4): 431. doi: 10.1007/s40291-018-0337-9 [14] GUJAR H, WEISENBERGERDJ, LIANG G, et al. The Roles of human DNA methyltransferases and their isoforms in shaping the epigenome[J]. Genes, 2019, 10(2): 172. doi: 10.3390/genes10020172 [15] 周辉. MicroRNA-200b通过靶向DNMT3A及DNMT3B在肾细胞癌中调控MEG3表达[D]. 武汉: 华中科技大学, 2016. [16] ZHANG X, DONG Y, TI H, et al. Down-regulation of miR-145 and miR-143 might be associated with DNA methyltransferase 3B overexpression and worse prognosis in endometrioid carcinomas[J]. Hum Pathol, 2013, 44(11): 2571. doi: 10.1016/j.humpath.2013.07.002 -





 下载:
下载: