-
食管癌在中国的发病率居于世界前列[1]。其中食管鳞癌的新发病例数约占世界新发食管癌总数的53%[2]。目前放疗是临床上食管癌综合治疗的关键手段之一,主要包括术前放疗、同步放化疗,但是食管癌病人的5年存活率仅为15%~25%[3]。大量饮酒和吸烟及其协同作用是食管癌的主要危险因素[1]。此外,肿瘤与炎症之间存在一定联系[4]。2005年,KIM等[5]首次正式报道了一种新的促炎症因子-自然杀伤细胞转录物4的基因产物,并命名为白细胞介素(interleukin,IL)-32。近年有研究[6-11]表明,IL-32表达的高低与肿瘤细胞凋亡、转移、侵袭存在一定关系,甚至抑制肿瘤生长,但这种关系在不同的肿瘤中存在差异,并且对预后也产生不同的影响。基于此,本研究通过免疫组织化学法检测95例食管鳞癌病人肿瘤组织,了解IL-32在食管鳞癌组织中的表达情况,探讨病人IL-32与放疗预后关系。现作报道。
-
选取2014年1月至2016年1月连云港东方医院及连云港市第二人民医院收治的食管鳞癌病人95例。纳入标准:确诊为食管鳞癌病人,行根治性放射治疗,临床病理信息完整。所有病人均行食管镜活检,经病理诊断确诊为鳞癌,并在放疗前行胸部CT,腹部及锁骨上彩超等基线检查。其中男66例,女29例;年龄39~83岁;肿瘤位置:胸上段19例,胸中段42例,胸下段34例;根据UICC/AJCC第七版食管癌TNM分期标准:Ⅱ期49例,Ⅲ期46例;淋巴结转移阳性36例,阴性59例;中-高分化60例,低分化35例。其中行单纯放射治疗40例,行同步放化疗55例(化疗方案为以铂类为基础的联合化疗或多西他赛单药化疗)。
-
所有病人均行6 mV高能X线放射治疗。食管病灶区域放射治疗为60~66 Gy,各段相应淋巴结引流区域放射治疗为50 Gy。单次剂量为2 Gy,每天1次,每周5次。危及器官控制剂量:肺V20≤30%,V30≤20%;心脏V40≤40%;脊髓最大剂量 < 45 Gy。
-
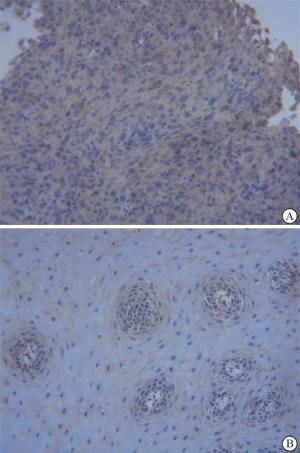
采用免疫组织化学法检测病人食管鳞癌组织中IL-32表达。兔抗人IL-32多克隆抗体购自美国Proteintech公司,免疫组织化学染色试剂盒购自武汉Servicebio公司。严格按照试剂说明完成实验。组织切片使用二甲苯、各浓度乙醇梯度脱蜡,使用柠檬酸钠-EDTA抗原修复液修复。3%H2O2孵育10 min阻断内源性过氧化物酶,BSA血清封闭30 min。加入稀释的兔抗IL-32抗体孵育,4 ℃过夜,选择相应的二抗室温孵育2 h,DAB显色,苏木精复染,脱水、透明、封片,显微镜采集图像并进行数据分析。以细胞质呈现黄色或棕黄色颗粒为IL-32阳性细胞,400倍显微镜下观察并对阳性细胞和所有细胞数进行计数,根据细胞染色程度和阳性细胞相对总细胞百分比,对染色结果进行半定量分析。细胞染色程度:0分为无色或淡蓝色无颗粒,1分为浅黄色颗粒,2分为较多棕黄色颗粒,3分为大量棕黄色或深棕色颗粒。每张切片阳性细胞占总细胞百分比:0分为 < 5%,1分为5%~ < 25%,2分为25%~ < 50%,3分为50%~ < 75%,4分为≥75%。两项评分乘积 < 4分计为阴性,其余计为阳性。
-
采用χ2检验、Kaplan-Meier生存分析、log-rank检验和Cox比例风险回归模型。
-
95例中IL-32低表达54例(56.84%),高表达41例(43.16%)。高表达组与低表达组病人性别、年龄、肿瘤位置、是否合并化疗差异均无统计学意义(P>0.05),而2组肿瘤分化程度差异有统计学意义(P < 0.05)(见图 1、表 1)。
临床特征 男 女 年龄/岁 肿瘤位置 分化程度 合并化疗 TNM分期/期 淋巴结转移 < 65 ≥65 胸上段 胸中段 胸下段 中-高 低 否 是 Ⅱ Ⅲ 阴性 阳性 低表达 40 14 15 39 14 25 15 29 25 24 30 25 29 33 21 高表达 26 15 16 25 5 17 19 31 10 16 25 24 17 26 15 χ2 1.25 1.34 4.56 4.8 0.28 1.4 0.05 P >0.05 >0.05 >0.05 < 0.05 >0.05 >0.05 >0.05 表 1 不同临床病理特征病人的IL-32表达(n)
-
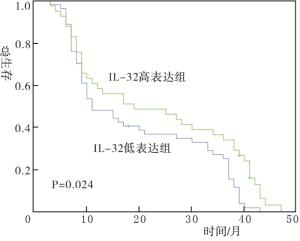
Kaplan-Meier生存分析显示,IL-32高表达组与IL-32低表达组预后差异有统计学意义(P < 0.05)(见图 2)。Cox多因素分析显示,合并化疗和IL-32高表达是食管鳞癌放疗病人预后的独立影响因素(P < 0.05)(见表 2)。
指标 B SE OR(95%CI) P 是否放化疗 0.452 0.216 0.637(0.417~0.972) < 0.05 分化程度 0.320 0.225 1.377(0.886~2.140) >0.05 性别 0.149 0.230 0.862(0.549~1.351) >0.05 年龄 0.242 0.237 1.273(0.800~2.026) >0.05 IL-32 0.486 0.235 0.615(0.388~0.974) < 0.05 表 2 食管鳞癌放疗病人预后影响因素的Cox回归分析
-
25%的上皮源性肿瘤由慢性感染或者慢性炎症导致[12]。作为一种新的促炎症因子,IL-32基因位于人类染色体16p13.3上。IL-32有9种可变剪接的亚型,分别为IL-32α、IL-32β、IL-32γ、IL-32δ、IL-32ε、IL-32ζ、IL-32η、IL-32θ、IL-32small。就分子量及对细胞作用而言,IL-32γ是最大最有效的亚型[13]。研究[14]表明,IL-32的结构呈现典型的α-螺旋,类似于黏附激酶的黏附靶区(FAT),而这是整合素结合后的重要信号传导介质。所以因IL-32类似于FAT的结构,其可能成为FAT活化的天然调节因子。
IL-32通过对许多癌症细胞的代谢和调亡产生不同作用而影响肿瘤进展。本研究结果显示,IL-32高表达组与IL-32低表达组预后差异有统计学意义,IL-32高表达是食管鳞癌放疗病人预后的独立影响因素。提示IL-32高表达病人放疗后预后优于IL-32低表达者。而DONNEM等[8]在肾透明细胞癌的研究中发现,IL-32过表达与高复发率呈正相关关系,与无病生存率和总生存率呈负相关关系。不过有研究[15]发现,在人IL-32γ过表达转基因小鼠模型中,IL-32γ会通过抑制持续激活的NF-κB和信号转导和转录激活因子(STAT)3来抑制体外和体内黑素瘤和结肠癌肿瘤生长。STAT3是STAT蛋白家族的主要成员和重要的核转录因子。STAT3目前被认为是增加放射敏感性的关键基因,抑制STAT3/HIF-1α/VEGF信号通路可以逆转食管癌细胞的放射抵抗[16-17]。因此,有理由认为高表达的IL-32可能通过抑制STAT3信号通路增强食管癌放疗效果,继而影响食管癌预后。同时本研究结果也显示,合并化疗是食管鳞癌放疗病人预后的独立影响因素。有研究[18]表明,不同亚型的急性白血病血清中IL-32表达程度不同。化疗与IL-32亦可能发生协同作用,增加化疗效果,延长病人总生存时间。
综上,IL-32高表达是中期食管鳞癌放疗后预后的独立影响因素,IL-32可能作为一种新的治疗靶点,为食管鳞癌的治疗提供新的方法。但本研究属于回顾性研究,且总样本量较少,仍需要开展大样本、多中心的前瞻性研究进一步验证。未来还需进一步阐明IL-32及各种亚型对食管鳞癌细胞放疗作用的分子机制。
IL-32表达与食管鳞癌放疗后预后的关系
Relationship between IL-32 expression and prognosis of esophageal squamous cell carcinoma after radiotherapy
-
摘要:
目的探讨白细胞介素(IL)-32在食管鳞癌组织中的表达及其与放疗后预后的关系。 方法回顾性分析食管鳞癌病人95例的临床资料,采用免疫组织化学法检测病人食管鳞癌组织中IL-32表达,按照IL-32表达情况分为IL-32高表达组41例和低表达组54例,比较2组病人相关临床特征及预后情况。 结果IL-32高表达组与低表达组病人性别、年龄、肿瘤位置、是否合并化疗差异均无统计学意义(P>0.05),而2组肿瘤分化程度差异有统计学意义(P < 0.05)。Kaplan-Meier生存分析显示,2组预后差异有统计学意义(P < 0.05)。Cox多因素分析显示,合并化疗和IL-32高表达是食管鳞癌放疗病人预后的独立影响因素(P < 0.05)。 结论IL-32高表达是中期食管鳞癌放疗后预后的独立影响因素。 Abstract:ObjectiveTo investigate the expression level of interleukin(IL)-32 in esophageal squamous cell carcinoma, and its relationship with the curative effects after radiotherapy. MethodsThe clinical data of 95 patients with esophageal squamous cell carcinoma were retrospectively analyzed.The expression levels of IL-32 in patients with esophageal squamous cell carcinoma were detected using immunohistochemistry.According to the expression level of IL-32, the patients were divided into the high expression group(41 cases) and low expression group(54 cases).The clinical features and prognosis were compared between two groups. ResultsThere was no statistical significance in the gender, age, tumor location and chemotherapy between two groups(P>0.05), while the difference of the tumor differentiation degree between two groups was statistically significant(P < 0.05).The results of Kaplan-Meier survival analysis showed that the difference of the prognosis between two groups was statistically significant(P < 0.05).The results of Cox multivariate analysis showed that the combined chemotherapy and high expression of IL-32 were the independent influencing factors of prognosis in patients with esophageal squamous cell carcinoma(P < 0.05). ConclusionsThe high expression of IL-32 is an independent risk factor of prognosis in patients with intermediate esophageal squamous cell carcinoma after radiotherapy. -
Key words:
- esophageal neoplasm /
- interleukin-32 /
- radiotherapy /
- prognosis
-
表 1 不同临床病理特征病人的IL-32表达(n)
临床特征 男 女 年龄/岁 肿瘤位置 分化程度 合并化疗 TNM分期/期 淋巴结转移 < 65 ≥65 胸上段 胸中段 胸下段 中-高 低 否 是 Ⅱ Ⅲ 阴性 阳性 低表达 40 14 15 39 14 25 15 29 25 24 30 25 29 33 21 高表达 26 15 16 25 5 17 19 31 10 16 25 24 17 26 15 χ2 1.25 1.34 4.56 4.8 0.28 1.4 0.05 P >0.05 >0.05 >0.05 < 0.05 >0.05 >0.05 >0.05 表 2 食管鳞癌放疗病人预后影响因素的Cox回归分析
指标 B SE OR(95%CI) P 是否放化疗 0.452 0.216 0.637(0.417~0.972) < 0.05 分化程度 0.320 0.225 1.377(0.886~2.140) >0.05 性别 0.149 0.230 0.862(0.549~1.351) >0.05 年龄 0.242 0.237 1.273(0.800~2.026) >0.05 IL-32 0.486 0.235 0.615(0.388~0.974) < 0.05 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394. doi: 10.3322/caac.21492 [2] ARNOLD M, SOERJOMATARAM I, FERLAY J, et al. Global incidence of esophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64(3): 381. doi: 10.1136/gutjnl-2014-308124 [3] ENZINGER PC, MAYER RJ. Esophageal cancer[J]. N Engl J Med, 2003, 349(23): 2241. doi: 10.1056/NEJMra035010 [4] GRIVENNIKOV SI, GRETEN FR, KARIN M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883. doi: 10.1016/j.cell.2010.01.025 [5] KIM S, HAN S, AZAM T, et al. Interleukin-32: a cytokine and inducer of TNF-α[J]. Immunity, 2005, 22(1): 131. [6] HEINHUIS B, PLANTINGA TS, SEMANGO G, et al. Alternatively spliced isoforms of IL-32 differentially influence cell death pathways in cancer cell lines[J]. Carcinogenesis, 2016, 37(2): 197. doi: 10.1093/carcin/bgv172 [7] LEE YS, KIM KC, MONGRE RK, et al. IL-32γ suppresses lung cancer stem cell growth via inhibition of ITGAV-mediated STAT5 pathway[J]. Cell Death Dis, 2019, 10(7): 506. doi: 10.1038/s41419-019-1737-4 [8] DONNEM T, HU J, FERGUSON M, et al. Vessel co-option in primary human tumors and metastases: an obstacle to effective anti-angiogenic treatment?[J]. Cancer Med, 2013, 2(4): 427. doi: 10.1002/cam4.105 [9] HANAHAN D, WEINBERG RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646. doi: 10.1016/j.cell.2011.02.013 [10] YUN J, PARK MH, SON DJ, et al. IL-32 gamma reduces lung tumor development through upregulation of TIMP-3 overexpression and hypomethylation[J]. Cell Death Dis, 2018, 9(3): 306. doi: 10.1038/s41419-018-0375-6 [11] BHAT S, GARDI N, HAKE S, et al. Impact of intra-tumoral IL17A and IL32 gene expression on T cell responses and lymph node status in breast cancer patients[J]. Cancer Res Clin Oncol, 2017, 143(9): 1745. doi: 10.1007/s00432-017-2431-5 [12] HONG JT, SON DJ, LEE CK, et al. Interleukin 32, inflammation and cancer[J]. Pharmacol Therapeut, 2017, 174: 127. doi: 10.1016/j.pharmthera.2017.02.025 [13] JOOSTEN LA, HEINHUIS B, NETEA MG, et al. Novel insights into the biology of interleukin-32[J]. Cell Mol Life Sci, 2013, 70(20): 3883. doi: 10.1007/s00018-013-1301-9 [14] HEINHUIS B, KOENDERS MI, VANDENBERG WB, et al. Interleukin 32(IL-32) contains a typical α-helix bundle structure that resembles focal adhesion targeting region of focal adhesion kinase-1[J]. J Biol Chem, 2012, 287(8): 5733. doi: 10.1074/jbc.M111.288290 [15] OH JH, CHO MC, KIM JH, et al. IL-32γ inhibits cancer cell growth through inactivation of NF-κB and STAT3 signals[J]. Oncogene, 2011, 30(30): 3345. doi: 10.1038/onc.2011.52 [16] WANG M, MENG B, LIU Y, et al. MiR-124 inhibits growth and enhances radiation-induced apoptosis in non-small cell lung cancer by inhibiting STAT3[J]. Cell Physiol Biochem, 2017, 44(5): 2017. doi: 10.1159/000485907 [17] ZHANG Q, ZHANG C, HE J, et al. STAT3 inhibitor stattic enhances radiosensitivity in esophageal squamous cell carcinoma[J]. Tumor Biol, 2015, 36(3): 2135. doi: 10.1007/s13277-014-2823-y [18] 袁宁, 吴佗, 侯佩强, 等. 急性白血病患者血清中IL-32的表达及其临床意义[J]. 中华血液学杂志, 2015, 36(10): 868. doi: 10.3760/cma.j.issn.0253-2727.2015.10.014 -




 下载:
下载: