-
术后肺部相关并发症(postoperative pulmonary complications,PPC)是影响肺癌病人围术期康复以及术后生活质量的重要因素[1]。肺不张、肺炎、胸腔积液、肺水肿、气胸等是心胸手术后常见的并发症,且与不良预后相关[2],如何准确地对病人进行肺功能评估,降低肺脏病人PPC的发生率成为临床医生的难题。随着技术的进步,肺超声检查在临床上的应用日益广泛,具有无创、重复性高、经济等优点,已被应用于儿童肺脏疾病[3]及危重症病人[4]的诊疗中,并有确切效果。目前国内关于肺超声评分(LUS)应用于老年病人肺部手术PPC的研究报道较少,本研究通过将肺超声检查技术应用于肺癌根治术病人,旨在分析此类病人PPC的发生率,并探讨较好的LUS干预措施。
-
选择我院2019年7月至2020年5月择期行胸腔镜下肺癌根治肺叶切除术的老年病人60例,男44例,女16例,年龄(68.52±4.47)岁。纳入标准:美国麻醉医师学会(ASA)分级Ⅱ~Ⅲ级,年龄60~75岁,体质量指数(BMI) 18.5~30 kg/m2,意识清楚,能够积极配合检查。排除标准:严重心、肝、肾功能异常、慢性阻塞性肺疾病、未控制的高血压、糖尿病、近期发生心脑血管意外,皮下气肿。肺超声检查为无创操作,告知病人获得同意,本研究不对病人收取肺超声检查费用,病人在检查过程中可随时拒绝操作检查。病人入室后开放外周静脉,行麻醉常规监测,局麻下行桡动脉穿刺置管测压,采集血样做血气分析。术中行双腔气管插管保护性肺通气策略,维持病人生命体征稳定,灵活运用血管活性药物。术后所有病人使用48 h自控静脉镇痛。
-
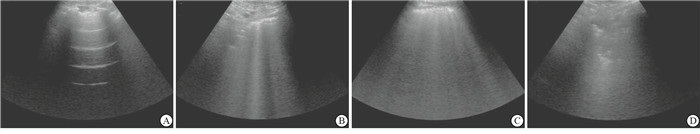
肺超声检查使用索诺声便携式彩超M-Turbo超声检查仪,C60x凸阵探头2~5 mHz。病人进入手术室后,由经过专门训练的人员进行肺超声检查,以病人胸旁线、腋前线、腋后线和椎旁线及乳头平面为界划定的十二个肺区对病人进行肺超声检查,并保存影像资料。根据检查结果对每一分区分别评分,然后相加得出最终评分,如果一个分区内有多种超声表现,则取最大值的评分。分值范围0~36分,分数越高,说明病人肺部病变越重。评分标准为:0分=正常通气;1分=通气中度丧失:肺间质综合征(多个间隔B线,或局限性肺水肿,在横向平面查到的B线小于肋间隙的50%,或胸膜下实变);2分=通气严重丧失(肺泡水肿,弥漫性聚集B线并占据整个肋间隙);3分=通气完全丧失(肺实变,伴或不伴支气管充气征)[4-6](见图 1)。
-
记录所有病人术前LUS、年龄、性别、ASA分级、吸烟史、肺超声检查时未吸氧状态的氧分压(PO2)、氧饱和度、呼吸频率、手术机械通气时间、总住院时间、术后住院时间及PPC发生情况。
-
PPC为发生在住院期间的呼吸系统功能障碍或其他与肺部相关的疾病,这些疾病与临床相关并影响临床病程。PPC的诊断基于临床表现、放射学检查、实验室检查和肺超声检查。PPC包括肺炎、呼吸衰竭、肺不张、肺水肿、气胸、胸腔积液、急性呼吸窘迫综合征、支气管胸膜瘘、低氧血症、支气管哮喘、脓胸等。按是否发生PPC分为2组:有并发症组(PPC组)和无并发症组(nPPC组)。采用受试者工作特征曲线(ROC)评价LUS预测病人发生PPC的情况。
-
采用χ2检验、t检验、Pearson相关分析和Spearman相关分析。
-
2组ASA分级、性别、吸烟史差异均无统计学意义(P>0.05)。PPC组总住院时间、术后住院时间、LUS均高于nPPC组(P < 0.05~P < 0.01)(见表 1)。
指标 nPPC组
(n=35)PPC组
(n=25)t P ASA Ⅱ/Ⅲ级 14/21 8/17 0.40* >0.05 年龄/岁 67.71±4.23 69.64±4.63 1.68 >0.05 男/女 7/28 9/16 1.91* >0.05 吸烟史/例 12 6 0.73* >0.05 PaO2/mmHg 79.03±3.03 78.00±3.44 1.23 >0.05 氧饱和度/% 96.26±1.22 95.56±1.73 1.84 >0.05 呼吸频率/(次/分) 17.86±1.48 18.60±1.83 1.73 >0.05 手术机械通气时间/min 157.40±29.41 153.68±19.93 0.55 >0.05 总住院时间/d 17.63±5.14 24.72±12.11 2.76 < 0.05 术后住院时间/d 7.11±2.14 13.72±7.75 4.15 < 0.01 LUS/分 12.34±1.88 14.88±2.22 4.78 < 0.01 *示χ2值 表 1 一般资料比较(x±s)
-
本研究60例病人中,25例出现PPC,其中肺炎11例(44.00%),呼吸衰竭7例(28.00%),肺不张7例(28.00%),低氧血症4例(16.00%),急性呼吸窘迫综合征4例(16.00%),胸腔积液4例(16.00%),残肺端漏气2例(8.00%),支气管胸膜瘘1例(4.00%)。肺炎、呼吸衰竭、肺不张发生率最高。
-
nPPC组病人的术前LUS为(12.34±1.88)分,PPC组病人的术前LUS为(14.88±2.22)分。LUS与年龄、PaO2、氧饱和度、呼吸频率、总住院时间、术后住院时间、PPC均呈正相关关系(P < 0.05~P < 0.01)(见表 2)。
指标 r P 年龄 0.316 < 0.01 ASA分级 0.106 >0.05 PO2 -0.347 < 0.01 氧饱和度 -0.280 < 0.05 呼吸频率 0.327 < 0.05 手术机械通气时间 -0.084 >0.05 总住院时间 0.312 < 0.05 术后住院时间 0.375 < 0.01 PPC 0.521 < 0.01 表 2 LUS与各项监测指标的相关性
-
对2组病人之间的LUS进行ROC曲线分析,LUS预测病人发生PPC的曲线下面积为0.802[95%CI(0.690,0.914)](见图 2);根据曲线及约登指数得出,LUS的最佳临界值为12.5分,此时病人发生PPC的灵敏度及特异度分别为88.0%、57.1%。
-
术后肺部并发症是我国老年肺癌病人术后死亡的重要原因。接受肺癌手术的病人是肺部并发症的高危人群,他们大多同时患有慢性阻塞性肺疾病、有大量吸烟史或其他并存的疾病,并且有可能因肺切除而导致进一步的换气不足。主要的影像学检查方法中, X线和CT检查均有一定局限性。病人术前的肺功能状况与PPC的发生有重要关系,术前准确的肺功能状况评估,对术后肺部并发症的评估及提高术后生存质量等具有重要临床意义。肺功能检查是肺癌病人的必备检查,其局限性也很明显。
LICHTENSTEI等[7]于1995年首次提出肺超声检查在危重病人中的应用价值。床旁肺超声作为一种高灵敏度、高特异性的影像学检查手段,越来越多地用于重症监护病房的肺病理诊断。近年来,超声技术也逐步被麻醉科广泛使用[8],超声技术成为新时代麻醉医生的一项基础技能。超声技术的发展及其在危重病人中的广泛应用,使肺超声成为评估机械通气病人肺功能状态的一种重要工具,肺超声在许多病理条件下有较高的准确性,如肺实变、胸腔积液、间质综合征和气胸[9]。
肺超声检查在肺部条件下有一定的局限性,但随着技术进步以及临床实践,对肺部超声图像的认识逐渐提高。健康正常通气的肺由于其高的声阻抗而反射超声束,并且仅显示一个高反射性胸膜线的解剖标志,该胸膜线随着呼吸在组织和空气之间滑动。正常的肺显示胸膜线以下的水平伪影,称为A线。从干燥的肺逐渐过渡到湿润的肺,这使得超声束的反射得以改变,并导致了称为b线[10]的垂直伪影的形成。垂直伪影的增加与肺充血程度的增加相对应,并可对肺通气进行量化。在胸膜线附近,以强化的形式显示肺泡空气缺乏的肺通气不良区域[11]。因此肺超声可以判断肺水肿的严重程度,可以对肺通气损伤的严重程度进行评估,LUS就是以此为基础发展而来的一种肺损伤评估方法[12]。已有研究表明如果将肺超声作为筛选临床相关PPC的主要成像技术,其表现会更好[2]。肺超声可能更有助于临床PPC的及时诊断,从而使治疗得以早期开始。
肺超声评分为肺损伤严重程度的评估提供了量化指标[13]。nPPC组术前LUS为(12.34±1.88)分,PPC组术前LUS为(14.88±2.22)分。本研究显示LUS与术后住院时间、PPC发生呈正相关关系(P < 0.01)。这些参数与病人肺功能相关,肺功能越差,PO2越低,氧饱和度越低,越有可能发生PPC,术后住院时间越长,说明LUS可以预测PPC的发生。此次研究以LUS 12.5分为预测值,病人发生PPC的灵敏度及特异度分别为88.0%、57.1%。因此,当病人LUS>12分时,应早期干预,预防PPC的发生。
本研究的局限性:在我们使用的方案中,并没有确定并发症的严重程度,只是评估为二分法,或者有并发症,或者没有;样本量较小;被气体遮挡的肺病变超声无法检测,可能出现假阴性。
综上所述,肺超声评分可定量评估老年病人肺癌根治术PPC的发生,可以指导临床诊疗。
术前肺超声评分与老年病人肺癌根治术术后肺部并发症的相关性研究
Correlation between preoperative lung ultrasound score and postoperative pulmonary complications in elderly patients undergoing radical resection of lung cancer
-
摘要:
目的分析术前肺超声评分(LUS)与病人临床资料的相关性,探讨其在术后肺部并发症(PPC)预测中的作用。 方法选取60例择期行肺癌根治术的老年病人,按是否发生PPC分为2组:有并发症组(PPC组)25例和无并发症组(nPPC组)35例。术前进行肺超声检查,计算LUS;记录病人的术前氧分压(PO2)、氧饱和度、呼吸频率、手术机械通气时间、总住院时间、术后住院时间;记录PPC发生情况。分析LUS与各项监测指标的相关性;应用ROC曲线评价LUS预测病人发生PPC的价值。 结果nPPC组术前LUS为(12.34±1.88)分,PPC组术前LUS为(14.88±2.22)分,LUS与年龄、PO2、氧饱和度、呼吸频率、总住院时间、术后住院时间、PPC均呈正相关关系(P < 0.05~P < 0.01)。PPC组LUS、总住院时间、术后住院时间均高于nPPC组(P < 0.05~P < 0.01)。以LUS 12.5分预测病人发生PPC的灵敏度及特异度分别为88.0%、57.1%。 结论LUS可定量评估老年病人肺癌根治术PPC的发生,可以指导临床诊疗。 Abstract:ObjectiveTo analyze the correlation between lung ultrasound score(LUS) and clinical data of patients and explore its role in predicting postoperative pulmonary complications(PPC). MethodsSixty cases of elderly patients who underwent radical resection of lung cancer were divided into two groups: PPC group(n=25) and nPPC group(n=35) according to the PPC occurrence.Lung ultrasound examination was performed before surgery to calculate LUS.Preoperative oxygen partial pressure(PO2), oxygen saturation, respiratory rate, operation mechanical ventilation time, total hospital stay, postoperative hospital stay and the occurrence of PPC were recorded.The correlation between LUS and monitoring indicators was analyzed.ROC curve was used to evaluate the value of LUS in predicting the occurrence of PPC in patients. ResultsThe preoperative score of LUS in nPPC and PPC group was(12.34±1.88) and(14.88±2.22), respectively.LUS was positively correlated with age, PO2, oxygen saturation, respiratory rate, total length of hospital stay, postoperative length of hospital stay and PPC(P < 0.05 to P < 0.01).LUS, total hospital stay and postoperative hospital stay in PPC group was higher than that in nPPC group (P < 0.05 to P < 0.01).The point for LUS to predict the occurrence of PPC was 12.5 with the sensitivity of 88.0% and the specificity of 57.1%. ConclusionsLUS can quantitatively pre-evaluate the occurrence of PPC after radical resection of lung cancer in elderly patients, which helps to guide clinical diagnosis and treatment. -
表 1 一般资料比较(x±s)
指标 nPPC组
(n=35)PPC组
(n=25)t P ASA Ⅱ/Ⅲ级 14/21 8/17 0.40* >0.05 年龄/岁 67.71±4.23 69.64±4.63 1.68 >0.05 男/女 7/28 9/16 1.91* >0.05 吸烟史/例 12 6 0.73* >0.05 PaO2/mmHg 79.03±3.03 78.00±3.44 1.23 >0.05 氧饱和度/% 96.26±1.22 95.56±1.73 1.84 >0.05 呼吸频率/(次/分) 17.86±1.48 18.60±1.83 1.73 >0.05 手术机械通气时间/min 157.40±29.41 153.68±19.93 0.55 >0.05 总住院时间/d 17.63±5.14 24.72±12.11 2.76 < 0.05 术后住院时间/d 7.11±2.14 13.72±7.75 4.15 < 0.01 LUS/分 12.34±1.88 14.88±2.22 4.78 < 0.01 *示χ2值 表 2 LUS与各项监测指标的相关性
指标 r P 年龄 0.316 < 0.01 ASA分级 0.106 >0.05 PO2 -0.347 < 0.01 氧饱和度 -0.280 < 0.05 呼吸频率 0.327 < 0.05 手术机械通气时间 -0.084 >0.05 总住院时间 0.312 < 0.05 术后住院时间 0.375 < 0.01 PPC 0.521 < 0.01 -
[1] LAI Y, DU H, WANG X, et al. Status and perspectives of clinical modes in surgical patients with lung cancer: a retrospective study[J]. Medicine, 2016, 95(2): e2429. doi: 10.1097/MD.0000000000002429 [2] TOUW HR, PARLEVLIET KL, BEEREPOOT M, et al. Lung ultrasound compared with chest X-ray in diagnosing postoperative pulmonary complications following cardiothoracic surgery: a prospective observational study[J]. Anaesthesia, 2018, 73(8): 946. doi: 10.1111/anae.14243 [3] 于红奎, 刘晓, 陈嘉坤, 等. 肺超声评分对儿童重症肺炎定量评估及预后判断的价值[J]. 中国超声医学杂志, 2019, 35(3): 229. [4] ROUBY JJ, ARBELOT C, GAO Y, et al. Training for lung ultrasound score measurement in critically ill patients[J]. Am J Respir Crit Care Med, 2018, 198(3): 398. doi: 10.1164/rccm.201802-0227LE [5] SOUMMER A, PERBET S, BRISSON H, et al. Ultrasound assessment of lung aeration loss during a successful weaning trial predicts postextubation distress[J]. Crit Care Med, 2012, 40(7): 2064. doi: 10.1097/CCM.0b013e31824e68ae [6] CALTABELOTI FP, ROUBY JJ. Lung ultrasound: a useful tool in the weaning process?[J]. Rev Bras Ter Intensiva, 2016, 28(1): 5. [7] LICHTENSTEIN D, MENU Y. A bedside ultrasound sign ruling out pneumothorax in the criticall ill. Lung sliding[J]. Chest, 1995, 108(5): 1345. doi: 10.1378/chest.108.5.1345 [8] SKUBAS NJ. Teaching whole body point-of-care ultrasound: advancing the skills of tomorrow's anesthesiologists[J]. Anesthesiology, 2015, 123(3): 499. doi: 10.1097/ALN.0000000000000777 [9] ZHOU J, SONG J, GONG S, et al. Lung ultrasound combined with procalcitonin for a diagnosis of ventilator-associated pneumonia[J]. Respir Care, 2019, 64(5): 519. doi: 10.4187/respcare.06377 [10] LICHTENSTEIN D, MEZIERE G, BIDERMAN P, et al. The comet-tail artifact. An ultrasound sign of alveolar-interstitial syndrome[J]. Am J Respir Crit Care Med, 1997, 156(5): 1640. doi: 10.1164/ajrccm.156.5.96-07096 [11] BASILE V, DI MAURO A, SCALINI E, et al. Lung ultrasound: a useful tool in diagnosis and management of bronchiolitis[J]. BMC Pediatr, 2015, 15(1): 63. doi: 10.1186/s12887-015-0380-1 [12] JAMBRIK Z, MONTI S, COPPOLA V, et al. Usefulness of ultrasound lung comets as a nonradiologic sign of extravascular lung water[J]. Am J Cardiol, 2004, 93(10): 1265. doi: 10.1016/j.amjcard.2004.02.012 [13] MONGODI S, VIA G, GIRARD M, et al. Lung ultrasound for early diagnosis of ventilator-associated pneumonia[J]. Chest, 2016, 149(4): 969. doi: 10.1016/j.chest.2015.12.012 -





 下载:
下载: