-
肠道屏障是由肠上皮细胞(intestinal epithelial cells,IECs)之间的紧密连接组成的,是抵御有害物质由肠道入侵机体的关键[1]。在创伤失血性休克(traumatic hemorrhagic shock,THS)中,人体血量的再分配显著减少肠黏膜的血流量,以优化心脏和大脑等重要器官的血供。然而,缺血缺氧性损伤对IECs的另一个后果是ATP减少和紧密连接破裂,进一步导致肠道屏障功能障碍[2]。肠道含有的大量细菌和其他微生物分子从肠道移位到循环系统被认为是该系统介导全身炎症反应发生的重要贡献者[3]。人们逐渐认识到肠屏障功能的损害成为THS诱导多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的启动和发展的关键因素[4]。因此,预防或改善肠屏障功能障碍将是预防THS相关MODS发生一个关键的治疗策略。近年来发现,人类疾病与肠道益生菌越来越相关,而乳酸菌(LAB)作为最具有代表性的益生菌研究最为广泛[5]。而目前对于THS在应用新型复苏液醋酸钠林格液复苏基础上应用乳酸菌探究对肠黏膜屏障的保护作用的研究较少。
既往研究[6-7]表明,TLR4-MAPK信号通路与急性肠道/肺损伤密切相关。因此针对TLR4-MAPK信号通路研究醋酸钠林格液复苏联合乳酸菌对THS大鼠肠黏膜屏障的保护作用是可行的。本研究通过前期应用乳酸菌素片饲养SD大鼠,后期通过建立THS模型,探究醋酸钠林格液复苏基础上应用乳酸菌对THS大鼠肠黏膜屏障作用机制。
-
取健康SD大鼠30只,SPF级,雌雄不限,体质量(270±10)g(由上海杰思捷实验动物有限公司提供)。于蚌埠医学院动物实验中心在室温(22±1)℃、湿度40%~45%、以12 h光照/黑暗周期下饲养1周。乳酸菌素片购于江西江中药业股份有限公司(每粒0.4 g,编号:A13202222273),醋酸钠林格液购于湖南康源制药有限公司,一抗稀释液(MDL MD412899),二抗稀释液(MDL MD51233),中等蛋白分子量marker(DA2019),ZO-1 antibody(MD1502)、Claudin-1antibody(MD2430)、TLR4 antibody(MD2233)、P-JNK antibody(MD3452),P-P38 antibody(MD7543)均购于MDL公司。ELISA试剂盒购于上海代轩生物科技有限公司。
-
取30只SD大鼠数字法随机分为THS未复苏组(THS组,n=10),醋酸钠林格液复苏组(AR组,n=10),醋酸钠林格液联合乳酸菌复苏组(AL组,n=10),其中AL组大鼠建立休克模型前在正常喂养的基础上加服用乳酸菌素片1周(按照体积面积换算,大鼠每次服用剂量108 mg/kg,每天3次)。
-
将3组大鼠通过腹腔注射2%戊巴比妥钠(40 mg/kg)进行麻醉后,将大鼠固定在恒温手术台,右侧股骨通过重物坠落撞击构建粉碎性骨折,右侧股动脉置管快速放血,左侧股动脉置管予以监测平均动脉压(MAP)(测压管中预先应用2.5%的枸橼酸钠葡萄糖注射液预防血液凝固),并于30 min内将MAP降至(35±5)mmHg,维持4 h;左侧股静脉置管后期予以休克复苏补液。置管后,大鼠适应20 min。THS组、AR组及AL组制作休克模型:用1 mL含有提前填充枸橼酸钠溶液0.1 mL注射器从股动脉以2 mL/3min速度缓慢放血,直至MAP达(35±5)mmHg,大概需要20 min,后续通过缓慢回输自体血或少量放血维持MAP在(35±5)mmHg区间波动1 h,THS组不予以液体复苏,观察4 h后取大鼠回肠组织。AR组与AL组在休克维持1 h后,利用醋酸钠林格液于左侧股静脉通过微量泵进行限制性液体复苏(通过限制输入液体的量和静脉泵入速度,30 min内控制65 mmHg≤MAP<70 mmHg,并维持30 min,后继续将大鼠复苏至正常血压水平),复苏成功后观察4 h后处死取大鼠回肠组织置于-80 ℃冰箱保存。本研究严格按照美国国立卫生研究院《实验动物的护理和使用指南》的建议进行,并得到了蚌埠医学院实验动物管理和伦理委员会批准进行。
-
按照ELISA试剂盒操作说明,检测3组大鼠外周血中肿瘤坏死因子-α(TNF-α)、白细胞介素(IL-6)、IL-4及IL-10含量。
-
取超低温冰箱中冷冻的回肠组织,加入裂解液离心30 min获取上清液,于-80 ℃冰箱冻存备用。采用BCA试剂检测上述蛋白浓度后,经SDS-PAGE分离后经过转移电泳转印至PVDF膜。分别加入相应一抗在4 ℃孵育过夜并经过TBST洗膜3次,再加入碱性磷酸酶(AP)标记的二抗,室温孵育1 h后利用TBST洗膜3次,ECL化学发光、显影、定影、拍照,最后利用图像分析软件Scion Image对蛋白带进行吸光度分析。将目的蛋白与β-actin灰度值进行比值即为蛋白相对表达量。
-
回肠组织在经过10%甲醛溶液内固定、石蜡包埋且卡片、HE染色后在光镜下进行小肠组织形态学观察。
-
统计学方法采用单因素方差分析和q检验。
-
经单因素方差分析,3组大鼠体质量、基础MAP差异均无统计学意义(P>0.05)(见表 1)。
分组 n 体质量/g 平均动脉压/mmHg THS组 10 271.04±10.23 103.12±4.35 AR组 10 273.28±9.71 104.09±6.05 AL组 10 269.25±11.75 102.94±3.20 F — 0.36 0.18 P — >0.05 >0.05 MS组内 — 3 033.431 591.412 表 1 3组大鼠体质量和基础平均动脉压比较(x±s)
-
与THS组相比,AL组大鼠外周血TNF-α、IL-6含量降低,IL-4、IL-10含量升高,AR组TNF-α含量降低,差异均有统计学意义(P<0.05);与AR组比较,AL组大鼠外周血TNF-α含量降低,差异有统计学意义(P<0.05),其余各细胞因子水平AR组和AL组比较差异无统计学意义(P>0.05)(见表 2)。
分组 n TNF-α IL-6 IL-4 IL-10 THS组 10 185.98±15.43 80.54±13.77 24.54±7.97 38.64±10.43 AR组 10 143.09±13.08* 70.35±11.54 27.77±6.76 40.03±13.08 AL组 10 122.06±14.66*△ 62.76±7.73* 33.46±8.07* 50.874±9.55* F — 50.99 6.24 3.50 3.63 P — <0.01 <0.01 <0.05 <0.05 MS组内 — 5 617.439 3 442.526 1 572.004 3 339.051 q检验:与THS组比较*P<0.05;与AR组比较△P<0.05 表 2 3组大鼠外周血细胞因子含量比较(x±s; pg/mL)
-
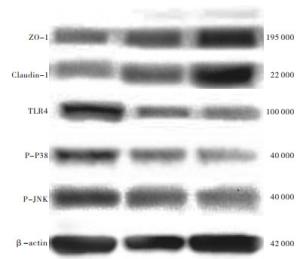
各组回肠组织,与THS组相比,AR组大鼠外周血TLR4、P-P38、P-JNK含量降低,AL组ZO-1、Claudin-1含量升高,差异均有统计学意义(P<0.05);与AR组相比,AL组ZO-1、Claudin-1含量升高,TLR4、P-JNK含量降低,差异均有统计学意义(P<0.05)(见图 1、表 3)。
分组 n ZO-1 Claudin-1 TLR4 P-P38 P-JNK THS组 10 0.32±0.10 0.21±0.08 0.44±0.13 0.72±0.21 0.85±0.10 AR组 10 0.38±0.14 0.28±0.15 0.29±0.09* 0.52±0.18* 0.56±0.14* AL组 10 0.51±0.13*△ 0.41±0.11*△ 0.18±0.13*△ 0.47±0.16* 0.41±0.12*△ F — 5.97 8.06 12.72 5.50 33.97 P — <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 — 0.435 0.346 0.380 0.886 0.399 q检验:与THS组比较*P<0.05;与AR组比较△P<0.05 表 3 3组大鼠回肠组织ZO-1、Claudin-1、TLR4、p38磷酸化及JNK磷酸化蛋白相对表达水平比较(x±s)
-
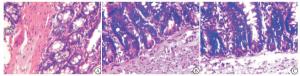
在光镜下观察:THS组回肠黏膜完整性破坏,黏膜层可见大量中性粒细胞浸润,绒毛黏膜及黏膜下间质水肿明显,间质层可见淤血;AR组较THS组回肠黏膜完整性破坏少,可见中性粒细胞浸润,黏膜下间质水肿减轻;AL组回肠黏膜结构完整,较少中性粒细胞浸润,无间质淤血表现,间质无明显水肿(见图 2)。
-
THS病人肠道血流减少导致的肠道菌群移位是介导全身炎症反应的重要因素[8]。本研究的重点是前期应用乳酸菌饲养SD大鼠,通过建立THS模型,观察利用醋酸钠林格液限制性液体复苏对大鼠肠黏膜屏障的影响。
THS激发全身炎症反应包括激活先天免疫反应和瀑布样促炎细胞因子的释放, 尤其是TLR4在宿主防御病原微生物入侵并识别与病原相关分子模式中扮演一个关键角色[9]。TLR4活化已被证实在许多细胞内信号转导途径,包括MAPK和NF-κB途径(这些都是炎症反应激活的关键调节剂)中发挥重要作用[9-10]。丝裂原激活蛋白激酶(MAPKs)是一个丝氨酸/苏氨酸蛋白激酶家族,特别是在介导炎症介质和细胞因子释放发挥重要作用。在哺乳动物中,MAPK家族的主要成员包括细胞外信号调节激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38促分裂原活化蛋白激酶(p38 MAPK),其中JNK和p38 MAPK在应激反应过程中发挥重要作用[11]。BARRENSCHEE等[12]研究表明,TLR4激活p38 MAPK上调了炎症相关基因的表达,并刺激了炎症细胞因子的释放。既往研究[13]表明,p38 MAPK的激活导致血红素加氧酶-1(HO-1)在肠组织中产生,早期抑制p38 MAPK活化可能是预防出血性休克后肠组织损伤和多器官功能衰竭发展的有效手段,因此,TLR4-p38MAPK/JNK信号通路介导的THS肠损伤过程是可行的。
醋酸钠林格液作为临床常用的新一代平衡盐溶液,前期本研究团队发现[7, 14-15],醋酸钠林格液不会引起乳酸蓄积及较少导致高血糖,而且在THS继发重要脏器(心、肝、肺)损伤方面具有保护作用。然而在肠道损伤方面,目前国内外研究较少。本研究发现,应用醋酸钠林格液限制性复苏THS大鼠后,大鼠肠组织病理在光镜下观察其肠道的炎性水肿及炎细胞的浸润较休克不复苏组明显好转,说明醋酸钠林格液对THS大鼠肠道具有保护作用。
肠道作为是THS后启动MODS的“中心器官”,肠道损伤后最主要表现为肠黏膜屏障功能障碍,进而使肠腔内高浓度的细菌、毒素等通过受损肠道进入门静脉汇入体循环导致全身炎症反应的发生[16]。乳酸菌最常用的益生菌菌株与病原体竞争,通过其黏附于肠上皮来增强黏膜屏障完整性,同时通过识别TLR4影响肠道上皮细胞,这些相互作用可刺激保护性细胞因子的产生,例如IL-10,可以抑制上皮细胞凋亡并增强上皮细胞再生[17]。本研究在建立THS模型前期通过给大鼠服用乳酸菌素片来补充乳酸菌,发现在醋酸钠林格液联合乳酸菌组TLR4、P-P38、P-JNK、TNF-α、IL-6表达水平较单纯应用醋酸钠林格液复苏组明显降低,在常规液体复苏基础上应用乳酸菌可以抑制TLR4-p38MAPK/JNK炎性信号通路介导的肠损伤,同时发现抗炎因子IL-4及IL-10表达水平增加,也证实上述观点。肠上皮细胞中ZO-1、Claudin-1蛋白相互作用形成紧密连接,保证其肠黏膜屏障的完整性具有重要作用。本研究通过利用Western blotting检测ZO-1蛋白和Claudin-1蛋白表达水平,发现醋酸钠联合乳酸菌组较单纯应用醋酸钠组蛋白表达水平增加,也进一步证实了乳酸菌在保护肠黏膜屏障上具有重要作用。
综上所述,我们推测在常规液体复苏THS基础上,应用乳酸菌可能进一步抑制TLR4-p38MAPK/JNK炎性信号通路的表达,进而抑制下游促炎因子TNF-α和IL-6的表达,同时增加抗炎因子IL-4和IL-10表达,进而逆转了休克造成的促炎因子和抗炎因子的表达失衡,减轻了THS肠道损伤,为临床控制休克病人肠道损伤提供理论基础,但考虑到Toll样受体家族庞大,信号通路复杂,本研究尚处于初步阶段,还需进一步大样本深入探究。
醋酸钠林格液复苏联合乳酸菌对创伤失血性休克大鼠肠黏膜屏障的保护作用
Protective effect of sodium acetate Ringer's solution resuscitation combined with lactic acid bacteria on the intestinal mucosal barrier of rats with traumatic hemorrhagic shock
-
摘要:
目的探讨醋酸钠林格液复苏基础上应用乳酸菌对创伤失血性休克大鼠肠黏膜屏障的作用。 方法取30只SD大鼠数字法随机分为创伤失血性休克未复苏组(THS组,n=10),醋酸钠林格液复苏组(AR组,n=10),醋酸钠林格液联合乳酸菌复苏组(AL组,n=10),其中AL组大鼠建立休克模型前在正常喂养的基础上加服用乳酸菌素片1周(按照体积面积换算,大鼠每次服用剂量108 mg/kg,每天3次)。THS、AR组及AL组制备成休克模型[平均动脉压维持(35±5)mmHg],AL组及AR组于休克后60 min应用醋酸钠林格液进行30 min液体复苏,复苏后观察4 h取大鼠回肠组织,THS组不予复苏,于休克观察4 h后取回肠组织。利用ELISA检测大鼠外周血肿瘤坏死因子α(TNF-α)、白细胞介素(IL-6)、IL-4、及IL-10含量;应用Western blotting法检测回肠组织ZO-1、Claudin-1、TLR4、p38磷酸化及JNK磷酸化蛋白相对表达水平。 结果与THS组相比,AL组大鼠外周血TNF-α、IL-6含量降低,IL-4、IL-10含量升高,AR组TNF-α含量降低,差异均有统计学意义(P<0.05);与AR组比较,AL组大鼠外周血TNF-α含量降低,差异均有统计学意义(P<0.05),其余各细胞因子水平AR组和AL组比较差异无统计学意义(P>0.05)。回肠组织中,与THS组相比,AR组大鼠外周血TLR4、P-P38、P-JNK含量降低,AL组ZO-1、Claudin-1含量升高,差异均有统计学意义(P<0.05);与AR组相比,AL组ZO-1、Claudin-1含量升高,TLR4、P-JNK含量降低,差异均有统计学意义(P<0.05);回肠组织病理学结果显示AL组回肠组织损伤程度轻于THS组与AR组。 结论在醋酸钠林格液复苏创伤失血性休克基础上,应用乳酸菌可能进一步抑制TLR4-p38MAPK/JNK炎性信号通路的表达,逆转休克造成的促炎因子和抗炎因子的表达失衡,减轻了创伤失血性休克肠道损伤。 Abstract:ObjectiveTo explore the protective effect of sodium acetate Ringer's solution resuscitation combined with lactic acid bacteria on the intestinal mucosal barrier of rats with traumatic hemorrhagic shock. MethodsThirty SD rats were randomly divided into traumatic hemorrhagic shock without resuscitation group (THS group, n=10), sodium acetate Ringer's solution resuscitation group (AR group, n=10) and sodium acetate Ringer's solution combined with lactic acid bacteria resuscitation group (AL group, n=10).The rats in the AL group were given lactic acid bacteria tablets for 1 week on the basis of normal feeding before the shock model was established (calculated according to the volume area, the rats took 108 mg/kg each time, three times a day).The shock models were established in the THS group, AR group and AL group (average arterial pressure maintained 35±5 mmHg).The AL group and AR group were treated with sodium acetate Ringer's solution for 30 minutes of fluid resuscitation after 60 minutes of shock, and the rats' ileum were observed for 4 hours after resuscitation tissue.THS group was not resuscitated, and ileum tissue was taken 4 hours after shock observation.ELISA was used to detect peripheral blood tumor necrosis factor-α(TNF-α), interleukin(IL)-6, IL-4, and IL-10 concentration.Western blotting method was used to detect the expressions of ileum tissue ZO-1, claudin-1, TLR4, p38 phosphorylation and JNK phosphorylation protein. ResultsCompared with the THS group, the levels of TNF-α and IL-6 in the peripheral blood in the AL group were decreased, and the levels of IL-4 and IL-10 were increased, and the TNF-α concentration in the AR group was decreased, and the differences of which were statistically significant (P<0.05).Compared with the AR group, the level of TNF-α in peripheral blood in the AL group was decreased (P<0.05).There was no statistical difference in the levels of other cytokines between AR group and AL group (P>0.05).Compared with the THS group, the levels of TLR4, P-P38, and P-JNK in the peripheral blood of rats in the AR group were decreased, and the levels of ZO-1 and Claudin-1 were increased in the AL group, and the differences of which were statistically significant (P<0.05).Compared with the AR group, the levels of ZO-1 and Claudin-1 in the AL group were increased, and the levels of TLR4 and P-JNK were decreased (P<0.05).The histopathological results of the ileum showed that the damage of the ileum tissue in the AL group was less than that in the THS group and AR group. ConclusionsOn the basis of sodium acetate Ringer's solution to resuscitate traumatic hemorrhagic shock, the application of lactic acid bacteria may further inhibit the expressions of TLR4-p38MAPK/JNK inflammatory signal pathway and reverse the expression imbalance of pro-inflammatory factors and anti-inflammatory factors caused by shock which reduce the trauma intestinal injury in hemorrhagic shock. -
表 1 3组大鼠体质量和基础平均动脉压比较(x±s)
分组 n 体质量/g 平均动脉压/mmHg THS组 10 271.04±10.23 103.12±4.35 AR组 10 273.28±9.71 104.09±6.05 AL组 10 269.25±11.75 102.94±3.20 F — 0.36 0.18 P — >0.05 >0.05 MS组内 — 3 033.431 591.412 表 2 3组大鼠外周血细胞因子含量比较(x±s; pg/mL)
分组 n TNF-α IL-6 IL-4 IL-10 THS组 10 185.98±15.43 80.54±13.77 24.54±7.97 38.64±10.43 AR组 10 143.09±13.08* 70.35±11.54 27.77±6.76 40.03±13.08 AL组 10 122.06±14.66*△ 62.76±7.73* 33.46±8.07* 50.874±9.55* F — 50.99 6.24 3.50 3.63 P — <0.01 <0.01 <0.05 <0.05 MS组内 — 5 617.439 3 442.526 1 572.004 3 339.051 q检验:与THS组比较*P<0.05;与AR组比较△P<0.05 表 3 3组大鼠回肠组织ZO-1、Claudin-1、TLR4、p38磷酸化及JNK磷酸化蛋白相对表达水平比较(x±s)
分组 n ZO-1 Claudin-1 TLR4 P-P38 P-JNK THS组 10 0.32±0.10 0.21±0.08 0.44±0.13 0.72±0.21 0.85±0.10 AR组 10 0.38±0.14 0.28±0.15 0.29±0.09* 0.52±0.18* 0.56±0.14* AL组 10 0.51±0.13*△ 0.41±0.11*△ 0.18±0.13*△ 0.47±0.16* 0.41±0.12*△ F — 5.97 8.06 12.72 5.50 33.97 P — <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 — 0.435 0.346 0.380 0.886 0.399 q检验:与THS组比较*P<0.05;与AR组比较△P<0.05 -
[1] GRAHAM WV, HE W, MARCHIANDO AM, et al. Intracellular MLCK1 diversion reverses barrier loss to restore mucosal homeostasis[J]. Nat Med, 2019, 25(4): 690. doi: 10.1038/s41591-019-0393-7 [2] DUAN C, KUANG L, XIANG X, et al. Activated Drp1-mediated mitochondrial ROS influence the gut microbiome and intestinal barrier after hemorrhagic shock[J]. Aging (Albany NY), 2020, 12(2): 1397. [3] SHEN W, WOLF PG, CARBONERO F, et al. Intestinal and systemic inflammatory responses are positively associated with sulfidogenic bacteria abundance in high-fat-fed male C57BL/6J mice[J]. J Nutr, 2014, 144(8): 1181. doi: 10.3945/jn.114.194332 [4] DEITCH EA, XU D. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review[J]. Front Biosci, 2006, 11(1): 520. doi: 10.2741/1816 [5] DE MORENO DE LEBLANC A, DEL CARMEN S, ZURITA-TURK M, et al. Importance of IL-10 modulation by probiotic microorganisms in gastrointestinal inflammatory diseases[J]. ISRN Gastroenterol, 2011, 2011(1): 892971. [6] ZHOU M, XU W, WANG J, et al. Boosting mTOR-dependent autophagy via upstream TLR4-MyD88-MAPK signalling and downstream NF-κB pathway quenches intestinal inflammation and oxidative stress injury[J]. EBioMedicine, 2018, 35: 345. doi: 10.1016/j.ebiom.2018.08.035 [7] 宋琦, 徐志鹏, 王振杰, 等. 醋酸钠林格液复苏失血性休克大鼠对肺炎性介质及其JNK信号通路的影响[J]. 中华急诊医学杂志, 2018, 27(6): 638. doi: 10.3760/cma.j.issn.1671-0282.2018.06.014 [8] YADAV VR, HUSSAIN A, SAHOO K, et al. Remediation of hemorrhagic shock-induced intestinal barrier dysfunction by treatment with diphenyldihaloketones EF24 and CLEFMA[J]. J Pharmacol Exp Ther, 2014, 351(2): 413. doi: 10.1124/jpet.114.217331 [9] WU XJ, LIU HM, SONG XM, et al. Penehyclidine hydrochloride inhibits TLR4 signaling and inflammation, and attenuates blunt chest trauma and hemorrhagic shock-induced acute lung injury in rats[J]. Mol Med Rep, 2018, 17(5): 6327. [10] YU HP, HWANG TL, HSIEH PW, et al. Role of estrogen receptor-dependent upregulation of P38 MAPK/heme oxygenase 1 in resveratrol-mediated attenuation of intestinal injury after trauma-hemorrhage[J]. Shock, 2011, 35(5): 517. doi: 10.1097/SHK.0b013e318209e931 [11] CHANG SY, SUN RQ, FENG M, et al. BML-111 inhibits the inflammatory response and apoptosis of renal tissue in rats with hemorrhagic shock by inhibiting the MAPK pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(11): 3439. [12] BARRENSCHEE M, LEX D, UHLIG S. Effects of the TLR2 agonists MALP-2 and Pam3Cys in isolated mouse lungs[J]. PLoS One, 2010, 5(11): e13889. doi: 10.1371/journal.pone.0013889 [13] HSU JT, CHEN TH, CHIANG KC, et al. Role of p38 MAPK pathway in 17β-estradiol-mediated attenuation of hemorrhagic shock-induced hepatic injury[J]. J Appl Physiol, 2015, 118(2): 187. doi: 10.1152/japplphysiol.00464.2014 [14] 王振杰, 徐志鹏, 陈硬, 等. 醋酸钠林格液对失血性休克大鼠心肌炎性介质及NF-κB、MAPK信号通路的影响[J]. 蚌埠医学院学报, 2020, 45(3): 281. [15] 徐志鹏, 陈硬, 宋琦, 等. 醋酸钠林格液联合乌司他丁对失血性休克大鼠肝组织NF-κB p65蛋白表达及其细胞因子的影响[J]. 蚌埠医学院学报, 2018, 43(10): 1334. [16] 朱然. 应用微透析检测创伤/失血性休克肠道代谢及其参与肠屏障损伤机制的研究[D]. 沈阳: 中国医科大学, 2018. [17] PATEL R, DUPONT HL. New approaches for bacteriotherapy: prebiotics, new-generation probiotics, and synbiotics[J]. Clin Infect Dis, 2015, 60(Suppl 2): S108. -




 下载:
下载: