-
肿瘤发病率逐年升高[1],化疗作为一种强而有效的治疗手段被广泛应用于肿瘤治疗。阿霉素作为一种高效、广谱的蒽环类抗癌药,可用于治疗成人以及儿童的多种实体肿瘤(如乳腺、卵巢和胃肠道肿瘤)和血液恶性肿瘤(如淋巴瘤和白血病),然而,因阿霉素可引起剂量依赖性的心脏毒性,导致严重心肌病和充血性心力衰竭,严重限制了其在临床上的应用[2],因此老年肿瘤病人及有严重心脏病者属限制性用药,克服阿霉素的心脏毒性将有助于扩宽阿霉素的适用人群。
黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)是中药黄芪主要的有效成分,具有抗癌、抗氧化、抗老化、抗炎等多种效应[3]。AST Ⅳ具有明显的心脏保护作用,主要表现为抑制心脏重构、改善血管内皮细胞功能、保护心肌缺血以及抑制心肌细胞凋亡等[4]。已有研究[5]表明,AST Ⅳ能缓解柯萨奇病毒B3感染引起的以严重的心脏炎症为特征的病毒性心肌炎。AST Ⅳ的心脏保护作用的机制尚不明确。Mer酪氨酸激酶(Mer tyrosine kinase,MerTK)是TAM受体酪氨酸激酶家族成员之一。MerTK缺乏已被证明在动脉粥样硬化模型中是有害的,因为它具有抑制炎症,促进分解和驱动斑块坏死核心中凋亡小体清除的能力[6]。我们的预实验提示AST Ⅳ能够维持MerTK的水平,因此提出假说,AST Ⅳ可能通过抑制MerTK裂解从而缓解阿霉素引起的心肌损伤。本研究旨在探究AST Ⅳ对阿霉素诱导的心肌损伤的保护作用,以及MerTK是否在其中发挥作用。
-
雄性6周龄ICR小鼠(18~22 g),购自上海西普尔-必凯实验动物有限公司。实验过程中对动物处置符合动物伦理学标准。盐酸多柔比星购自深圳万乐药业有限公司,AST Ⅳ购自成都曼斯特有限公司,羧甲基纤维素钠购自上海生物工程有限公司,Masson染色试剂盒购自福建迈新公司,p-MerTK抗体购自Abcam公司,白细胞介素-1β(interleukin 1β,IL-1β)、白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)ELISA试剂盒均购自上海碧云天生物技术有限公司。小动物心电图机(BL-420S生物机能实验系统),AU5800型全自动生化分析仪(美国BeckmanCoulter公司)。
-
50只小鼠随机分成对照组、阿霉素组(DOX组)、DOX+AST Ⅳ20 mg/kg组、DOX+AST Ⅳ40 mg/kg组、DOX+AST Ⅳ 80 mg/kg组,每组10只,观察小鼠精神状态和存活率改善情况以进行AST Ⅳ剂量的筛选。随后,30只小鼠随机分为对照组、DOX组、DOX+AST Ⅳ 80 mg/kg组,每组10只。给予ICR小鼠阿霉素20 mg/kg单次腹腔注射制备阿霉素急性心脏毒性模型,对照组给予0.9%氯化钠溶液。将AST Ⅳ用0.5%羧甲基纤维素钠配置成2 mg/mL混选液,给予小鼠灌胃,对照组与DOX组给予0.5%羧甲基纤维素钠灌胃。于造模前1 d给予AST Ⅳ 80 mg/kg灌胃预处理,造模当天记为第0天,继续给药10 d,每天1次。
-
于造模后第10天,每组各取3只,给小鼠备皮,运用气麻机麻醉小鼠(麻醉药为异氟烷),将小鼠放置于检测台上。四肢涂抹导电凝胶,心电图机监测小鼠 心电图,高分辨率小鼠超声监测心脏射血分数(EF)和缩短分数(FS)。
-
于造模后第10天,每组各取3只,迅速暴露小鼠心脏,用40 g/L多聚甲醛经左心室灌注,心固定24 h后,加入400 g/L蔗糖脱水,冰冻切片,Masson染色(参照试剂盒说明书),显微镜下观察。
-
于造模后第10天,每组各取3只,收集小鼠静脉血,每只500~600 μL,冰上静置后放入4 ℃离心机中,3 000 r/min离心10 min,分离上清。使用全自动血清生化仪检测血清中肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)含量(试剂盒购自浙江伊利康生物技术有限公司);通过酶联免疫吸附法测定IL-1β、IL-6和TNF-α水平(试剂盒购自碧云天生物技术有限公司)。
-
于造模后第10天,每组各取3只,用40 g/L水合氯醛0.4 mL/20 g麻醉并处死小鼠,用眼科剪开胸取心,将其放入预冷PBS中,将心脏中的血液轻轻挤压漂洗干净血液,用滤纸吸干水份。心脏组织置于冻存管后,存放于液氮中速冻。将样本移入专用组织破碎管中,每10 mg样本中加入100 μL含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液,并放入适量磁珠,放入破碎仪中匀浆2~3次,直到组织块消失。冰上静置1 h,待组织样本充分裂解。使用预冷的4 ℃离心机,15 000 r/min离心10 min。取上清液,并且用BCA法测蛋白浓度。放入-80 ℃备用。蛋白样品与5×蛋白上样缓冲液按4∶1比例混合,涡旋混匀,100 ℃水浴中加热5 min。每个泳道加30 μg蛋白样品,通过SDS-PAGE分离蛋白质,并电泳转印至PVDF膜上,室温封闭60 min,加入按1∶1 000稀释的p-MerTK抗体,4 ℃过夜。TBST洗膜后再以辣根过氧化物酶标记的兔源IgG室温孵育2 h。ECL底物发光显色1 min,应用Image J软件对条带进行灰度分析,目的蛋白条带和内参GAPDH条带的比值作为目的蛋白的相对表达量。
-
采用方差分析和q检验。
-
对照组小鼠精神状态良好,进食情况正常;DOX组、DOX+AST Ⅳ 20 mg/kg组、DOX+AST Ⅳ 40 mg/kg组出现精神萎靡不振、中度腹泻等症状;DOX+AST Ⅳ 80 mg/kg组小鼠精神状态尚可,有轻度腹泻的症状。造模第10天,对照组小鼠存活10只,DOX组小鼠存活3只,DOX+AST Ⅳ 20 mg/kg组小鼠存活3只,DOX+AST Ⅳ 40 mg/kg组小鼠存活4只,DOX+AST Ⅳ 80 mg/kg组小鼠存活6只。DOX组小鼠死亡率高;DOX+AST Ⅳ 80 mg/kg组第10天小鼠存活率明显改善;DOX+AST Ⅳ 20 mg/kg组、DOX+AST Ⅳ 40 mg/kg组第10天小鼠存活率低,且精神状态欠佳。因此,其他实验中AST Ⅳ剂量为80 mg/kg。
-
与对照组相比,DOX组小鼠心率明显减慢、QT间期明显延长(P<0.01);与DOX组相比,DOX+AST Ⅳ 80mg/kg组小鼠QT间期明显缩短(P<0.01),心率改善几乎达到正常水平(见表 1)。
分组 心率/(次/分) QT间期/s 对照组 431.00±21.92 0.020±0.001 DOX组 290.70±17.20** 0.035±0.001** DOX+AST Ⅳ 80 mg/kg组 410.30±23.55## 0.026±0.001**## F 38.79 171.00 P <0.01 <0.01 MS组内 443.640 0.000 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 1 AST Ⅳ改善阿霉素引起的小鼠心电异常(ni=3;x±s)
-
与对照组相比,DOX组小鼠EF和FS均明显降低(P<0.01);与DOX组相比,DOX+AST Ⅳ 80 mg/kg组小鼠EF、FS下降程度明显改善(P<0.01)(见表 2)。
分组 EF/% FS/% 对照组 61.37±0.80 31.64±0.86 DOX组 48.56±0.34** 25.38±0.41** DOX+AST Ⅳ组 57.08±0.54**## 29.32±0.58**## F 365.39 72.45 P < 0.01 <0.01 MS组内 0.349 0.415 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 2 3组小鼠心脏超声心动图检查结果(ni=3;x±s)
-
与对照组相比,DOX组CK-MB和LDH含量均明显增加(P<0.01);与DOX组相比,DOX+AST Ⅳ 80 mg/kg组CK-MB和LDH含量均明显降低(P<0.01)(见表 3)。
分组 LDH/(U/L) CK-MB/(U/L) 对照组 546.20±15.61 168.10±6.81 DOX组 3 368.00±55.46** 289.30±5.80** DOX+AST Ⅳ 80mg/kg组 1 406.00±71.98**## 201.10±6.39**## F 2 214.77 292.40 P <0.01 <0.01 MS组内 2 833.535 40.283 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 3 AST Ⅳ改善阿霉素引起的心肌酶改变(ni=3;x±s)
-
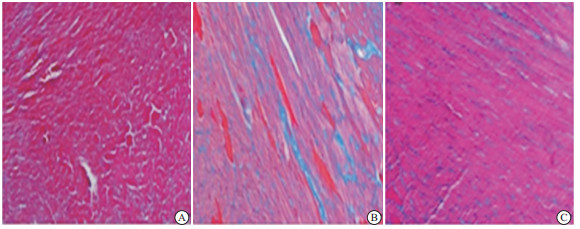
Massson染色结果显示,与对照组相比,DOX组小鼠心肌细胞间质出现严重纤维化(蓝色部分);与DOX组相比,DOX+AST Ⅳ 80 mg/kg组小鼠心肌纤维化面积明显减少(蓝色部分)(见图 1)。
-
与对照组相比,DOX组p-MerTK的蛋白表达明显增加(P<0.01);与DOX组相比,DOX+AST Ⅳ 80 mg/kg组p-MerTK的表达水平明显下降(P<0.01)(见图 2、表 4)。
分组 p-MerTK F P MS组内 对照组 1.00±0.00 6 337.57 <0.01 0.001 DOX组 3.47±0.04** DOX+AST Ⅳ 80 mg/kg组 1.93±0.02## q检验:与对照组比较**P<0.01;与DOX组比较##<0.01 表 4 各组p-MerTK蛋白表达比较(ni=3;x±s)
-
与对照组相比,DOX组小鼠IL-1β、IL-6、TNF-α水平均明显升高(P<0.01);与DOX组相比,DOX+AST Ⅳ 80 mg/kg组IL-1β、IL-6、TNF-α水平均明显下降(P<0.01)(见表 5)。
分组 IL-1β/(ng/L) IL-6/(ng/L) TNF-α/(ng/L) 对照组 908.70±23.90 178.30±3.34 41.03±0.91 DOX组 1 949.00±52.34** 284.20±7.58** 145.80±3.33** DOX+AST Ⅳ 80 mg/kg组 1 650.00±35.71**## 243.00±4.76**## 123.00±4.83**## F 562.97 281.01 775.23 P < 0.01 < 0.01 <0.01 MS组内 1 528.630 30.423 11.749 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 5 各组炎症指标水平比较(ni=3;x±s)
-
蒽环类化疗药物阿霉素显著提高了癌症病人的生存率;但是,许多病人遭受阿霉素引起的心脏毒性,以剂量依赖性方式引起不可逆性心肌病,如左心功能不全和心力衰竭,降低了病人的生存质量[7]。右丙亚胺是FDA批准用于治疗阿霉素诱导的心脏毒性的唯一药物,然而其也具有很大的不良反应,如骨髓抑制和干扰阿霉素活性[8]。因此,寻找缓解化疗性心脏病新的治疗方案极其迫切。本研究显示在给予化疗药物后,给予AST Ⅳ可以减轻化疗药物导致的心脏毒性,且与MerTK的作用相关,为临床缓解化疗药物毒性提供了新的选择。
AST Ⅳ可以减轻阿霉素引起的心脏损伤,减轻心脏炎症并改善心功能。通过查阅文献,本研究选择20、40、80 mg/kg 3个AST Ⅳ剂量[9-10],然而在小鼠生存率实验中,20、40 mg/kg AST Ⅳ组小鼠死亡率未明显改善,因此选择80 mg/kg AST Ⅳ进行其他实验。相关文献[9-10]也显示,大剂量的AST Ⅳ才是有效的,大剂量的AST Ⅳ能够减轻心肌损伤、心肌炎症、心肌细胞凋亡、心脏纤维化等。研究[9]表明,AST Ⅳ能够通过抑制NADPH氧化酶2和NADPH氧化酶4减轻阿霉素诱发的心肌细胞凋亡、心肌炎症等;AST Ⅳ显著减弱了阿霉素诱导的心肌细胞线粒体损伤和功能障碍[11];AST Ⅳ通过抑制NF-κB信号转导可减轻柯萨奇病毒B3感染引起的心肌炎的严重程度,并减轻心脏炎症[5]。本研究也显示AST Ⅳ减轻了阿霉素引起的IL-1β等炎症指标的升高,明确了AST Ⅳ对抗心脏炎症的作用。研究[4, 9, 12]表明,AST Ⅳ通过多种信号通路改善心脏的收缩功能,并发挥心肌保护作用,如抑制NADPH氧化酶衍生的氧化应激、抑制NF-κB信号转导、激活PPARα,本研究显示AST Ⅳ改善阿霉素引起的心脏收缩功能指标EF、FS的降低、心肌酶LDH、CK-MB的升高以及心肌纤维化。
AST Ⅳ减轻心脏损伤的机制可能是抑制了MerTK裂解。有研究[10]表明MerTK的裂解由TNF-α转化酶通过涉及活性氧(ROS)、蛋白激酶Cδ和p38丝裂原活化蛋白激酶的途径介导。另有研究[12]表明生长停滞特异性蛋白6(Gas6)和蛋白S是MerTK的配体,GAS6和蛋白S都是桥接分子,将MerTK与垂死细胞上的磷脂酰丝氨酸连接起来ADAM17裂解MerTK形成可溶性Mer。ROS是阿霉素引起的常见成分,它们诱导MerTK的蛋白裂解,导致MerTK功能障碍和稳定裂解产物可溶性Mer的出现[13];MerTK裂解会损害炎症消退并限制心脏修复[6]。抑制MerTK裂解可在缺血再灌注损伤后促进炎症消退,促炎性介质IL-1β和TNF-α降低[6]。在心肌缺血再灌注小鼠模型中,巨噬细胞MerTk缺失导致心脏创伤清创减少,梗死面积增大,心功能下降,提示MerTK可能参与心肌修复[14]。本研究结果显示,AST Ⅳ维持了MerTK表达水平的同时降低了阿霉素引起的炎症介质IL-1β、IL-6和TNF-α升高,提示AST Ⅳ可能通过维持心肌组织内巨噬细胞的MerTK水平维持巨噬细胞清除炎症的功能而实现其改善心功能和心肌纤维化的作用。
黄芪甲苷通过抑制MerTK缓解阿霉素引起的心脏毒性
Study on astragaloside Ⅳ alleviating the cardiotoxicity caused by doxorubicin by inhibiting MerTK
-
摘要:
目的探讨黄芪甲苷对阿霉素诱导的心肌损伤的作用及机制。 方法6周龄ICR雄性小鼠随机分为对照组、阿霉素组、阿霉素+黄芪甲苷组。对照组给予单次腹腔注射0.9%氯化钠溶液,其余组均给予单次腹腔注射20 mg/kg阿霉素造模。阿霉素+黄芪甲苷80 mg/kg组行每天1次黄芪甲苷80 mg/kg灌胃,其余组给予0.5%羧甲基纤维素钠灌胃,持续至造模第10天。于第10天进行心脏超声检测小鼠心肌功能指标射血分数和缩短分数,进行心电图测试监测小鼠心率;于第10天取小鼠血清和心脏组织采用Masson染色法检测心肌组织结构的变化,使用全自动血清生化仪检测血清中乳酸脱氢酶(LDH)、肌酸激酶(CK-MB)水平,采用ELISA法检测血清中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平,以Western blotting检测心肌中Mer酪氨酸激酶(MerTK)蛋白表达。 结果与对照组相比,阿霉素组小鼠心率明显减慢、QT间期明显延长(P < 0.01);心脏射血分数和缩短分数均明显降低(P < 0.01);心肌酶CK-MB和LDH含量均明显增加(P < 0.01);p-MerTK的蛋白表达明显增加(P < 0.01);IL-1β、IL-6、TNF-α水平均明显升高(P < 0.01);小鼠心肌细胞间质出现严重纤维化。与阿霉素组相比,阿霉素+黄芪甲苷80 mg/kg组小鼠QT间期明显缩短(P < 0.01),心率改善几乎达到正常水平;心脏射血分数和缩短分数下降程度明显改善(P < 0.01);CK-MB和LDH含量均明显降低(P < 0.01);p-MerTK的表达水平明显下降(P < 0.01);IL-1β、IL-6、TNF-α水平均明显下降(P < 0.01);小鼠心肌纤维化面积明显减少。 结论黄芪甲苷可能通过抑制MerTK裂解减轻心肌损伤,减轻阿霉素诱导的心脏毒性。 Abstract:ObjectiveTo investigate the effects and mechanism of astragaloside Ⅳ on the doxorubicin-induced myocardial injury. MethodsThe 6-week-old ICR male mice were randomly divided into the control group, doxorubicin group, doxorubicin+Astragaloside Ⅳ group.The control group was given a single intraperitoneal injection of 0.9% sodium chloride solution, and the other groups were given a single intraperitoneal injection of 20 mg/kg doxorubicin for modeling.The doxorubicin+astragaloside Ⅳ 80 mg/kg group were given astragaloside Ⅳ once a day by gavage, and the other groups were given a solvent(0.5% sodium carboxymethyl cellulose) by gavage for 10 days.On the 10th day, the mice's myocardial function(ejection fraction and fractional shortening) were detected using the echocardiography, and the heart rate of mice were monitored by the electrocardiogram test.On the 10th day, the serum and heart tissue of mice were collected, and the changes in the myocardial tissue structure were detected using Masson staining, and the levels of lactate dehydrogenase(LDH) and creatine kinase(CK-MB) were detected using biochemistry.The serum levels of interleukin-1β(IL-1β), interleukin-6(IL-6) and tumor necrosis factor-α(TNF-α) in mice were examined using ELISA, and the protein levels of Mer tyrosine kinase(MerTK) in the myocardium were detected using Western blotting. ResultsCompared with the control group, the heart rate and QT interval were significantly slower(P < 0.01), the cardiac ejection fraction and fractional shortening significantly decreased(P < 0.01), the contents of myocardial enzyme CK-MB and LDH significantly increased(P < 0.01), the protein expression lev el of p-MerTK significantly increased(P < 0.01), the levels of IL-1β, IL-6 and TNF-α significantly increased(P < 0.01), and there was severe fibrosis in the interstitium of mouse myocardial cells in adriamycin group.Compared with the doxorubicin group, the QT interval was significantly shortened(P < 0.01), the heart rate was improved almost to the normal level, the decreasing of cardiac ejection fraction and fractional shortening was significantly improved(P < 0.01), the contents of myocardial enzyme CK-MB and LDH significantly decreased(P < 0.01), the expression level of p-MerTK significantly decreased(P < 0.01), the levels of IL-1β, IL-6 and TNF-α significantly decreased(P < 0.01), and the area of myocardial fibrosis was significantly reduced in doxorubicin+astragaloside Ⅳ 80 mg/kg group. ConclusionsAstragaloside Ⅳ may reduce the myocardial injury and cardiotoxicity induced by doxorubicin through inhibiting MerTK cleavage. -
Key words:
- doxorubicin /
- cardiotoxicity /
- astragaloside Ⅳ
-
表 1 AST Ⅳ改善阿霉素引起的小鼠心电异常(ni=3;x±s)
分组 心率/(次/分) QT间期/s 对照组 431.00±21.92 0.020±0.001 DOX组 290.70±17.20** 0.035±0.001** DOX+AST Ⅳ 80 mg/kg组 410.30±23.55## 0.026±0.001**## F 38.79 171.00 P <0.01 <0.01 MS组内 443.640 0.000 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 2 3组小鼠心脏超声心动图检查结果(ni=3;x±s)
分组 EF/% FS/% 对照组 61.37±0.80 31.64±0.86 DOX组 48.56±0.34** 25.38±0.41** DOX+AST Ⅳ组 57.08±0.54**## 29.32±0.58**## F 365.39 72.45 P < 0.01 <0.01 MS组内 0.349 0.415 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 3 AST Ⅳ改善阿霉素引起的心肌酶改变(ni=3;x±s)
分组 LDH/(U/L) CK-MB/(U/L) 对照组 546.20±15.61 168.10±6.81 DOX组 3 368.00±55.46** 289.30±5.80** DOX+AST Ⅳ 80mg/kg组 1 406.00±71.98**## 201.10±6.39**## F 2 214.77 292.40 P <0.01 <0.01 MS组内 2 833.535 40.283 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 表 4 各组p-MerTK蛋白表达比较(ni=3;x±s)
分组 p-MerTK F P MS组内 对照组 1.00±0.00 6 337.57 <0.01 0.001 DOX组 3.47±0.04** DOX+AST Ⅳ 80 mg/kg组 1.93±0.02## q检验:与对照组比较**P<0.01;与DOX组比较##<0.01 表 5 各组炎症指标水平比较(ni=3;x±s)
分组 IL-1β/(ng/L) IL-6/(ng/L) TNF-α/(ng/L) 对照组 908.70±23.90 178.30±3.34 41.03±0.91 DOX组 1 949.00±52.34** 284.20±7.58** 145.80±3.33** DOX+AST Ⅳ 80 mg/kg组 1 650.00±35.71**## 243.00±4.76**## 123.00±4.83**## F 562.97 281.01 775.23 P < 0.01 < 0.01 <0.01 MS组内 1 528.630 30.423 11.749 q检验:与对照组比较**P<0.01;与DOX组比较##P<0.01 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394. doi: 10.3322/caac.21492 [2] BHAGAT A, KLEINERMAN ES. Anthracycline-induced cardiotoxicity: causes, mechanisms, and prevention[J]. Adv Exp Med Biol, 2020, 1257: 181. [3] LI Y, YE Y, CHEN H. Astragaloside Ⅳ inhibits cell migration and viability of hepatocellular carcinoma cells via suppressing long noncoding RNA ATB[J]. Biomed Pharmacother, 2018, 99: 134. doi: 10.1016/j.biopha.2017.12.108 [4] DONG Z, ZHAO P, XU M, et al. Astragaloside Ⅳ alleviates heart failure via activating PPARα to switch glycolysis to fatty acid β-oxidation[J]. Sci Rep, 2017, 7(1): 2691. doi: 10.1038/s41598-017-02360-5 [5] GUI J, CHEN R, XU W, et al. Remission of CVB3-induced myocarditis with Astragaloside Ⅳ treatment requires A20(TNFAIP3) up-regulation[J]. J Cell Mol Med, 2015, 19(4): 850. doi: 10.1111/jcmm.12459 [6] DEBERGE M, YEAP XY, DEHN S, et al. MerTK cleavage on resident cardiac macrophages compromises repair after myocardial ischemia reperfusion injury[J]. Circ Res, 2017, 121(8): 930. doi: 10.1161/CIRCRESAHA.117.311327 [7] HU C, ZHANG X, WEI W, et al. Matrine attenuates oxidative stress and cardiomyocyte apoptosis in doxorubicin-induced cardiotoxicity via maintaining AMPKα/UCP2 pathway[J]. Acta Pharm Sin B, 2019, 9(4): 690. doi: 10.1016/j.apsb.2019.03.003 [8] TOMLINSON L, LU ZQ, BENTLEY RA, et al. Attenuation of doxorubicin-induced cardiotoxicity in a human in vitro cardiac model by the induction of the NRF-2 pathway[J]. Biomed Pharmacother, 2019, 112: 108637. doi: 10.1016/j.biopha.2019.108637 [9] LIN J, FANG L, LI H, et al. Astragaloside Ⅳ alleviates doxorubicin induced cardiomyopathy by inhibiting NADPH oxidase derived oxidative stress[J]. Eur J Pharmacol, 2019, 859: 172490. doi: 10.1016/j.ejphar.2019.172490 [10] THORP E, VAISAR T, SUBRAMANIAN M, et al. Shedding of the Mer tyrosine kinase receptor is mediated by ADAM17 protein through a pathway involving reactive oxygen species, protein kinase Cδ, and p38 mitogen-activated protein kinase (MAPK)[J]. J Biol Chem, 2011, 286(38): 33335. doi: 10.1074/jbc.M111.263020 [11] JIA Y, ZUO D, LI Z, et al. Astragaloside Ⅳ inhibits doxorubicin-induced cardiomyocyte apoptosis mediated by mitochondrial apoptotic pathway via activating the PI3K/Akt pathway[J]. Chem Pharm Bull (Tokyo), 2014, 62(1): 45. doi: 10.1248/cpb.c13-00556 [12] UEHARA H, SHACTER E. Auto-oxidation and oligomerization of protein S on the apoptotic cell surface is required for Mer tyrosine kinase-mediated phagocytosis of apoptotic cells[J]. J Immunol, 2008, 180(4): 2522. doi: 10.4049/jimmunol.180.4.2522 [13] ANWAR A, KEATING AK, JOUNG D, et al. Mer tyrosine kinase (MerTK) promotes macrophage survival following exposure to oxidative stress[J]. J Leukoc Biol, 2009, 86(1): 73. doi: 10.1189/jlb.0608334 [14] CAI B, THORP EB, DORAN AC, et al. MerTK cleavage limits proresolving mediator biosynthesis and exacerbates tissue inflammation[J]. Proc Natl Acad Sci USA, 2016, 113(23): 6526. doi: 10.1073/pnas.1524292113 -




 下载:
下载: