-
乳腺癌是全球范围内与女性癌症相关死亡的最常见疾病之一,其发病率与死亡率也逐年增加[1-2]。乳腺癌是一种具有复杂的生物学特征性高度异质性的恶性乳腺肿瘤,不同分子亚型,其治疗方案及预后差异较大。根据其免疫组织化学(免疫组化)雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER-2)及肿瘤增殖抗原指数(Ki-67)表达情况,将乳腺癌分为4种分子亚型,随着驱动基因重要性的不断增强,首先明确判断HER-2状态成为分子分型的重要原则[3]。HER-2阳性病人预示着肿瘤分化较差、病程进展速度更快、转移和复发概率更高以及预后较差[4]。同时,随着曲妥珠单抗等抗HER-2靶向药物不断问世,改变了HER-2阳性乳腺癌病人的治疗策略,改善了病人的预后[5]。既往对HER-2阳性乳腺癌的诊断需要通过手术或穿刺活检等有创检查的方式。MRI检查作为一种重要无创检查方式,已成为癌症早期诊断的一种很有前途的工具[6]。因此,本次研究希望通过无创性多参数乳腺MRI检查,对HER-2阳性乳腺癌作出初步的诊断,以助于乳腺癌病人治疗方案的初步制定与预后评估。
-
收集蚌埠医学院第一附属医院2018年8月至2020年9月经病理证实为乳腺癌的女性病人的临床及影像资料98例,纳入标准:(1)所有病人均行乳腺MRI平扫+动态增强+弥散加权成像;(2)单侧乳腺单发病灶。排除标准:(1)MRI检查前病人已穿刺或化疗(n=7);(2)MRI检查后>2周后手术或穿刺(n=3);(3)MRI图像质量不良(n=2);(4)非肿块样或点样强化病变(n=8);(5)免疫组织化学(免疫组化)资料不全(n=4)。最终入组74例(HER-2阳性组34例,HER-2阴性组40例)。
-
采用荷兰Philips Achieva 3.0T双梯度超导磁共振仪,病人以俯卧位头先进方式,双乳置于SENSE7通道矩阵线圈中。常规行横断位T1WI(TR: 400 ms、TE: 10 ms,层厚5.5 mm)和抑脂T2WI(TR: 5 000 ms、TE: 60 ms,层厚5.5 mm),扩散加权成像(b=0、800 s/mm2),动态增强扫描(连续扫描6期,造影剂为钆喷酸葡胺,剂量0.2 mmol/kg,速率2.0 mL/s,层厚2 mm),最大密度投影成像以及多平面重建的增强扫描。
-
将扫描数据传至Extended MR Workspace EWS(荷兰Philips公司)工作站进行后处理。由2位有丰富乳腺疾病MRI诊断经验的高年资主治医师按照2013年第5版MRI-BI-RADS进行诊断及评估,当诊断意见不一致时,共同商量后得到最后的诊断,分析内容包括:病灶长径、病灶形态(圆形、椭圆形、不规则形、分叶形)、病灶边缘(光滑、不规则、毛刺)、病灶强化方式(均匀、不均匀、环形)、病灶时间-信号强度曲线(time-signal intensity curve,TIC)及病灶表观弥散系数(ADC)值。分叶形指病灶呈波浪状改变的病灶,不规则形指具有2个或3个尖角状凸起的病灶,边缘毛刺指病灶边缘呈放射状改变,边缘不规则指病灶边界不清晰,又无毛刺。长径测量,选取病灶最大层面对病灶进行3次测量,取平均值。绘制TIC及测量ADC值时,同时参考DCE-MRI图和弥散加权成像(DWI)原始图,在DCE-MRI图及ADC图上画感兴趣区(region of interest,ROI),得出TIC曲线、ADC值,为避免部分容积效应,选取病变中心层面,同时避开坏死区域,根据病变大小和形态调整绘制ROI。测量3次ADC值取平均值,绘制病灶TIC曲线时,同时绘制对侧乳腺相同部位TIC曲线作为参考。TIC曲线按照BI-RADS指南分3型:Ⅰ型(持续上升型);Ⅱ型(平台型);Ⅲ型(流出型)。
-
根据2020CSCO乳腺癌诊疗指南,将乳腺癌分为HER-2阳性、三阴型、Luminal A型和Luminal B型四型,本次研究将其他三型均归为HER-2阴性组。采用免疫组化方法对肿瘤标本中HER-2的表达进行检测。HER-2阳性产物为位于细胞膜的棕黄色颗粒,≤30%肿瘤细胞染色为阴性(-),>30%的肿瘤细胞有不完整细胞膜染色为弱阳性(+),>30%的肿瘤细胞有较弱但完整的细胞膜染色为中度阳性(2+),>30%的肿瘤细胞较强的完整细胞膜染色为强阳性(3+)。将免疫组化染色(-)、(+)记为HER-2阴性,免疫组化染色(3+)记为HER-2阳性,免疫组化染色(2+)时,进一步行FISH检测,如扩增记为HER-2阳性。
-
采用χ2检验和t检验。
-
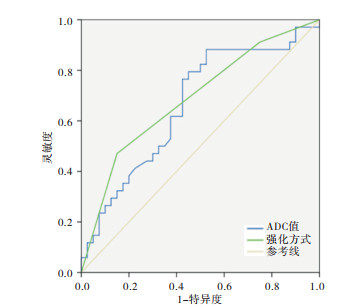
2组平均年龄差异无统计学意义(P>0.05);2组MRI定量特征比较:HER-2阳性组长径与阴性组差异无统计学意义(P>0.05),但ADC值高于阴性组(P < 0.05)(见表 1)。ROC曲线下面积(AUC)为0.663(95%CI:0.538~0.789),利用ROC曲线取阈值0.844×10-3mm2/s,其敏感性88.2%、特异性47.5%(见图 1)。
分组 n 年龄/岁 长径/mm ADC值/(×10-3mm2/s) HER-2阳性组 34 49.59±9.30 26.41±10.66 1.01±0.23 HER-2阴性组 40 45.68±9.01 24.10±12.57 0.90±0.16 t — 1.83 0.84 2.48 P — >0.05 >0.05 < 0.05 表 1 HER-2阳性组与阴性组各定量参数比较
-
MRI定性特征方面,HER-2阳性组与阴性组在病灶形态、边缘及TIC曲线类型分布方面差异均无统计学意义(P>0.05);HER-2阳性组病灶呈不规则或分叶形占比85.29%(29/34)、边缘呈不规则或毛刺占比82.35%(28/34)、TIC曲线Ⅲ型占比64.70%(22/34),阴性组病灶呈不规则或分叶形占比67.50%(27/40)、边缘呈不规则或毛刺占比65.00%(26/40)、TIC曲线Ⅲ型占比50%(20/40)。HER-2阳性组在强化方式上与阴性组差异有统计学意义(P < 0.01)。HER-2阳性组环形强化方式占比47.06%(16/34);阴性组占比15.00%(6/40)(见表 2),ROC AUC为0.689(95%CI:0.567~0.811)(见图 1)。
分组 n 形态 边缘 强化方式 TIC曲线 圆形/类圆形 不规则形 分叶形 光滑 不规则 毛刺 均匀 不均匀 环形 Ⅰ型 Ⅱ型 Ⅲ型 HER-2阳性组 34 5 23 6 6 10 18 3 15 16 5 7 22 HER-2阴性组 40 13 20 7 14 10 16 10 24 6 7 13 20 χ2 — 3.38 2.85 9.97 1.75 P — >0.05 >0.05 < 0.01 >0.05 表 2 HER-2阳性组与阴性组各定性参数比较
-
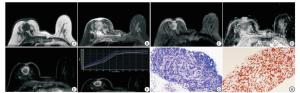
HER-2阳性乳腺癌典型病例:病人女,56岁,病灶呈圆形,边缘光滑,T1WI呈等信号,抑脂T2WI周围呈稍高信号,中央呈等信号,DWI病灶周围弥散受限呈高信号,ADC病灶周围呈低信号,测ADC值1.036×10-3mm2/s,增强扫描病灶呈环形强化,TIC曲线呈Ⅱ型(平台型)(见图 2A~2F)。HER-2阴性乳腺癌典型病例:病人女,48岁,病灶呈椭圆形,边缘光滑,T1WI呈等信号,抑脂T2WI呈不均匀稍高信号,DWI病灶弥散受限呈高信号,ADC病灶呈低信号,测ADC值0.848×10-3mm2/s,增强扫描病灶呈均匀强化,TIC曲线呈Ⅲ型(流出型)(见图 3)。
-
HER-2阳性乳腺癌病人占乳腺癌中15%~20%[7]。HER-2基因(ErbB2)位于染色体17q12-21.32上,编码蛋白的相对分子质量为185 000,是乳腺癌发生、发展的重要原癌基因之一,以及乳腺癌不良预后的独立因素[8-9],也是靶向治疗药物的靶点及主要预测指标[10]。随着MR设备的普及和相关成像技术的成熟,MRI检查除具有高软组织分辨率、无辐射、无创外,同时可对病变进行多参数、多方位、多角度扫描,且对乳腺癌的诊断敏感性也很高[11],因此乳腺MRI检查已成为乳腺疾病诊断的重要检查方式。已有研究[12]表明不同病理组织类型的乳腺病变具有不同的影像学特征。
本次研究结果显示病人年龄及病灶形态学(包括病灶长径、形态、边缘)水平在HER-2阳性组与HER-2阴性组之间差异无统计学意义。本研究2组病例主要表现出乳腺癌MRI影像的共性特征,如形态多为不规则形、病灶边缘多为毛刺状及不规则等恶性影像学征象。这与CHENG等[13]的研究结果不一致,分析其原因可能与样本量不足有关。
DWI通过检查组织内的水分子扩散受限程度与方向等信息,来间接反映组织微观结构的变化,病灶内水分子受限程度越大,ADC值越低,DWI序列现已常规用于乳腺癌的MRI检查[14]。本组研究,HER-2阳性组ADC值高于HER-2阴性组,差异有统计学意义(P < 0.05)。与CHENG等[13, 15-16]研究结果一致。这与传统认为肿瘤恶性程度越高,ADC值越低不一致。分析其原因可能与ADC值受多种因素影响有关,ADC值除由肿瘤细胞的大小、密度、细胞外间隙容积等因素有关外,同时还受肿瘤内血流灌注情况影响。HER-2阳性乳腺癌可诱导肿瘤细胞生成血管内皮生长因子(vascular endothelial growth factor,VEGF),VEGF促进肿瘤内大量血管的生成,新生血管不成熟通透性高,肿瘤内血流灌注增高及细胞外间隙液体增多,因此HER-2阳性乳腺癌ADC值相应增高。本研究ADC值AUC为0.663(95%CI: 0.538~0.789),利用ROC曲线取阈值0.844×10-3mm2/s,以此值作为鉴别HER-2阳性与阴性乳腺癌,其敏感性为88.2%、特异性为47.5%。
动态对比增强MRI(DCE-MRI)不仅有助于显示乳腺癌的形态学信息,同时还可以观测到病灶的强化方式与血流动力学特征。本研究发现2组病例在病灶的强化方式上,HER-2阳性组中病灶呈环形强化特征(47.06%)占比高于HER-2阴性组(15.00%),差异有统计学意义(P < 0.05),这与陈倩等[15, 17]的研究结果一致。分析环形强化特征的形成,可能与HER-2阳性乳腺癌肿瘤细胞生长较快,病灶中央部分血供不足发生坏死及纤维化相关,虽然HER-2高表达阳性乳腺癌可促进VEGF的生成,使得肿瘤血管大量生成,但多集中与病灶周围[17-18]。本组研究TIC曲线类型在2组间无统计学差异,这与孙双燕等[19]的研究结果相一致, 2组均以Ⅲ型TIC曲线为主。
因此,通过本次研究发现HER-2阳性乳腺癌与肿瘤ADC值及环形强化方式有一定的相关性,这对于有手术或穿刺禁忌证、高龄以及希望进行姑息治疗的病人,无创性的MRI检查可提供靶向治疗的影像学依据;同样对于病理实验室条件较差,无法进行免疫组化检测以及无基因检测实验室的医院,可利用多参数MRI检查,对HER-2阳性乳腺癌进行初步诊断。虽然本组研究结果显示HER-2阳性乳腺癌与肿瘤大小、形态、边缘及TIC曲线类型无明显相关性,但术前乳腺MRI检查同样可以帮助了解肿瘤浸润的范围和程度以及有助于识别和预测临床上隐匿的肿瘤侵犯乳头乳晕复合体[20],同时对乳腺癌病人的腋窝淋巴结转移风险有一定的预测作用[21]。这对临床治疗方式的选择、手术计划的制定以及预防的评估有重要参考价值。
本研究存在一定的局限性:(1)研究样本量较少;(2)部分病灶免疫组化结果为穿刺所得,受穿刺部位、取样大小及肿瘤异质性等的影响,病理结果可能存在一定的误差;(3)定量数据较少,定性数据较多。在今后的研究工作中,我们将提高样本量、利用新的MRI扫描技术,如体素内不相干运动、扩散张量成像等,以及影像组学来提高对HER-2阳性乳腺癌诊断的准确性。
综上所述,多参数乳腺MRI作为一种非侵入式的检查方法,根据其多参数影像特征可对HER-2阳性乳腺癌作出初步的诊断,为临床对病情的评估及治疗策略的制定,提供较好的参考价值。
多参数3.0T MRI在HER-2阳性乳腺癌中的应用
Application value of multi-parameter 3.0T-MRI in HER-2 positive breast cancer
-
摘要:
目的探讨多参数3.0T-MRI对人表皮生长因子受体2(HER-2)阳性乳腺癌诊断的临床应用价值。 方法回顾性分析74例经病理证实的乳腺癌病人影像学特征及临床资料,所有病人术前均行乳腺MRI检查。根据术后病理免疫组织化学HER-2表达情况分为2组,其中HER-2阳性组34例,HER-2阴性组40例。比较2组在病人年龄、病灶长径、形态、边缘、强化方式、ADC值及病灶时间-信号强度曲线(TIC)之间的差异性,并分析HER-2阳性乳腺癌MRI影像特征。 结果HER-2阳性组年龄(49.59±9.30)岁与阴性组年龄(45.68±9.01)岁差异无统计学意义(P>0.05)。HER-2阳性组病灶表观弥散系数值(1.01±0.23)×10-3 mm2/s高于阴性组的(0.90±0.16)×10-3 mm2/s(P < 0.05),ROC曲线下面积(AUC)为0.663(95%CI:0.538~0.789)。HER-2阳性组病灶呈环形强化方式较阴性组多(P < 0.01),AUC为0.689(95%CI:0.567~0.811)。2组病例在病灶长径、形态、边缘、TIC曲线的MRI特征参数方面差异均无统计学意义(P>0.05)。 结论HER-2阳性乳腺癌MRI影像表现具有一定的特征性,为病人术前评估、临床治疗方案制定、预后判断提供重要参考。 -
关键词:
- 乳腺肿瘤 /
- 人表皮生长因子受体2 /
- 磁共振成像
Abstract:ObjectiveTo explore the clinical value of multi-parameter 3.0T-MRI in the diagnosis of human epidermal growth factor receptor 2(HER-2)positive breast cancer. MethodsThe imaging features and clinical data of 74 patients with breast cancer confirmed by pathology were retrospectively analyzed.The breast MRI in all patients were detected before operation.According to the expression of HER-2 detected by postoperative pathological immunohistochemistry, the patients were divided into the HER-2 positive group(34 cases) and HER-2 negative group(40 cases).The differences of the age, length, diameter, shape and edge of lesions, enhancement mode, apparent diffusion coefficient(ADC) value and time-intensity curve(TIC) curve were compared between two groups, and the MRI features of the HER-2 positive breast cancer were analyzed. ResultsThe difference of the age between the HER-2 positive group[(49.59±9.30) years old] and HER-2 negative group[(45.68±9.01) years old] was not statistically significant(P>0.05).The ADC value of lesions in HER-2 positive group[(1.01±0.23)×10-3mm2/s] was higher than that in HER-2 negative group[(0.90±0.16)×10-3mm2/s](P < 0.05), and the area under ROC curve(AUC) was 0.663(95%CI: 0.538-0.789).The ring enhancement patterns of lesions in HER-2 positive group was more than that in HER-2 negative group(P < 0.01), and AUC was 0.689(95%CI: 0.567-0.811).The differences of the length, diameter, shape and edge of lesions, and MRI characteristic parameters of TIC curve were not statistically significant between two groups(P>0.05). ConclusionsThe MRI findings of the HER-2 positive breast cancer have certain characteristics, which can provide an important reference for the preoperative evaluation, clinical treatment and prognosis of patients. -
表 1 HER-2阳性组与阴性组各定量参数比较
分组 n 年龄/岁 长径/mm ADC值/(×10-3mm2/s) HER-2阳性组 34 49.59±9.30 26.41±10.66 1.01±0.23 HER-2阴性组 40 45.68±9.01 24.10±12.57 0.90±0.16 t — 1.83 0.84 2.48 P — >0.05 >0.05 < 0.05 表 2 HER-2阳性组与阴性组各定性参数比较
分组 n 形态 边缘 强化方式 TIC曲线 圆形/类圆形 不规则形 分叶形 光滑 不规则 毛刺 均匀 不均匀 环形 Ⅰ型 Ⅱ型 Ⅲ型 HER-2阳性组 34 5 23 6 6 10 18 3 15 16 5 7 22 HER-2阴性组 40 13 20 7 14 10 16 10 24 6 7 13 20 χ2 — 3.38 2.85 9.97 1.75 P — >0.05 >0.05 < 0.01 >0.05 -
[1] TORRE LA, ISLAMI F, SIEGEL RL, et al. Global cancer in women: burden and trends[J]. Cancer Epidemiol Biomarkers Prev, 2017, 26(4): 444. doi: 10.1158/1055-9965.EPI-16-0858 [2] ANASTASIADI Z, LIANOS GD, IGNATIADOU E, et al. Breast cancer in young women: an overview[J]. Updates Surg, 2017, 69(3): 313. doi: 10.1007/s13304-017-0424-1 [3] SHI P, CHEN C, YAO Y. Correlation between HER-2 gene amplification or protein expression and clinical pathological features of breast cancer[J]. Cancer Biother Radiopharm, 2019, 34(1): 42. doi: 10.1089/cbr.2018.2576 [4] 郭晨明, 吴楠, 郭丽英. 我国HER-2阳性乳腺癌预后影响因素的Meta分析[J]. 中国普通外科杂志, 2016, 25(2): 264. [5] DI OTO E, BRANDES AA, CUCCHI MC, et al. Prognostic impact of HER-2 Subclonal Amplification in breast cancer[J]. Virchows Arch, 2017;471(3): 313. doi: 10.1007/s00428-017-2151-x [6] 张俊杰, 杨晓棠, 杜笑松, 等. 隐匿性乳腺癌的MRI表现及临床病理特征[J]. 中华肿瘤杂志, 2018, 40(1): 40. [7] WAKS AG, WINER EP. Breast cancer treatment: A review[J]. JAMA, 2019, 321(3): 288. doi: 10.1001/jama.2018.19323 [8] LI X, ZHAO C, SU C, et al. Epidemiological study of HER-2 mutations among EGFR wild-type lung adenocarcinoma patients in China[J]. BMC Cancer, 2016, 16(1): 828. doi: 10.1186/s12885-016-2875-z [9] NITTA H, KELLY BD, ALLRED C, et al. The assessment of HER2 status in breast cancer: the past, the present, and the future[J]. Pathol Int, 2016, 66(6): 313. doi: 10.1111/pin.12407 [10] 江泽飞, 邵志敏, 徐兵河, 等. 人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016[J]. 中华医学杂志, 2016, 96(14): 1091. doi: 10.3760/cma.j.issn.0376-2491.2016.14.006 [11] 陶维静, 胡春洪, 柏根基, 等. 乳腺癌MRI强化特征与免疫组织化学相关性分析[J]. 临床放射学杂志, 2016, 35(5): 706. [12] MANNELLI L, NOUGARET S, VARGAS HA, et al. Advances in diffusion weighted imaging[J]. Radiologic clinics of North America, 2015, 53: 569. doi: 10.1016/j.rcl.2015.01.002 [13] 程雪, 余日胜, 徐民, 等. 乳腺癌的功能磁共振成像征象与人表皮生长因子受体2表达差异的相关性分析[J]. 中华医学杂志, 2019, 99(31): 2440. doi: 10.3760/cma.j.issn.0376-2491.2019.31.007 [14] 张丽, 韩立新, 曹惠霞, 等. 3.0T磁共振扩散加权成像和VIBRANT动态增强在鉴别乳腺腺病与乳腺癌中的价值[J]. 临床放射学杂志, 2017, 36(3): 342. [15] 陈倩, 沈玉英, 蔡庆, 等. 乳腺癌MRI表现与CerbB-2、Ki-67表达的相关性研究[J]. 临床放射学杂志, 2016, 35(10): 1486. [16] PARK SH, CHOI HY, HAHN SY. Correlations between apparent diffusion coefficient values of invasive ductal carcinoma and pathologic factors on diffusion weighted MRI at 3.0 Tesla[J]. JMRI, 2015, 41(1): 175. doi: 10.1002/jmri.24519 [17] 李敏红, 陈德基, 罗永良, 等. 乳腺癌的MRI影像学特征与细胞分子表型之间的相关性研究[J]. 临床放射学杂志, 2015, 34(1): 36. [18] LI X, LI Y, ZHU Y, et al. Association between enhancement patterns and parameters of contrast-enhanced ultrasound and microvessel distribution in breast cancer[J]. Oncol Lett, 2018, 15(4): 5643. [19] 孙双燕, 杨长良, 黄志成, 等. 不同分子亚型乳腺癌MRI特征分析[J]. 中国临床医学影像杂志, 2017, 28(5): 327. doi: 10.3969/j.issn.1008-1062.2017.05.007 [20] HA R, JIN B, MANGO V, et al. Breast cancer molecular subtype as a predictor of the utility of preoperative MRI[J]. AJR, 2015, 204(6): 1354. doi: 10.2214/AJR.14.13666 [21] 郭斌. 乳腺癌病人腋窝淋巴结转移相关因素分析[J]. 蚌埠医学院学报, 2021, 46(2): 206. -





 下载:
下载: