-
2型糖尿病(T2DM)为糖尿病最常见类型,发病率占全部糖尿病病人的90%以上[1]。且有研究[2-3]显示, T2DM病人中非酒精性脂肪肝(NAFLD)发生率高达80%左右,40%~50%的NAFLD病人伴有不同程度的糖代谢异常。NAFLD的发生可增加肝纤维化、肝硬化发生风险,严重影响病人预后。相关研究[4]指出,血糖波动是T2DM病人并发NAFLD的独立危险因素。而T2DM作为一种以胰岛B细胞功能受损、胰岛素抵抗为主要发病机制的疾病,空腹胰岛素(FINS)水平变化与血糖指标密切相关[5]。C肽(CP)由胰岛B细胞合成、分泌,能准确反映胰岛B细胞的功能[6]。故本研究通过探究T2DM并NAFLD病人空腹C肽(FC-P)、FINS、血糖指标表达及其与肝纤维化的关系,旨在为临床治疗本病提供参考。现作报道。
-
选取2018年2月至2019年12月我院T2DM并NAFLD病人126例为研究组,随机选取同期126例单纯T2DM病人为对照A组,均符合T2DM的诊断标准[7],NAFLD诊断参照《非酒精性脂肪肝中医诊疗专家共识意见(2017)》[8]。126名健康体检者为对照B组。3组性别、年龄、体质量指数(BMI)、合并症、居住地、吸烟情况差异均无统计学意义(P>0.05)(见表 1)。
分组 n 男 女 年龄/岁 BMI/(kg/m2) 合并症 居住地 吸烟 高血压 冠心病 高血脂 城镇 农村 是 否 研究组 126 67 59 53.98±5.48 26.21±1.34 31 22 26 81 45 46 80 对照A组 126 71 55 53.26±6.62 25.94±1.08 28 19 22 77 49 50 76 对照B组 126 64 62 52.81±6.40 25.87±1.21 26 20 20 75 51 52 74 χ2 — 0.79 1.15* 2.75* 0.58 0.27 1.00 0.63 0.62 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 *示F值; 吸烟定义:每日吸烟1支以上,持续时间≥6个月 表 1 3组一般资料比较[n; 百分率(%)]
-
纳入标准:(1)认知功能良好,无沟通交流障碍;(2)无乙型肝炎、肝癌等其他肝脏疾病;(3)具有良好行为能力,能配合完成研究;(4)病人知晓本研究,已签署同意书。排除标准:(1)凝血功能障碍者;(2)恶性肿瘤病人;(3)严重心脑血管疾病病人;(4)NAFLD确诊先于T2DM者;(5)严重贫血、营养不良者;(6)严重感染性疾病病人;(7)近期持续服用糖皮质激素等药物者。
-
实验室指标检测方法:研究对象入组第2天清晨,采集空腹静脉血5 mL,分成两份,取血液标本以3 500 r/min转速、10 cm半径离心处理5 min,取血清,置于-70 ℃冷冻室内待检,由专业检测师采用电化学发光法测定血清FC-P水平,试剂盒购自上海信帆生物科技有限公司,采用固相免疫放射测定法测定血清FINS水平,试剂盒购自上海酶联生物科技有限公司。取血液标本,采用日本奥林巴斯公司AU2700型全自动生化分析仪检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)水平。
肝纤维化评定方法[9]:采用非酒精性脂肪肝纤维化评分(NAFLDFS)评估,NAFLDFS=-1.675+0.037×年龄(岁)+0.094×BMI(kg/m2)+1.13×糖调节受损或糖尿病(是=1,否=0)+0.99×丙氨酸氨基转移酶/天冬氨酸氨基转移酶-0.013×血小板计数(109/L)-0.66×白蛋白(g/L),NAFLDFS>0.676即可诊断为肝纤维化,-1.455≤NAFLDFS≤0.676为不确定肝纤维化,NAFLDFS < -1.455可排除肝纤维化。
-
(1) 比较3组血清FC-P、FINS、FPG、HbA1c水平。(2)探讨血清FC-P、FINS、FPG、HbA1c对T2DM并NAFLD的预测价值。(3)研究组不同NAFLDFS病人一般资料(年龄、性别、BMI、病程、腰围)及血清FC-P、FINS、FPG、HbA1c水平。(4)探究血清FC-P、FINS、FPG、HbA1c水平与T2DM并NAFLD病人NAFLDFS分值的关系。(5)分析T2DM并NAFLD病人NAFLDFS>0.676的影响因素。
-
采用方差分析、q检验、Spearman相关分析、χ2检验和logistic回归分析,采用受试者工作(ROC)曲线分析预测价值。
-
3组血清FC-P、FINS、FPG、HbA1c水平:研究组>对照A组>对照B组(P < 0.01)(见表 2)。
分组 n FC-P/(ng/mL) FINS/(mU/L) FPG/(mmol/L) HbA1c/% 研究组 126 2.79±0.34 12.49±2.72 9.63±1.97 9.81±1.84 对照A组 126 2.53±0.29** 10.64±2.30** 8.42±1.69** 8.59±1.62** 对照B组 126 1.32±0.21**## 7.57±2.12**## 5.27±1.31**## 5.46±1.15**## F — 954.20 135.86 226.54 259.54 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.081 5.728 2.818 2.444 q检验: 与研究组比较**P < 0.01;与对照A组比较##P < 0.01 表 2 3组血清FC-P、FINS、血糖指标水平比较(x±s)
-
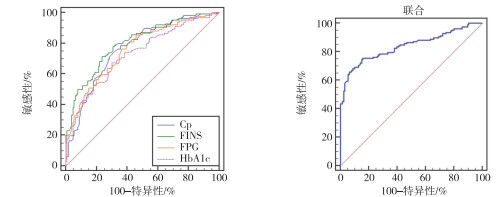
绘制血清FC-P、FINS、FPG、HbA1c预测T2DM并NAFLD的ROC曲线显示:血清FC-P预测的曲线下面积(AUC)为0.764,95%CI为0.707~0.815,截断值>2.56 ng/mL,对应预测敏感度为78.57%,特异度为64.29%;血清FINS预测的AUC为0.801,95%CI为0.747~0.849,截断值>11.02 mU/L,对应预测敏感度为71.43%,特异度为76.19%;FPG预测的AUC为0.757,95%CI为0.699~0.809,截断值>8.34 mmol/L,对应预测敏感度为85.71%,特异度为53.97%;HbA1c预测的AUC为0.729,95%CI为0.669~0.782,截断值>8.94%,对应预测敏感度为67.46%,特异度为69.46%;各指标联合预测的AUC为0.839,95%CI为0.788~0.882,Z统计=13.136,最佳预测敏感度为75.40%,特异度为84.13%(见图 1)。
-
研究组不同NAFLDFS分值病人年龄、性别差异均无统计学意义(P>0.05);随研究组病人NAFLDFS分值增高其BMI、病程、腰臀比逐渐增高(P < 0.01)(见表 3)。
分组 n 年龄/岁 男 女 BMI/(kg/m2) 病程/年 腰围/cm NAFLDFS>0.676 42 61.72±8.94 22 20 27.38±2.62 8.19±2.38 96.41±8.57 -1.455≤NAFLDFS≤0.676 49 59.96±7.26 26 23 25.42±2.25** 4.87±2.14** 89.06±7.39** NAFLDFS < -1.455 35 58.31±7.68 19 16 23.85±2.08**## 2.95±0.86**## 84.79±2.15**## F — 1.76 0.03△ 22.13 70.95 28.74 P — >0.05 >0.05 < 0.01 < 0.01 < 0.01 MS组内 — 63.514 — 5.460 3.880 47.071 △示χ2值。q检验: 与NAFLDFS>0.676组比较**P < 0.01;与-1.455≤NAFLDFS≤0.676组比较##P < 0.01 表 3 研究组不同NAFLDFS分值病人一般资料比较(x±s)
-
随研究组病人NAFLDFS分值增高其血清FC-P、FINS、FPG、HbA1c水平逐渐增高(P < 0.05~P < 0.01)(见表 4)。
分组 n FC-P/(ng/mL) FINS/(mU/L) FPG/(mmol/L) HbA1c/% NAFLDFS>0.676 42 3.14±0.39 13.74±2.95 10.64±2.02 10.68±2.06 -1.455≤NAFLDFS≤0.676 49 2.68±0.31** 12.36±2.63* 9.47±1.86** 9.74±1.82* NAFLDFS < -1.455 35 2.52±0.28**# 11.17±2.29**# 8.64±1.61**# 8.86±1.75**# F — 37.72 9.04 11.44 8.95 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.110 7.050 3.427 3.554 q检验: 与NAFLDFS>0.676组比较**P < 0.01;与-1.455≤NAFLDFS≤0.676组比较#P < 0.05 表 4 研究组不同NAFLDFS分值病人各指标水平比较(x±s)
-
Spearman相关分析发现,血清FC-P(r=0.639、P < 0.01)、FINS(r=0.593、P < 0.01)、FPG(r=0.604、P < 0.01)、HbA1c(r=0.582、P < 0.01)与T2DM并NAFLD病人NAFLDFS分值均呈明显正相关关系。
-
以T2DM并NAFLD病人NAFLDFS>0.676的为因变量,将病人单因素分析有意义因素BMI、病程、腰臀比、血清FC-P、FINS、FPG、HbA1c为自变量,纳入logistic回归分析模型,结果发现,病程、血清FC-P、FINS、FPG、HbA1c为T2DM并NAFLD病人NAFLDFS>0.676的独立危险因素(P < 0.01)(见表 5)。
变量 B SE Waldχ2 P OR 95%CI 病程 1.599 0.489 10.69 < 0.01 4.949 2.741~8.935 FC-P 1.728 0.564 9.38 < 0.01 5.627 3.587~8.826 FINS 1.461 0.508 8.27 < 0.01 4.311 2.419~7.684 FPG 1.210 0.412 8.63 < 0.01 3.354 1.924~5.847 HbA1c 0.995 0.358 7.72 < 0.01 2.704 1.716~4.260 表 5 T2DM并NAFLD病人NAFLDFS>0.676的影响因素
-
近年来我国T2DM患病人数逐渐增加,T2DM与NAFLD存在明显关联性,增加与肝脏相关疾病的死亡率,应高度重视T2DM并NAFLD病人肝病的进展情况[10-11]。
NAFLD的发生被认为与糖代谢异常、胰岛素抵抗等密切相关[12]。本研究发现,T2DM并NAFLD病人FPG、HbA1c水平明显高于单纯T2DM病人及健康人群,与李昊翔等[13-14]研究结果一致,充分证明血糖指标异常可增加T2DM病人并发NAFLD风险。FPG、HbA1c水平越高,提示病人糖尿病控制情况越差,糖代谢异常程度越高。高血糖被认为是肝脏损害的危险因素之一,导致肝细胞功能受损,且糖代谢异常引发脂肪动员,当大量脂肪积蓄于肝脏时,可引发脂肪肝[15]。且肝脏作为机体代谢的主要器官,其代偿能力较强,肝脏损伤早期一般无明显症状,一旦出现相关症状后肝损伤往往发展至较严重阶段[16]。因此, 早期发现T2DM并NAFLD并及时治疗,对改善病人预后至关重要。本研究结果还显示,FPG、HbA1c在预测T2DM并NAFLD方面均具有一定临床价值,提示二者可能作为预测T2DM并NAFLD风险的生物学指标。张广清等[17]研究指出,胰岛素也可能是糖尿病病人并发肝脏损害的原因之一。本研究发现,T2DM并NAFLD病人血清FINS呈异常高表达状态,可能参与T2DM并NAFLD的发生,与上述研究结论相符。血清FINS表达升高可导致肝脏脂肪变性及外周组织胰岛素抵抗,增加NAFLD发生风险[18]。有研究[19]表明,当肝脏有病变产生时,肝功能受损可能导致胰岛素等代谢受到影响。NAFLD病人脂肪在肝脏内积蓄增加,可导致脂肪组织功能失调及脂毒性增强,从而加重胰岛素抵抗及胰岛B细胞功能受损,引起血清FINS表达升高。但糖尿病病人胰岛素水平也可能降低,仅从血清FINS变化情况推测肝损伤可能存在明显偏差。CP是一个具有31个氨基酸的内源性多肽,由胰岛素原在胰岛细胞中断裂形成。冯伟广等[20]研究发现,胰岛素和CP、CP与胰岛素比值可在很大程度上反映出肝病病人的肝细胞受损的情况,并且和病人的预后紧密相连。本研究发现,T2DM并NAFLD病人血清FC-P表达明显升高,与彭扬洋等[21]研究结果一致。CP和胰岛素来源于同一前体即胰岛素原,一个分子的胰岛素原的酶切产物为一个分子的CP以及一个分子的胰岛素。T2DM并NAFLD导致胰岛B细胞功能受损加重,其分泌的CP增加,且通过肝脏代谢的CP量减少,最终导致血清FC-P水平升高。本研究发现血清FC-P、FINS在预测T2DM并NAFLD同样具有一定价值,尤其是血清FC-P、FINS、FPG、HbA1c联合对T2DM并NAFLD进行预测,AUC高达0.839,预测效能优于各指标单一预测,有助于临床评估T2DM病人并发NAFLD的风险,或将对临床早期发现T2DM并NAFLD提供参考,有待后续研究中进一步深入探究。
NAFLDFS是一种与NAFLD病人肝脏纤维化程度相关的非侵入性评价系统,2012年被美国胃肠病协会指南推荐使用,其分值高于高诊断阈值(0.676)基本可以确定为肝纤维化,在评估NAFLD病人肝脏纤维化程度方面的应用十分广泛[22-23]。本研究显示,T2DM并NAFLD病人血清FC-P、FINS、FPG、HbA1c表达水平与NAFLDFS分值间均呈明显正相关关系,可在一定程度上反映病人肝纤维化程度,且本研究经logistic回归分析发现,随着T2DM并NAFLD病人血清FC-P、FINS、FPG、HbA1c水平升高,NAFLDFS>0.676的发生风险逐渐升高。因此,通过相关措施抑制病人血清FC-P、FINS、FPG、HbA1c表达,可能有助于降低肝纤维化发生风险,从而改善病人预后情况。本研究还发现,病程增加也是T2DM并NAFLD病人NAFLDFS>0.676危险因素,因此尽早检出并积极开展早期治疗,对控制肝脏损伤进展具有重要意义。
综上可知,T2DM并NAFLD病人FC-P、FINS、血糖指标表达明显升高,且与病人肝纤维化评分呈正相关关系,检测各指标表达水平将有助于临床预测T2DM病人并发NAFLD的风险、评估肝纤维化程度,可为临床防止病人病情进展提供指导性参考。
T2DM合并NAFLD病人FC-P、FINS、血糖指标表达及其与肝纤维化的关系
Relationship between the expression levels of FC-P, FINS and blood glucose indexes, and liver fibrosis in T2DM patients complicated with NAFLD
-
摘要:
目的探究2型糖尿病(T2DM)合并非酒精性脂肪肝(NAFLD)病人空腹C肽(FC-P)、空腹胰岛素(FINS)、血糖指标[空腹血糖(FPG)、糖化血红蛋白(HbA1c)]表达情况及各指标与肝纤维化的关系。 方法选取T2DM并NAFLD病人126例为研究组,随机选取同期126例单纯T2DM病人为对照A组,126名健康体检者为对照B组。比较3组血清FC-P、FINS、FPG、HbA1c水平,并比较研究组不同NAFLD肝纤维化评分(NAFLDFS)病人上述指标水平,探讨血清FC-P、FINS、FPG、HbA1c对T2DM并NAFLD的预测价值,探究各指标与T2DM并NAFLD病人NAFLDFS分值的关系,并分析T2DM并NAFLD病人NAFLDFS>0.676的影响因素。 结果血清FC-P、FINS、FPG、HbA1c水平研究组>对照A组>对照B组(P < 0.01);血清FC-P、FINS、FPG、HbA1c联合预测T2DM并NAFLD的受试者基本工作特征曲线下面积(AUC)为0.839,大于各指标单一预测的AUC(0.764、0.801、0.757、0.729),联合预测的最佳敏感度、特异度分别为75.40%、84.13%;随研究组病人NAFLDFS分值增高,其体质量指数(BMI)、病程、腰臀比、血清FC-P、FINS、FPG、HbA1c水平均逐渐增高(P < 0.01);研究组病人血清FC-P、FINS、FPG、HbA1c表达水平与NAFLDFS分值间均呈正相关关系(P < 0.01);经logistic回归分析发现,随着T2DM并NAFLD病人病程增加,血清FC-P、FINS、FPG、HbA1c水平升高,NAFLDFS>0.676的发生风险逐渐升高(P < 0.01)。 结论T2DM并NAFLD病人FC-P、FINS、血糖指标高表达与肝纤维化评分呈正相关关系,联合检测可为预测T2DM病人并发NAFLD的风险、评估肝纤维化程度、抑制病情进展提供指导性参考。 Abstract:ObjectiveTo explore the serum levels of fasting C-peptide(FC-P), fasting insulin(FINS), blood glucose indexes[fasting plasma glucose(FPG), glycosylated hemoglobin(HbA1c)] in patients with type 2 diabetes mellitus(T2DM) complicated with non-alcoholic fatty liver disease(NAFLD), and relationship between each index and liver fibrosis. MethodsOne hundred and twenty-six patients with T2DM complicated with NAFLD were set as the study group.One hundred and twenty-six patients with T2DM and 126 healthy medical examinees during the same period were divided into the control group A and control group B, respectively.The serum levels of FC-P, FINS, FPG and HbA1c among three groups were compared, and the above index levels of patients with different NAFLD fibrosis scores(NAFLDFS) in the study group were compared.The predictive value of serum levels of FC-P, FINS, FPG and HbA1c to T2DM patients complicated with NAFLD were investigated, the relationship between each index and NAFLDFS score in T2DM patients complicated with NAFLD were explored, and the influencing factors of T2DM patients complicated with NAFLDFS more than 0.676 were analyzed. ResultsThe serum levels of FC-P, FINS, FPG and HbA1c in the study group, control group A and control group B gradually decreased(P < 0.01).The area under the curve(AUC) predicted by the serum levels combination of FC-P, FINS, FPG and HbA1c in T2DM patients complicated with NAFLD was 0.839, which was greater than the AUC predicted by each indicator alone(0.764, 0.801, 0.757 and 0.729, respectively).The best sensitivity and specificity of the combined prediction were 75.40% and 84.13%, respectively.With the increasing of NAFLDFS score, the body mass index, disease duration, waist-to-hip ratio, and serum levels of FC-P, FINS, FPG, and HbA1c gradually increased in the study group(P < 0.01).There was a positive correlation between the expression levels of serum FC-P, FINS, FPG and HbA1c, and NAFLDFS score in the study group(P < 0.01).The results of logistic regression analysis showed that with the disease course of T2DM patients complicated with NAFLD prolonging, the serum levels of FC-P, FINS, FPG and HbA1c increased, and the risk of NAFLDFS>0.676 gradually increased(P < 0.01). ConclusionsThe high levels of FC-P, FINS and blood glucose indexes in T2DM patients complicated with NAFLD is positively correlated with the liver fibrosis score.The combined detection can predict the risk of NAFLD in T2DM patients, and provide the guiding reference in evaluating the degree of liver fibrosis, and inhibiting the progression of the disease. -
表 1 3组一般资料比较[n; 百分率(%)]
分组 n 男 女 年龄/岁 BMI/(kg/m2) 合并症 居住地 吸烟 高血压 冠心病 高血脂 城镇 农村 是 否 研究组 126 67 59 53.98±5.48 26.21±1.34 31 22 26 81 45 46 80 对照A组 126 71 55 53.26±6.62 25.94±1.08 28 19 22 77 49 50 76 对照B组 126 64 62 52.81±6.40 25.87±1.21 26 20 20 75 51 52 74 χ2 — 0.79 1.15* 2.75* 0.58 0.27 1.00 0.63 0.62 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 *示F值; 吸烟定义:每日吸烟1支以上,持续时间≥6个月 表 2 3组血清FC-P、FINS、血糖指标水平比较(x±s)
分组 n FC-P/(ng/mL) FINS/(mU/L) FPG/(mmol/L) HbA1c/% 研究组 126 2.79±0.34 12.49±2.72 9.63±1.97 9.81±1.84 对照A组 126 2.53±0.29** 10.64±2.30** 8.42±1.69** 8.59±1.62** 对照B组 126 1.32±0.21**## 7.57±2.12**## 5.27±1.31**## 5.46±1.15**## F — 954.20 135.86 226.54 259.54 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.081 5.728 2.818 2.444 q检验: 与研究组比较**P < 0.01;与对照A组比较##P < 0.01 表 3 研究组不同NAFLDFS分值病人一般资料比较(x±s)
分组 n 年龄/岁 男 女 BMI/(kg/m2) 病程/年 腰围/cm NAFLDFS>0.676 42 61.72±8.94 22 20 27.38±2.62 8.19±2.38 96.41±8.57 -1.455≤NAFLDFS≤0.676 49 59.96±7.26 26 23 25.42±2.25** 4.87±2.14** 89.06±7.39** NAFLDFS < -1.455 35 58.31±7.68 19 16 23.85±2.08**## 2.95±0.86**## 84.79±2.15**## F — 1.76 0.03△ 22.13 70.95 28.74 P — >0.05 >0.05 < 0.01 < 0.01 < 0.01 MS组内 — 63.514 — 5.460 3.880 47.071 △示χ2值。q检验: 与NAFLDFS>0.676组比较**P < 0.01;与-1.455≤NAFLDFS≤0.676组比较##P < 0.01 表 4 研究组不同NAFLDFS分值病人各指标水平比较(x±s)
分组 n FC-P/(ng/mL) FINS/(mU/L) FPG/(mmol/L) HbA1c/% NAFLDFS>0.676 42 3.14±0.39 13.74±2.95 10.64±2.02 10.68±2.06 -1.455≤NAFLDFS≤0.676 49 2.68±0.31** 12.36±2.63* 9.47±1.86** 9.74±1.82* NAFLDFS < -1.455 35 2.52±0.28**# 11.17±2.29**# 8.64±1.61**# 8.86±1.75**# F — 37.72 9.04 11.44 8.95 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.110 7.050 3.427 3.554 q检验: 与NAFLDFS>0.676组比较**P < 0.01;与-1.455≤NAFLDFS≤0.676组比较#P < 0.05 表 5 T2DM并NAFLD病人NAFLDFS>0.676的影响因素
变量 B SE Waldχ2 P OR 95%CI 病程 1.599 0.489 10.69 < 0.01 4.949 2.741~8.935 FC-P 1.728 0.564 9.38 < 0.01 5.627 3.587~8.826 FINS 1.461 0.508 8.27 < 0.01 4.311 2.419~7.684 FPG 1.210 0.412 8.63 < 0.01 3.354 1.924~5.847 HbA1c 0.995 0.358 7.72 < 0.01 2.704 1.716~4.260 -
[1] KARKI R, KODAMULLIL AT, HOFMANN-APITIUS M. Comorbidity analysis between Alzheimer's disease and type 2 diabetes mellitus(T2DM) based on shared pathways and the role of T2DM drugs[J]. J Alzheimers Dis, 2017, 60(2): 721. doi: 10.3233/JAD-170440 [2] 范译丹, 陈玉, 饶春梅, 等. T2DM病人合并非酒精性脂肪肝与胰岛β细胞功能和胰岛素抵抗的关系[J]. 昆明医科大学学报, 2018, 39(11): 62. doi: 10.3969/j.issn.1003-4706.2018.11.015 [3] 史丽伟, 倪青, 冯玲, 等. 2型糖尿病人群非酒精性脂肪肝的中西医诊疗进展[J]. 医学综述, 2018, 24(12): 145. [4] FUMI H, AKIRA H, HIDEYUKI H, et al. Evaluation of glycemic variability in chronic liver disease patients with type 2 diabetes mellitus using continuous glucose monitoring[J]. PLoS One, 2018, 13(4): e0195028. doi: 10.1371/journal.pone.0195028 [5] 廖世波, 黄淑玉, 吴敏, 等. 外源性胰岛素与2型糖尿病病人空腹胰岛素水平的相关性研究[J]. 中国全科医学, 2018, 21(23): 25. [6] SIRAJ ES, CAROL H, WILSON LA, et al. Islet cell associated autoantibodies and C-peptide levels in patients with diabetes and symptoms of gastroparesis[J]. Front Endocrinol, 2018, 9(1): 32. [7] ASCHNER PM, MUÑOZ OM, GIRÓN D, et al. Clinical practice guideline for the prevention, early detection, diagnosis, management and follow up of type 2 diabetes mellitus in adults[J]. Colomb Med, 2016, 47(2): 109. [8] 中华中医药学会脾胃病分会. 非酒精性脂肪性肝病中医诊疗专家共识意见(2017)[J]. 中医杂志, 2017, 58(19): 1706. [9] CHEN PC, KAO WY, CHENG YL, et al. The correlation between fatty liver disease and chronic kidney disease. [J]. J Formos Med Assoc, 2020, 119(1Pt1): 42. [10] 王凌, 刘建宏, 崔欣, 等. 西安市体检人群2型糖尿病流行病学调查及相关因素分析[J]. 解放军预防医学杂志, 2018, 36(4): 483. [11] 叶凡豪, 代敏, 杨孟雪, 等. 糖尿病合并非酒精性脂肪性肝病病人血清25-羟维生素D水平的变化及其临床意义[J]. 中国糖尿病杂志, 2017, 25(7): 587. [12] 汪运生, 戴武. 非酒精性脂肪性肝病与2型糖尿病关系的研究进展[J]. 安徽医学, 2019, 40(3): 339. [13] 李昊翔, 徐梦娇, 袁婧, 等. 2型糖尿病合并非酒精性脂肪肝病人血清白脂素浓度变化及其影响因素[J]. 江苏大学学报(医学版), 2019, 29(1): 62. [14] 杨丽弘, 廖鑫, 张晗, 等. 2型糖尿病合并非酒精性脂肪肝肝纤维化与血清25-羟维生素D水平的关系研究[J]. 中国糖尿病杂志, 2018, 26(2): 117. [15] 韩冰峰, 杨树博, 张入学, 等. 2型糖尿病和空腹血糖受损与肝功能指标的相关性研究[J]. 中国预防医学杂志, 2019, 20(6): 505. [16] HEIDARI R, MOHAMMADI H, GHANBARINEJAD V, et al. Proline supplementation mitigates the early stage of liver injury in bile duct ligated rats[J]. J Basic Clin Physiol Pharmacol, 2018, 30(1): 91. [17] 张广清, 林学壬, 葛晶晶. 糖尿病合并肝脏损害病人胰岛素、C肽和血糖水平变化及临床意义研究[J]. 国际检验医学杂志, 2017, 38(23): 3303. [18] 王蕤, 吴素萍, 徐品颖. 2型糖尿病合并非酒精性脂肪肝病人血浆miR-577水平与脂代谢及胰岛素抵抗关系的研究[J]. 中国实验诊断学, 2019, 23(5): 795. [19] 王诗钰, 史琴瑶, 陈柳, 等. 2型糖尿病合并脂肪肝老年病人胰岛素抵抗及脂代谢状况分析[J]. 解放军预防医学杂志, 2018, 36(8): 993. [20] 冯伟广, 周建, 朱礼尧, 等. 肝病病人血糖、胰岛素和C肽对于其病程发展转归的预警作用[J]. 肝脏, 2017, 22(11): 1060. [21] 彭扬洋, 刘艳秋, 邱樊. 胰岛素抗体阳性的2型糖尿病病人血清甲状腺激素、促甲状腺激素水平分析[J]. 检验医学与临床, 2019, 16(22): 3236. [22] 范雪梅, 赵凌霞, 郗光霞, 等. 2型糖尿病血糖波动与非酒精性脂肪性肝病肝纤维化评分的相关性研究[J]. 中国药物与临床, 2019, 19(11): 1765. [23] 任桂晶. 空腹C肽联合血清学诊断模型对2型糖尿病合并脂肪肝人群肝纤维化的评估价值[D]. 长春: 吉林大学, 2018. -





 下载:
下载: