-
选取2016-2019年我院收治的80例HDCP病人,依据疾病进展情况分为伴严重表现子痫前期组21例、不伴严重表现子痫前期组34例、单纯HDCP组25例,另选择同期68名正常妊娠孕妇为对照组。本研究均经我院医学伦理委员会批准。
纳入标准:(1)伴严重表现子痫前期组、不伴严重表现子痫前期组、HDCP组均符合《HDCP诊治指南(2020年版)》[7]和《ACOGHDCP指南》[8]中相关标准;(2)4组均于我院建立孕期档案并按时孕检,临床资料完整,且病人及家属均签署知情同意书。排除标准:(1)妊娠合并冠心病或原发性皮质醇增多合并妊娠;(2)合并病毒性肝炎、脂肪肝等其他肝脏疾病;(3)合并系统性红斑狼疮、甲状腺功能亢进、心脑血管疾病或其他慢性疾病;(4)近期有影响凝血系统药物服用史;(5)精神行为异常。
-
收集一般资料通过仔细查阅病人病历资料,设计临床研究表,调查内容:年龄、孕前体质量、孕周、产妇类型、收缩压(SBP)、舒张压(DBP)。
-
空腹采5 mL静脉血,3 000 r/min离心15 min,离心半径8 cm,分离取血清,置于-70 ℃低温保存。采用全自动生化分析仪及其配套试剂盒检测血清CHE、GGT、LDH水平,仪器及其配套试剂盒购自瑞士罗氏公司,上述操作均严格按照仪器、试剂盒说明书执行。
-
(1) 比较4组一般资料,包括年龄、孕前体质量、孕周、产妇类型、SBP、DBP。(2)比较4组血清CHE、GGT、LDH表达。(3)分析HDCP病人血清CHE、GGT、LDH与血压(SBP、DBP)水平的关系。(4)分析血清CHE、GGT、LDH与子痫前期发病的关系。(5)比较是否出现不良妊娠结局HDCP病人血清CHE、GGT、LDH表达。其中妊娠不良结局分为3个方面,即病人不良结局:胎盘早剥、脑出血、微血管病性溶血、中枢神经系统症状、肝肾心肺衰竭、肺水肿、严重胸腹水、死亡、治疗性引产;胎儿不良结局:胎儿生长受限、羊水过少、死胎;新生儿不良结局:新生儿窒息、死产、新生儿死亡、低出生体质量。(6)分析血清CHE、GGT、LDH单一及联合对HDCP病人出现不良妊娠结局的预测价值。
-
采用t检验、方差分析、q检验、χ2检验、logistic回归分析、Pearson相关分析和受试者工作特征曲线(ROC)分析。
-
4组年龄、孕前体质量、孕周、产妇类型差异均无统计学意义(P>0.05),SBP与DBP水平4组间均为伴严重表现子痫前期组>不伴严重表现子痫前期组>HDCP组>对照组(P < 0.05~P < 0.01)(见表 1)。
分组 n 年龄/岁 孕前体质量/kg 孕周/周 初产妇 经产妇 SBP/(mmol/L) DBP/(mmol/L) 对照组 68 26.89±3.43 54.32±5.64 38.08±0.93 43 25 136.53±7.51 87.29±6.84 HDCP组 25 27.28±3.16 54.57±5.28 38.21±0.79 16 9 142.21±8.04** 92.04±7.02** 不伴严重表现子痫前期组 34 27.47±2.86 54.76±5.92 38.42±0.91 23 11 147.05±8.63**△ 95.89±7.26**△ 伴严重表现子痫前期组 21 27.12±3.05 55.04±4.73 37.96±0.82 15 6 153.47±9.62**△△## 100.84±8.29**△△# F — 0.27 0.11 1.53 0.58□ 28.14 23.67 P — >0.05 >0.05 >0.05 >0.05 < 0.01 < 0.01 MS组内 — 10.305 30.586 0.790 — 66.936 51.606 □示χ2值。q检验:与对照组比较** P < 0.01;与HDCP组比较△P < 0.05,△△P0.01;与不伴严重表现子痫前期组比较#P < 0.05,##P < 0.01 表 1 4组一般资料比较(x±s)
-
4组血清CHE表达为伴严重表现子痫前期组 < 不伴严重表现子痫前期组和HDCP组 < 对照组(P < 0.01);GGT与LDH表达为伴严重表现子痫前期组>不伴严重表现子痫前期组>HDCP组>对照组(P < 0.05~P < 0.01)(见表 2)。
分组 n CHE/(kU/L) GGT/(U/L) LDH/(IU/L) 对照组 68 4.57±1.36 17.83±6.76 131.62±25.83 HDCP组 25 3.49±1.02** 24.52±9.24** 198.02±32.96** 不伴严重表现子痫前期组 34 3.15±0.83** 29.97±10.74**△ 235.94±36.58**△△ 伴严重表现子痫前期组 21 2.08±0.69**△△## 41.06±13.35**△△## 314.50±68.23**△△## F — 31.26 37.52 145.25 P — <0.01 <0.01 <0.01 MS组内 — 1.258 86.679 1 444.710 q检验:与对照组比较** P < 0.01;与HDCP组比较△P < 0.05,△△P < 0.01;与不伴严重表现子痫前期组比较##P < 0.01 表 2 4组血清CHE、GGT、LDH表达比较(x±s)
-
HDCP病人血清CHE表达与SBP、DBP水平均呈负相关关系(P < 0.01),GGT、LDH表达与SBP、DBP水平均呈正相关关系(P < 0.01)(见表 3)。
项目 CHE GGT LDH SBP -0.595** 0.618** 0.729** DBP -0.583** 0.604** 0.697** **P < 0.01 表 3 HDCP病人血清各指标与血压水平的关系(r)
-
在控制年龄、孕前体质量、孕周、产妇类型等基线资料后,经logistic回归分析发现,血清CHE水平与子痫前期发病呈负相关关系(P < 0.01),GGT、LDH与子痫前期发病均呈正相关关系(P < 0.01)(见表 4)。
变量 B SE Waldχ2 P OR 95%CI CHE -0.954 0.324 8.663 <0.01 0.385 0.226~0.657 GGT 1.723 0.547 9.921 <0.01 5.601 3.562~8.806 LDH 1.555 0.468 11.047 <0.01 4.737 2.475~9.068 表 4 血清各指标与子痫前期发病关系的logistic回归分析
-
随访至分娩,无脱落病例。出现不良妊娠结局HDCP病人血清CHE表达明显低于未出现不良妊娠结局HDCP病人(P < 0.01),GGT、LDH表达均明显高于未出现不良妊娠结局HDCP病人(P < 0.01)(见表 5)。
分组 n CHE/(kU/L) GGT/(U/L) LDH/(IU/L) 出现不良妊娠结局 31 2.56±0.75 37.58±12.06 283.04±46.52 未出现不良妊娠结局 49 3.25±1.04 27.13±10.49 220.46±39.07 t — 3.20 4.10 6.48 P — < 0.01 < 0.01 < 0.01 表 5 是否出现不良妊娠结局HDCP病人血清各指标表达比较(x±s)
-
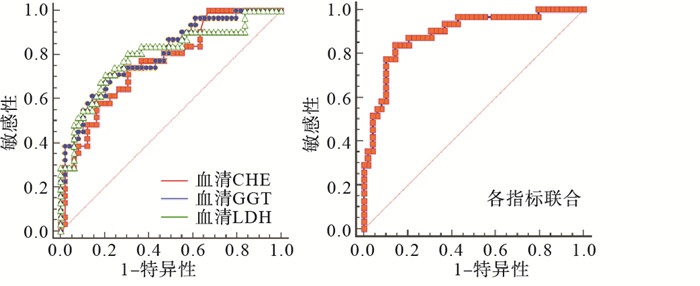
血清CHE、GGT、LDH预测HDCP病人出现不良妊娠结局的最佳截断值分别≤2.83 kU/L、>32.16 U/L、>256.06 IU/L,其曲线下面积(AUC)均小于联合预测(P < 0.01)(见表 6、图 1)。
指标 AUC 95%CI P 截断值 敏感度/% 特异度/% CHE 0.766 0.658~0.854 <0.01 ≤2.83 kU/L 74.19 69.39 GGT 0.801 0.697~0.882 <0.01 >32.16 U/L 70.97 77.55 LDH 0.798 0.693~0.879 <0.01 >256.06 IU/L 70.97 79.59 各指标联合 0.891 0.801~0.949 0.01 — 83.87 85.71 表 6 血清各指标预测HDCP病人出现不良妊娠结局的ROC曲线分析
-
全身小血管痉挛、血管内皮细胞损伤、局部缺血是HDCP主要病理生理基础[9],但具体机制尚未完全阐明,且临床表现多样,故寻找可信赖指标,评估HDCP病人病情与预后情况是目前产科工作者研究重要课题
LDH作为主要氧化还原酶之一,当细胞缺血缺氧时,无氧糖酵解增加,其合成与分泌加快,可能参与机体解毒、氧化还原及部分生理活动[10-11]。陈大立等[12]研究发现,血清LDH水平随HDCP疾病程度加重呈上升趋势,是子痫前期及伴严重表现子痫前期的独立危险因素,本研究结果与之相符。随HDCP病人病情持续进展,其血管壁紧张性、血管内压力出现不同程度升高,导致血管壁内皮细胞通透性增强[13],致大量蛋白及液体渗漏至组织间隙,从而促使血液黏稠度升高,引发血液氧供失衡,最终促使血液大量合成LDH。可见LDH通过反映HDCP病人缺氧缺血水平,有望成为评估病情程度的间接指标。本研究进一步经ROC曲线分析可知,血清LDH对HDCP病人出现不良妊娠结局具有一定预测价值,与蒋利红等[14]研究结果相符,推测可能是由于血清LDH水平持续升高一定程度会加重血液黏稠度,继而急剧增高孕妇血压,从而诱导胎盘血管急性动脉粥样硬化,降低胎盘功能,引发绒毛浸润障碍,导致胎盘浅着床,加重血管内皮功能障碍及免疫平衡失调,进而诱发胎盘供血不足,增加胎儿生长受限、新生儿呼吸窘迫等不良妊娠结局发生风险。因此,早期监测HDCP病人血清LDH水平,并予以早期干预、处理对预防不良妊娠结局具有重要临床价值。
研究[15]显示,约30%子痫前期病人存在明显肝功能异常,其中以转氨酶水平异常最为常见。同时,HDCP病人体内存在氧化应激、脂质过氧化,易引发血管内皮损伤,继而诱发子痫前期[16]。而GGT是评估肝功能状态最常用指标,也是氧化应激发生的独立危险因素[17]。另有学者[18]发现,血清GGT水平与血压水平存在正相关关系,可能是DBP升高的独立影响因素。本研究经Pearson相关分析可知,HDCP病人血清GGT表达与SBP、DBP水平呈正相关关系,可能与HDCP病人存在脏器低血流灌注现象,可能激发氧化应激,增加GGT水平,从而间接影响血压调节有关。推测血清GGT水平高表达对HDCP具有一定诊断价值。同时,DACAJ等[19]认为,母体脂代谢与糖代谢异常可能是子痫前期发病基础,不仅损伤胎盘与血管系统,还加重肝脏负担,主要表现为GGT、天门冬氨酸氨基转移酶等转氨酶水平增加。本研究结果显示,血清GGT水平在伴严重表现子痫前期病人呈高表达状态,与GOULOPOULOU[20]研究相似,分析机制在于,HDCP病人病情进展可能会加重肝脏内小动脉痉挛,引发肝细胞缺血、缺氧,进而诱导细胞肿胀、细胞膜通透性升高及肝细胞微粒体内酶分泌,从而释放大量血清GGT水平,形成恶性循环。另外,本研究还发现,血清GGT水平过度表达可能会增加HDCP病人不良妊娠结局发生风险,提示血清GGT水平对HDCP病人不良妊娠结局风险具有预测能力,可为临床选择针对性干预方案提供新靶点。
CHE是胆碱能信号传递重要调控环节,其水平下降可能提高乙酰胆碱酯酶活性,加重肝组织损伤[21]。本研究结果显示,血清CHE水平随HDCP病人病情程度加重出现下降趋势,并是子痫前期发生的重要影响因素,结合应萍等[22]研究结果推测,HDCP病人伴有母胎界面炎症反应,可激活机体代偿胆碱能抗炎通路,抑制血清CHE合成,促使CHE等酶蛋白消耗、分解,从而增加血清乙酰胆碱表达水平,引发促炎与抗感染反应失衡,加快病情恶化。但胆碱能抗炎通路是否在子痫前期疾病中也起着重要抗炎作用,需大量基础与临床研究进一步论述。另外,本研究随访至分娩发现,出现不良妊娠结局HDCP病人血清CHE表达低于未出现不良妊娠结局HDCP病人,推测与血清CHE表达下降可能会抑制胆碱能抗炎通路,诱发全身炎症反应,影响胎儿正常发育有关。然而经ROC曲线分析显示,血清CHE预测HDCP病人出现不良妊娠结局的特异度较低,预测效果不甚理想,故本研究选取联合预测模式,结果表明,血清CHE、GGT、LDH联合预测HDCP病人出现不良妊娠结局AUC为0.891,大于上述血清指标单一预测,说明三者联合可作为预测HDCP病人出现不良妊娠结局的生化检测指标,为临床治疗及孕产预后评估提供参考。
妊娠期高血压疾病病人血CHE、GGT、LDH与病情程度的相关性研究
Study on the correlation between the levels of CHE, GGT and LDH, and severity of hypertensive disorder complicating pregnancy patients
-
摘要:
目的探讨妊娠期高血压疾病(HDCP)病人血清胆碱酯酶(CHE)、γ-谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)表达变化及与病情程度的相关性。 方法选取80例HDCP病人,依据HDCP进展情况分为伴严重表现子痫前期组21例、不伴严重表现子痫前期组34例、单纯HDCP组25例,另选同期68名正常妊娠孕妇为对照组。比较4组血清CHE、GGT、LDH表达,分析HDCP病人血清各指标表达与血压指标[收缩压(SBP)、舒张压(DBP)]关系及与病人子痫前期发生的关联性,探讨血清各指标预测HDCP病人出现不良妊娠结局的价值。 结果SBP、DBP水平为伴严重表现子痫前期组>不伴严重表现子痫前期组>HDCP组>对照组(P < 0.05~P < 0.01);血清CHE为伴严重表现子痫前期组<不伴严重表现子痫前期组<HDCP组<对照组(P < 0.01);血清GGT、LDH为伴严重表现子痫前期组>不伴严重表现子痫前期组>HDCP组>对照组(P < 0.05~P < 0.01);HDCP病人血清CHE表达与SBP、DBP水平均呈负相关关系(P < 0.01),GGT、LDH表达与SBP、DBP水平均呈正相关关系(P < 0.01)。在控制年龄、孕前体质量、孕周、产妇类型后,血清CHE水平与子痫前期发病呈负相关关系(P < 0.01),GGT、LDH与子痫前期发病均呈正相关关系(P < 0.01)。随访至分娩,出现不良妊娠结局HDCP病人血清CHE表达低于未出现不良妊娠结局HDCP病人(P < 0.01),GGT、LDH表达高于未出现不良妊娠结局HDCP病人(P < 0.01)。血清CHE、GGT、LDH预测HDCP病人出现不良妊娠结局的最佳截断值分别≤ 2.83 kU/L、>32.16 U/L、>256.06 IU/L,其曲线下面积均小于联合预测。 结论血清CHE、GGT、LDH异常表达是子痫前期发生的重要影响因素,并与HDCP病人病情程度存在一定相关性,三者联合预测HDCP病人出现不良妊娠结局效果更好。 Abstract:ObjectiveTo investigate the changes of serum levels of cholinesterase(CHE), γ-glutamyl transpeptidase(GGT) and lactate dehydrogenase(LDH) expression in patients with hypertensive disorder complicating pregnangcy(HDCP), and their correlation with the degree of disease. MethodsEighty patients with HDCP were selected, and divided into the severe preeclampsia group(21 cases), non-severe preeclampsia group(34 cases) and simple HDCP group(25 cases) according to the progress of HDCP, and 68 normal pregnant women in the same period were selected as the control group.The serum levels of CHE, GGT and LDH in four groups were measured and compared.The relationship between the serum indicators, and levels of SBP and DBP, occurrence of preeclampsia in HDCP patients were analyzed, and the value of serum indexes in predicting adverse pregnancy outcome in HDCP patients was investigated. ResultsThe levels of SBP and DBP in the severe preeclampsia group, non-severe preeclampsia group, HDCP group and control group gradually decreased in turn(P < 0.05 to P < 0.01).The levels of CHE in the severe preeclampsia group, non-severe preeclampsia group, HDCP group and control group gradually increased in turn(P < 0.05 to P < 0.01).The levels of GGT and LDH in severe preeclampsia group, non-severe preeclampsia group, HDCP group and control group gradually decreased in turn(P < 0.05 to P < 0.01).The serum levels of CHE in HDCP patients was negatively correlated with the levels of SBP and DBP(P < 0.01), and the serum levels of GGT and LDH were positively correlated with the levels of SBP and DBP(P < 0.01).After controlling the age, prepregnancy body weight, gestational age and maternal type, the serum level of CHE was negatively correlated with the onset of preeclampsia(P < 0.01), and the levels of GGT and LDH were positively correlated with the onset of preeclampsia(P < 0.01).During follow-up to delivery, the expression of CHE in HDCP patients with adverse pregnancy outcome was lower than that in HDCP patients without adverse pregnancy outcome(P < 0.01), while the expression of GGT and LDH in HDCP patients with adverse pregnancy outcome were higher than that in HDCP patients without adverse pregnancy outcome(P < 0.01).The best cutoff values of CHE, GGT and LDH in predicting adverse pregnancy outcomes in HDCP patients were ≤ 2.83 kU/L, >32.16 U/L and>256.06 IU/L, respectively, and the areas under the curve were smaller than that in combined prediction. ConclusionsThe abnormal expression of serum CHE, GGT and LDH is an important influencing factor for the occurrence of preeclampsia, has a certain correlation with the degree of illness in HDCP patients, and the combination of the three is better in predicting adverse pregnancy outcomes in patients with HDCP. -
表 1 4组一般资料比较(x±s)
分组 n 年龄/岁 孕前体质量/kg 孕周/周 初产妇 经产妇 SBP/(mmol/L) DBP/(mmol/L) 对照组 68 26.89±3.43 54.32±5.64 38.08±0.93 43 25 136.53±7.51 87.29±6.84 HDCP组 25 27.28±3.16 54.57±5.28 38.21±0.79 16 9 142.21±8.04** 92.04±7.02** 不伴严重表现子痫前期组 34 27.47±2.86 54.76±5.92 38.42±0.91 23 11 147.05±8.63**△ 95.89±7.26**△ 伴严重表现子痫前期组 21 27.12±3.05 55.04±4.73 37.96±0.82 15 6 153.47±9.62**△△## 100.84±8.29**△△# F — 0.27 0.11 1.53 0.58□ 28.14 23.67 P — >0.05 >0.05 >0.05 >0.05 < 0.01 < 0.01 MS组内 — 10.305 30.586 0.790 — 66.936 51.606 □示χ2值。q检验:与对照组比较** P < 0.01;与HDCP组比较△P < 0.05,△△P0.01;与不伴严重表现子痫前期组比较#P < 0.05,##P < 0.01 表 2 4组血清CHE、GGT、LDH表达比较(x±s)
分组 n CHE/(kU/L) GGT/(U/L) LDH/(IU/L) 对照组 68 4.57±1.36 17.83±6.76 131.62±25.83 HDCP组 25 3.49±1.02** 24.52±9.24** 198.02±32.96** 不伴严重表现子痫前期组 34 3.15±0.83** 29.97±10.74**△ 235.94±36.58**△△ 伴严重表现子痫前期组 21 2.08±0.69**△△## 41.06±13.35**△△## 314.50±68.23**△△## F — 31.26 37.52 145.25 P — <0.01 <0.01 <0.01 MS组内 — 1.258 86.679 1 444.710 q检验:与对照组比较** P < 0.01;与HDCP组比较△P < 0.05,△△P < 0.01;与不伴严重表现子痫前期组比较##P < 0.01 表 3 HDCP病人血清各指标与血压水平的关系(r)
项目 CHE GGT LDH SBP -0.595** 0.618** 0.729** DBP -0.583** 0.604** 0.697** **P < 0.01 表 4 血清各指标与子痫前期发病关系的logistic回归分析
变量 B SE Waldχ2 P OR 95%CI CHE -0.954 0.324 8.663 <0.01 0.385 0.226~0.657 GGT 1.723 0.547 9.921 <0.01 5.601 3.562~8.806 LDH 1.555 0.468 11.047 <0.01 4.737 2.475~9.068 表 5 是否出现不良妊娠结局HDCP病人血清各指标表达比较(x±s)
分组 n CHE/(kU/L) GGT/(U/L) LDH/(IU/L) 出现不良妊娠结局 31 2.56±0.75 37.58±12.06 283.04±46.52 未出现不良妊娠结局 49 3.25±1.04 27.13±10.49 220.46±39.07 t — 3.20 4.10 6.48 P — < 0.01 < 0.01 < 0.01 表 6 血清各指标预测HDCP病人出现不良妊娠结局的ROC曲线分析
指标 AUC 95%CI P 截断值 敏感度/% 特异度/% CHE 0.766 0.658~0.854 <0.01 ≤2.83 kU/L 74.19 69.39 GGT 0.801 0.697~0.882 <0.01 >32.16 U/L 70.97 77.55 LDH 0.798 0.693~0.879 <0.01 >256.06 IU/L 70.97 79.59 各指标联合 0.891 0.801~0.949 0.01 — 83.87 85.71 -
[1] 胡蓉, 李笑天. 妊娠期高血压疾病降压的再认知及管理与子痫前期防范[J]. 中国实用妇科与产科杂志, 2018, 34(5): 24. [2] 许琦, 张颜秋, 王雁, 等. 妊娠中期胎盘生长因子水平与妊娠期高血压疾病风险的研究[J]. 中国妇产科临床杂志, 2019, 20(1): 34. [3] WANG W, FAM D, WANG J, et al. Association between hypertensive disorders complicating pregnancy and risk of placenta accreta: a meta-analysis and systematic review[J]. Hypert Pregn, 2018, 37(3): 168. doi: 10.1080/10641955.2018.1498880 [4] 王勇, 李发红, 韩娜, 等. 胎盘蛋白13促进妊娠期高血压疾病患者血管损伤修复的作用及机制研究[J]. 现代妇产科进展, 2018, 27(8): 589. [5] 聂星, 黄道超, 钟海英, 等. 肌肽对小鼠化学性肝损伤氧化应激和炎症因子的影响[J]. 免疫学杂志, 2018, 34(12): 1059. [6] 王桃桃. 胎盘中内脂素、网膜素表达与妊娠期高血压疾病相关性研究[D]. 昆明: 昆明医科大学, 2017. [7] 杨孜, 张为远. 妊娠期高血压疾病诊治指南(2020)[J]. 中华妇产科杂志, 2020, 55(4): 277. [8] 罗晓蕾, 王涛. 2019年ACOG妊娠期高血压疾病妇产科医师临床管理指南要点解读[J]. 实用妇产科杂志, 2019, 35(4): 259. [9] 刘怀昌, 肖磊, 徐智立, 等. 妊娠期高血压疾病对孕妇动脉弹性和血管内皮功能的影响[J]. 中华高血压杂志, 2019, 27(4): 372. [10] DAVE A, MARU L, JAIN A. LDH (Lactate dehydrogenase): a biochemical marker for the prediction of adverse outcomes in pre-eclampsia and eclampsia[J]. J Obstet Gynaecol India, 2016, 66(1): 23. doi: 10.1007/s13224-014-0645-x [11] KASRAEIAN M, ASADI N, VAFAEI H, et al. Evaluation of serum biomarkers for detection of preeclampsia severity in pregnant women[J]. Pak J Med Sci, 2018, 34(4): 869. [12] 陈大立, 柴利强, 彭兰, 等. 血清乳酸脱氢酶与子痫前期及妊娠不良结局的关系[J]. 国际妇产科学杂志, 2016, 43(4): 393. [13] BURWICK RM, MONICA R, BEERAKA SS, et al. Evaluation of hemolysis as a severe feature of preeclampsia[J]. Hypertension, 2018, 72(2): 460. doi: 10.1161/HYPERTENSIONAHA.118.11211 [14] 蒋利红, 施晓飞. 妊娠期高血压疾病孕妇的血清LDH水平及其对PE的预测价值[J]. 中国妇幼健康研究, 2018, 29(9): 1119. doi: 10.3969/j.issn.1673-5293.2018.09.013 [15] TRAN TT, AHN J, REAU NS. ACG clinical guideline: liver disease and pregnancy[J]. Am J Gastroenterol, 2016, 111(2): 176. doi: 10.1038/ajg.2015.430 [16] GRANGER JP, SPRADLEY FT, BAKRANIA BA. The endothelin system: a critical player in the pathophysiology of preeclampsia[J]. Curr Hypertens Rep, 2018, 20(4): 32. doi: 10.1007/s11906-018-0828-4 [17] 杨丽惠, 蒋晓红, 王龙, 等. 血清尿酸水平对新诊断2型糖尿病患者肌电图的影响[J]. 中国糖尿病杂志, 2017, 25(2): 103. [18] 舒琴, 李雨真, 张贵敏. 高血压患者血清γ-谷氨酰转移酶水平与冠状动脉病变程度的关系[J]. 中国心血管病研究, 2018, 16(11): 1000. doi: 10.3969/j.issn.1672-5301.2018.11.009 [19] DACAJ R, IZETBEGOVIC S, STOJKANOVIC G, et al. Elevated liver enzymes in cases of preeclampsia and intrauterine growth restriction[J]. Med Arch, 2016, 70(1): 44. doi: 10.5455/medarh.2016.70.44-47 [20] GOULOPOULOU S. Vascularendothelium: a potential source of podocalyxin in serum from pregnancies with preeclampsia[J]. J Hypertens, 2017, 35(11): 2176. doi: 10.1097/HJH.0000000000001468 [21] SEPČIĆK, SABOTIČ J, A OHM R, et al. First evidence of cholinesterase-like activity in Basidiomycota[J]. PLoS One, 2019, 14(4): e0216077. [22] 应萍, 吴朝勇, 夏桂玉. 重度子痫前期孕妇血清前白蛋白胆碱酯酶分析[J]. 浙江临床医学, 2016, 18(11): 2108. -




 下载:
下载: