-
肺癌是世界上癌症相关死亡的主要原因,其发病率和死亡率均居全球第一[1]。其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的80%~85%[2]。国家综合癌症指南(2018版)指出,NSCLC的淋巴结转移状态,对术式的选择、淋巴结清扫范围、是否需要新辅助化疗及疾病预后至关重要[3]。目前胸腔镜检查或超声引导下穿刺活检是评价NSCLC淋巴结转移的主要方法,结果较准确,但有创。无创且能有效评估NSCLC病人淋巴结状态的检查方法越来越受到临床的关注。近年来,影像组学在医学领域发展迅速,它可以反映关于肿瘤的生物学信息,并可以无创地提供关于诊断、预后评估和治疗反应预测的信息[4]。研究[5-8]表明,对于术前预测淋巴结转移,影像组学已经应用于头颈部癌、结直肠癌、胃癌等全身多个系统,然而,对预测肺癌淋巴结转移的报道较少。本研究旨在探讨CT影像组学在预测NSCLC病人淋巴结转移中的价值,并与传统临床危险因素和影像主观征象进行对比。
-
回顾性收集蚌埠医学院第一附属医院2018年10月至2020年8月经术后病理证实为NSCLC病人的临床及影像资料。纳入标准:(1)术后病理结果证实为NSCLC,伴或不伴淋巴结转移;(2)病人在术前2周内行胸部螺旋CT增强扫描;(3)CT检查前未经任何肿瘤治疗(放疗、化疗或靶向治疗)。排除标准:(1)病人术前2周内未接受CT增强检查;(2)无薄层CT图像;(3)病人有远处转移或合并其他恶性肿瘤。
最终共有143例病人纳入本研究,男102例,女41例,年龄(64.04±8.97)岁,其中鳞癌44例,腺癌99例。按照7∶3比例,分为训练组(共100例,其中有淋巴结转移34例,无淋巴结转移66例) 和验证组(共43例,其中有淋巴结转移14例,无淋巴结转移29例)。本研究经医院伦理委员会审核通过。
-
病人取仰卧位,采用GE 64排和GE Revolution 256排螺旋CT扫描仪行胸部增强扫描,扫描范围从肺尖到肺底,吸气后屏气完成整个肺部扫描。两台CT机扫描参数均保持一致:管电压140 kV,管电流240 mA,层厚5 mm,螺距为0.992∶1,窗宽400 Hu, 窗位40 Hu,重建层厚和层间距均为0.625 mm。通过肘静脉注入对比剂碘克沙醇(320 mg I/mL),速率为2.5 mL/s,剂量为60 mL,注入对比剂25 s、50 s后完成动脉期及静脉期图像采集。
-
由2名放射科医生(分别有5年和10年胸部阅片经验)在不了解病理结果的前提下,共同审阅CT图像,评价指标主要包括肿瘤最长径、毛刺征、空气支气管征、分叶征、胸膜凹陷征、血管集束征和空泡征,意见不一致时则咨询高年资医师(15年以上胸部诊断经验)后作出决定。
-
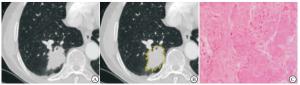
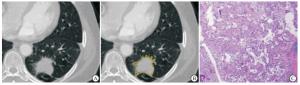
将静脉期CT增强图像导入“医准-达尔文”科研平台软件,选取肿瘤的最大横断面,由2名经验丰富的放射科医生手动分割感兴趣区(regions of interest, ROI),ROI包含肿瘤内的支气管、血管及空泡,不包括正常的肺组织(见图 1~2)。
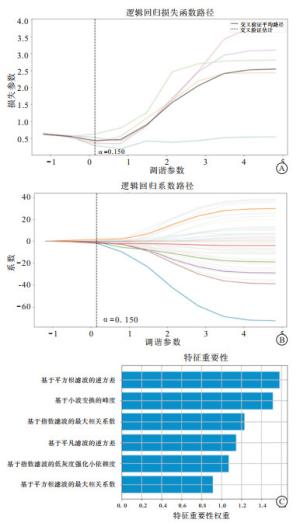
首先对数据指标进行标准化处理,以消除量纲与取值范围差异的影响,本研究采用“最小最大值归一化”,线性变换原始数据,将数据映射到[0, 1]之间,从而便于综合分析,使结果更加准确。然后利用Fisher确切概率法进行筛选,得到50个相关性较强的影像组学特征。最后通过最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)约束的逻辑回归对数据进行降维和筛选,最终得到6个最优影像组学特征(见图 3)。
-
本研究构建了两个模型,即影像组学预测模型和临床预测模型。使用具有径向基函数核的支持向量机(support vector machine, SVM)进行数据集的分类,并通过交叉验证的模型选择来评估根基函数SVM的超参数,从而得到了一个评估淋巴结转移效能的放射组学评分。肿瘤最长径和毛刺征作为输入变量,建立临床预测模型,在验证组进行验证。
-
采用χ2检验、t检验和Delong检验。
-
训练组和验证组有淋巴结转移病人的病灶最长径大于无淋巴结转移病人(P < 0.05),毛刺征发生比例高于无转移病人(P < 0.01和P < 0.05),其他特征在有无淋巴结转移病人之间差异均无统计学意义(P>0.05)(见表 1)。
特征 训练组(n = 100) 验证组(n = 43) 无淋巴结转移(n=66) 有淋巴结转移(n=34) χ2 P 无淋巴结转移(n=29) 有淋巴结转移(n=14) χ2 P 年龄(x±s)/岁 64.36±9.18 62.15±9.90 1.11* >0.05 65.28±7.82 64.57±8.04 0.27* >0.05 性别 男
女48(72.73)
18(27.27)24(70.59)
10(29.41)0.05 >0.05 20(68.97)
9(31.03)10(71.43)
4(28.57)0.00 >0.05 基础病 无
有38(57.58)
28(42.42)26(76.47)
8(23.53)3.48 >0.05 18(62.07)
11(37.93)8(57.14)
6(42.86)0.96 >0.05 吸烟史 无
有43(65.15)
23(34.85)17(50.00)
17(50.00)2.15 >0.05 21(72.41)
8(27.59)9(64.29)
5(35.71)0.30 >0.05 原发肿瘤病史 无
有60(90.91)
6(9.09)32(94.12)
2(5.88)0.03 >0.05 29(100.00)
0(0.00)12(85.71)
2(14.29)1.72 >0.05 病灶形态 圆形/类圆形
不规则3(4.55)
63(95.45)0(0.00)
34(100.00)0.41 >0.05 1(3.45)
28(96.55)0(0.00)
14(100.00)0.00 >0.05 分叶征 无
有2(3.03)
64(96.97)4(11.76)
30(88.24)1.68 >0.05 1(3.45)
28(96.55)0(0.00)
14(100.00)0.00 >0.05 毛刺征 无
有43(65.15)
23(34.85)13(38.23)
21(61.77)6.60 < 0.01 19(79.17)
10(20.83)4(21.05)
10(80.95)5.18 < 0.05 血管集束征 无
有61(92.42)
5(7.58)33(97.06)
1(2.94)0.23 >0.05 25(86.21)
4(13.79)13(92.86)
1(7.14)0.17 >0.05 胸膜凹陷征 无
有43(65.15)
23(34.85)26(76.47)
8(23.53)1.34 >0.05 18(62.07)
11(37.93)9(64.29)
5(35.71)0.20 >0.05 空洞/空泡征 无
有59(89.39)
7(10.61)29(85.29)
5(14.71)0.36 >0.05 23(79.31)
6(20.69)13(92.86)
1(7.14)0.47 >0.05 液化/坏死 无
有55(83.33)
11(16.67)29(85.29)
5(14.71)0.06 >0.05 26(89.66)
3(10.34)13(92.86)
1(7.14)0.00 >0.05 钙化 无
有60(90.91)
6(9.09)33(97.06)
1(2.94)0.53 >0.05 26(89.66)
3(10.34)14(100.00)
0(0.00)0.37 >0.05 病灶位置 上叶
中下叶30(45.45)
36(54.55)10(29.41)
24(70.59)2.41 >0.05 15(51.72)
14(48.28)11(78.57)
3(21.43)1.84 >0.05 *示t值 表 1 病人临床因素及CT征象统计学比较[n; 构成比(%)]
-
临床模型由病灶最长径和毛刺征组成,其回归方程为:P=1.074×毛刺征+0.442×最长径-2.501。通过比较预测值P(Predict)与约登指数的大小来判断淋巴结是否转移,当P值大于约登指数时,认为有淋巴结转移,反之无淋巴结转移,该模型的约登指数为0.26。
影像组学预测模型由6个最优影像组学特征组成,分别为:(1)灰度共生矩阵(GLCM)特征4个:基于平方根滤波的逆方差(squareroot-glcm-inverse variance, Squareroot-IV)、基于平方滤波的逆方差(square-glcm-inverse variance, Square-IV)、基于指数滤波的最大相关系数(exponential-MCC, E-MCC)、基于平方根滤波的最大相关系数(squareroot-MCC, S-MCC);(2)小波特征:基于小波变换的峰度(firstorder-kurtosis, FK);(3)灰度依赖矩阵:基于指数滤波的低灰度强化小依赖度(small dependence low gray level emphasis, SDLGLE)。放射组学评分,其公式为:RadScore =-1.578×(Squareroot-IV)-1.510×FK-1.228×(E-MCC)-1.145×(Square - IV)+1.069×SDLGLE-0.911×(S-MCC)+2.606。通过计算机调整惩罚系数后,得到最佳系数对应的放射组学评分界值为-7.475,当放射组学评分大于-7.475时,判定有淋巴结转移,反之,无淋巴结转移。
-
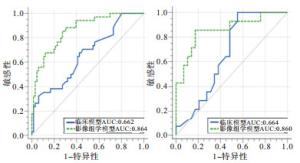
影像组学模型的ROC曲线下面积(AUC)高于临床模型(P < 0.01和P < 0.05)(见表 2、图 4)。
模型 训练组 验证组 AUC(95%CI) 准确度/% 敏感性/% 特异性/% AUC(95%CI) 准确度/% 敏感性/% 特异性/% 临床模型 0.662(0.561~0.754) 62.0 32.4 93.9 0.664(0.504~0.800) 60.0 100.0 44.8 影像组学模型 0.864(0.781~0.924) 79.0 85.3 72.7 0.860(0.720~0.946) 81.0 85.7 82.8 Z 4.36 2.03 P < 0.01 < 0.05 表 2 2种模型在训练组和验证组中的AUC、准确度、敏感性、特异性的比较
-
在精准诊断和精准治疗的大背景下,影像组学作为一种无创性的评估方法,对肺癌淋巴结转移状态的预测具有很大的应用前景[9]。本研究结果显示,对于NSCLC淋巴结转移的预测,影像组学模型在训练组和验证组中的AUC分别为0.864、0.860,显著高于临床模型,这与CONG等[10]研究结果相似。在构成影像组学模型的6个影像组学特征中,我们发现这些特征值与NSCLC淋巴结转移状态之间均表现出一定的相关性,FK、SDLGLE值越大,E-MCC、S-MCC、Squareroot-IV、Square-IV值越小,肿瘤发生淋巴结转移的可能性越大。本研究还发现,在临床模型中,肿瘤最长径和毛刺征是预测NSCLC病人淋巴结转移的独立预测因子,随着肿瘤直径的增大,以及肺癌毛刺征的形成,淋巴结转移的概率增大,这与以往的研究报道[11-12]结果一致。病灶最长径和毛刺征反映了肺癌向邻近结构浸润的生物学行为,即小血管、小淋巴管以及小支气管受累,造成这些结构的堵塞或癌细胞沿着这些管道生长,或者沿小叶间隔生长,从而造成淋巴结转移的概率的增大。虽然肿瘤最长径和肺癌毛刺征是肿瘤侵袭性及预后不良的重要特征,但是二者作为形态学特征,在定性方面受主观因素的影响较大,而影像组学通过高通量提取病灶内的信息,挖掘肉眼无法发现的隐藏信息,且对数据进行量化,规避了观察者主观判断的偏差[13],因此在本研究中,影像组学预测模型的效能明显高于临床模型。
本研究与ZHONG等[14]研究的不同之处在于,本研究同时纳入肺鳞癌和肺腺癌,因为不同组织学类型的NSCLC,其淋巴结转移的概率亦不相同。相比于肺鳞癌,肺腺癌更容易发生纵膈、肺门及肺内淋巴结转移[15],将二者同时纳入研究,其预测结果更为全面、客观、准确。一些研究[16-17]试图使用CT纹理分析来区分肺癌中的恶性和良性淋巴结。然而,这些研究只分析较大的淋巴结,不能区分正常大小和隐匿的淋巴结转移。本研究的创新之处在于通过对原发病灶的特征分析来预测淋巴结转移的可能性,因为原发病灶反映了病变的病理特征,如肿瘤缺氧和血管生成等[18]。动脉期时相病灶容易受邻近大血管内的高浓度造影剂影响,产生干扰伪影,并且肿瘤组织在动脉期血流灌注不同,强化程度不一,其密度也不均匀,而静脉期随着血流的廓清,病灶密度趋于均匀,更有利于影像组学特征的提取,故本研究选择静脉期CT增强图像构建影像组学预测模型。
本研究存在一定的局限性。首先,这是一项回顾性研究,存在一定的偏倚;其次,这是一个单中心样本,缺乏多中心的外部验证;最后,本研究未能提取肿瘤的三维影像组学特征。
总之,本研究基于静脉期CT增强图像提取的影像组学特征,是术前NSCLC淋巴结转移的有力预测因子,有望为非小细胞肺癌病人的临床诊断及治疗决策提供重要参考价值。
CT影像组学在预测非小细胞肺癌淋巴结转移中的价值
The value of CT radiomics in the prediction of lymph node metastasis in non-small cell lung cancer
-
摘要:
目的探讨基于胸部CT影像组学在术前预测非小细胞肺癌淋巴结转移中的价值。 方法回顾性分析经术后病理证实的143例非小细胞肺癌病人临床、胸部CT增强影像资料。按照7:3比例,随机分为训练组(n=100)和验证组(n=43)。在静脉期图像上提取肿瘤的影像组学特征,采用最小绝对收缩选择算子(LASSO)逻辑回归用于数据降维、特征筛选。分别基于影像组学特征和临床-影像特征(最大径、毛刺征)构建预测模型。采用受试者工作特征曲线(ROC)的曲线下面积(AUC)评价不同模型的鉴别预测效能,并对模型的ROC曲线行Delong检验;在验证组中评估其预测效能。 结果共提取939个影像组学特征,经筛选最终得到6个最优特征并建立影像组学预测模型。对于术前预测淋巴结转移的效能,在训练组中,影像组学模型AUC为0.864(95%CI:0.781~0.924),大于临床模型的AUC为0.662(95%CI:0.561~0.754)(P < 0.01);在验证组中,影像组学模型AUC为0.860(95%CI:0.720~0.964),大于临床模型的AUC为0.664(95%CI:0.504~0.880)(P < 0.05)。 结论基于胸部CT增强图像提取影像组学特征及其构建的预测模型,影像组学模型的效能高于临床模型,可以作为一种预测非小细胞癌病人淋巴结是否转移的辅助工具,具有良好的临床应用前景。 Abstract:ObjectiveTo explore the value of chest enhanced CT radiomics in the prediction of lymph node metastasis in patients with non-small cell lung cancer(NSCLC). MethodsThe clinical and chest enhanced CT data of 143 NSCLC patients confirmed by pathologically were retrospectively analyzed.The patients were randomly divided into the training group(n=100) and verification group(n=43) according to the ratio of 7:3.The venous phase images were used to extract the radiomics features.The least absolute shrinkage and selection operator(LASSO) logistic regression was used for data dimension reduction and feature selection.Two predictive models were constructed using the radiomics features and clinical-imaging characteristics(the maximum meridian and burr sign).The AUCs of ROC was used to evaluate the predictive effectiveness of model.The ROC curve of model was tested by Delong test.The predictive efficacy was evaluated in validation group. ResultsA total of 939 radiomics features were extracted, 6 optimal features were finally selected, and the prediction model was established.In the training group, the AUC of the radiomics model was 0.864(95%CI: 0.781~0.924), which was higher than that of the clinical model[0.662 (95%CI: 0.561~0.754)](P < 0.01).In the validation group, the AUC of the radiomics model was 0.860(95%CI: 0.720~0.964), which was greater than that of the clinical model[(0.664 (95%CI: 0.504~0.880)](P < 0.05). ConclusionsBased on the image omics features extracted from the chest CT enhanced images and constructing the prediction model, the efficacy of the radiomics model was higher than that of the clinical model.The CT radiomics can be used as an auxiliary tool to predict lymph node metastasis in patients with non-small cell cancer, which has a good clinical application prospect. -
Key words:
- radiomics /
- non-small cell lung cancer /
- lymph node metastasis
-
表 1 病人临床因素及CT征象统计学比较[n; 构成比(%)]
特征 训练组(n = 100) 验证组(n = 43) 无淋巴结转移(n=66) 有淋巴结转移(n=34) χ2 P 无淋巴结转移(n=29) 有淋巴结转移(n=14) χ2 P 年龄(x±s)/岁 64.36±9.18 62.15±9.90 1.11* >0.05 65.28±7.82 64.57±8.04 0.27* >0.05 性别 男
女48(72.73)
18(27.27)24(70.59)
10(29.41)0.05 >0.05 20(68.97)
9(31.03)10(71.43)
4(28.57)0.00 >0.05 基础病 无
有38(57.58)
28(42.42)26(76.47)
8(23.53)3.48 >0.05 18(62.07)
11(37.93)8(57.14)
6(42.86)0.96 >0.05 吸烟史 无
有43(65.15)
23(34.85)17(50.00)
17(50.00)2.15 >0.05 21(72.41)
8(27.59)9(64.29)
5(35.71)0.30 >0.05 原发肿瘤病史 无
有60(90.91)
6(9.09)32(94.12)
2(5.88)0.03 >0.05 29(100.00)
0(0.00)12(85.71)
2(14.29)1.72 >0.05 病灶形态 圆形/类圆形
不规则3(4.55)
63(95.45)0(0.00)
34(100.00)0.41 >0.05 1(3.45)
28(96.55)0(0.00)
14(100.00)0.00 >0.05 分叶征 无
有2(3.03)
64(96.97)4(11.76)
30(88.24)1.68 >0.05 1(3.45)
28(96.55)0(0.00)
14(100.00)0.00 >0.05 毛刺征 无
有43(65.15)
23(34.85)13(38.23)
21(61.77)6.60 < 0.01 19(79.17)
10(20.83)4(21.05)
10(80.95)5.18 < 0.05 血管集束征 无
有61(92.42)
5(7.58)33(97.06)
1(2.94)0.23 >0.05 25(86.21)
4(13.79)13(92.86)
1(7.14)0.17 >0.05 胸膜凹陷征 无
有43(65.15)
23(34.85)26(76.47)
8(23.53)1.34 >0.05 18(62.07)
11(37.93)9(64.29)
5(35.71)0.20 >0.05 空洞/空泡征 无
有59(89.39)
7(10.61)29(85.29)
5(14.71)0.36 >0.05 23(79.31)
6(20.69)13(92.86)
1(7.14)0.47 >0.05 液化/坏死 无
有55(83.33)
11(16.67)29(85.29)
5(14.71)0.06 >0.05 26(89.66)
3(10.34)13(92.86)
1(7.14)0.00 >0.05 钙化 无
有60(90.91)
6(9.09)33(97.06)
1(2.94)0.53 >0.05 26(89.66)
3(10.34)14(100.00)
0(0.00)0.37 >0.05 病灶位置 上叶
中下叶30(45.45)
36(54.55)10(29.41)
24(70.59)2.41 >0.05 15(51.72)
14(48.28)11(78.57)
3(21.43)1.84 >0.05 *示t值 表 2 2种模型在训练组和验证组中的AUC、准确度、敏感性、特异性的比较
模型 训练组 验证组 AUC(95%CI) 准确度/% 敏感性/% 特异性/% AUC(95%CI) 准确度/% 敏感性/% 特异性/% 临床模型 0.662(0.561~0.754) 62.0 32.4 93.9 0.664(0.504~0.800) 60.0 100.0 44.8 影像组学模型 0.864(0.781~0.924) 79.0 85.3 72.7 0.860(0.720~0.946) 81.0 85.7 82.8 Z 4.36 2.03 P < 0.01 < 0.05 -
[1] XIE Y, ZHAO H, GUO Y, et al. A PET/CT nomogram incorporating SUVmax and CT radiomics for preoperative nodal staging in non-small cell lung cancer[J]. Eur Radiol, 2021, 31(8): 6030. doi: 10.1007/s00330-020-07624-9 [2] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7. doi: 10.3322/caac.21332 [3] ETTINGER DS, WOOD DE, AISNER DL, et al. Non-small cell lung cancer, version 5.2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2017, 15(4): 504. doi: 10.6004/jnccn.2017.0050 [4] HUANG Y, LIU Z, HE L, et al. Radiomics signature: a potential biomarker for the prediction of disease-free survival in early-stage (Ⅰ or Ⅱ) non-small cell lung cancer[J]. Radiology, 2016, 281(3): 947. doi: 10.1148/radiol.2016152234 [5] LIU T, ZHOU S, YU J, et al. Prediction of lymph node metastasis in patients with papillary thyroid carcinoma: a radiomics method based on preoperative ultrasound images[J]. Technol Cancer Res Treat, 2019, 18: 1. [6] 贾传亮, 曹嫒, 宋晴, 等. 基于MR的影像组学列线图预测喉癌颈淋巴结转移的临床价值[J]. 中华耳鼻咽喉头颈外科杂志, 2020, 55(12): 1154. doi: 10.3760/cma.j.cn115330-20200719-00604 [7] LI M, ZHANG J, DAN Y, et al. A clinical-radiomics nomogram for the preoperative prediction of lymph node metastasis in colorectal cancer[J]. J Transl Med, 2020, 18(1): 46. doi: 10.1186/s12967-020-02215-0 [8] 王小雷, 高玉青, 徐鹤, 等. 基于能谱CT纹理分析在预测胃癌术前淋巴结转移中的价值[J]. 蚌埠医学院学报, 2021, 46(1): 21. [9] THAWANI R, MCLANCE M, BEIG N, et al. Radiomics and radiogenomics in lung cancer: a review for the clinician[J]. Lung Cancer, 2018, 115: 34. doi: 10.1016/j.lungcan.2017.10.015 [10] CONG M, YAO H, LIU H, et al. Development and evaluation of a venous computed tomography radiomics model to predict lymph node metastasis from non-small cell lung cancer[J]. Medicine (Baltimore), 2020, 99(18): e20074. doi: 10.1097/MD.0000000000020074 [11] YANG G, NIE P, ZHAO L, et al. 2D and 3D texture analysis to predict lymph ovascular invasion in lung adenocarcinoma[J]. Eur J Radiol, 2020, 129: 109111. doi: 10.1016/j.ejrad.2020.109111 [12] DENG HY, ZENG M, LI G, et al. Lung adenocarcinoma has a higher risk of lymph node metastasis than Squamous cell carcinoma: a propensity score-matched analysis[J]. World J Surg, 2019, 43(3): 955. doi: 10.1007/s00268-018-4848-7 [13] 王敏, 宋彬, 黄子星, 等. 大数据时代的精准影像医学: 放射组学[J]. 中国普外基础与临床杂志, 2016, 23(6): 752. [14] ZHONG Y, YUN M, ZHANG T, et al. Radiomics approach to prediction of occult mediastinal lymph node metastasis of lung adenocarcinoma[J]. AJR Am J Roentgenol, 2018, 211(1): 109. doi: 10.2214/AJR.17.19074 [15] LIU Y, KIM J, BALAGURUNATHAN Y, et al. Prediction of pathological nodal involvement by CT-based radiomics features of the primary tumor in patients with clinically node-negative peripheral lung adenocarcinomas[J]. Med Phys, 2018, 45(6): 2518. doi: 10.1002/mp.12901 [16] PHAN TD, WATANABE Y, HIGUCHI M, et al. Texture analysis and synthesis of malignant and benign mediastinal lymph nodes in patients with lung cancer on computed tomography[J]. Sci Rep, 2017, 1(1): 43209. [17] ANDERSEN MB, HARDERS SW, GANESHAN B, et al. CT texture analysis can help differentiate between malignant and benign lymph nodes in the mediastinum in patients suspected for lung cancer[J]. Acta Radiol, 2016, 57(6): 669. doi: 10.1177/0284185115598808 [18] YANG X, PAN X, LIU H, et al. A new approach to predict lymph node metastasis in solid lung adenocarcinoma: a radiomics nomogram[J]. J Thorac Dis, 2018, 10(Suppl 7): S807. -




 下载:
下载: