-
胆囊癌是一种发生在胆囊组织的恶性肿瘤,其发病率在我国消化道肿瘤高居第五[1]。胆囊癌早期临床症状不明显,诊断困难,且由于其恶性程度高、病情发展迅速、预后差等特点,使胆囊癌病人的死亡率较高,五年生存率不足5%[2-3]。近年黏蛋白(mucin,MUC)对于肿瘤的影响逐渐得到学术界的重视[4]。MUC是一种通过上皮细胞分泌,具有单次跨膜结构的高度糖基化蛋白,在信号转导通路、免疫应答等生理病理过程中均具有一定调控作用[5]。MUC16基因位于染色体19p13.2位点,是卵巢癌的特异性诊断标志物之一。但当前关于胆囊癌细胞与MUC16间相互作用的研究仍不深入。本文采用RNA干扰技术观察MUC16对人胆囊癌细胞GBC-SD增殖和迁移的影响,探讨其可能的作用机制,以期为后续研究提供参考。现作报道。
-
人胆囊癌GBC-SD细胞(中科院上海分院细胞所细胞库);胎牛血清、DMEM培养基(美国GIBICO公司);pGMLV-SC1 RNAi慢病毒载体(上海前尘生物公司);PCR试剂primer(生工生物工程上海有限公司);Matrigel胶(美国BD公司);96孔板和CCK-8(美国Corning公司);奥林巴斯IX71/81型倒置显微镜(日本奥林巴斯公司)。
-
采用慢病毒感染GBC-SD细胞中MUC16(GBC-SD+MUC16-siRNA组),同时设立阴性对照组(GBC-SD+NC组)及空白对照组(GBC-SD组)。采用RT-PCR、Western blotting法鉴定siRNA MUC16基因沉默效果,采用Western blotting法检测GBC-SD细胞中增殖细胞核抗原(PCNA)和CD44蛋白表达情况。
-
引物由上海生物工程科技有限公司合成,根据基因库,设计并合成3个siRNA质粒沉默胆囊癌细胞GBC-SD。插入序列如下:MUC16siRNA1:AAA GCC ACA TCA CCA ATG TTT;MUC16siRNA2:ACA GCA GCA TCA AGA GTT ATT;MUC16siRNA3:AAA CCT CAC CAT CTG TAA CTT;对照序列为GGA ATC TCA TTC GAT GCA TAC。抽提总RNA,逆转录cDNA后进行RT-PCR对数据进行分析,siRNA1、siRNA2和siRNA3的相对表达水平分别为0.74±0.15、0.59±0.11和0.41±0.24,其中siRNA3当选为最高效序列,遂进行后续实验。
-
GBC-SD细胞经48 h培养后,取出培养板,加入DMEM培养液150 μL,避光孵育4 h后吸取100 μL培养液与150 μL二甲亚砜溶液振荡10 min。搁至紫色结晶物完全融解,使用酶标仪在570 nm波长下测得每孔吸光度(重复测量3次后取平均值)A值,设定GBC-SD组中的细胞活力为100%,计算各组细胞增殖率。细胞增殖率=(实验组A值-空白孔组A值)/(对照组A值-空白孔组A值)×100%。
-
采用胎牛血清(10%)培养基配制单细胞悬液,接种于96孔板(每孔5×105个细胞)后培养24 h。待细胞密度达到80%,以200 μL灭菌枪头划线,使用PBS将划痕内残存细胞洗净后转入空白培养基,使用电子显微镜于0 h和48 h拍照并观察迁移细胞数。
-
采用方差分析和LSD-t检验。
-
GBC-SD+MUC16-siRNA组MUC16 mRNA表达水平均明显低于GBC-SD组和GBC-SD+NC组(P<0.01),GBC-SD+NC组和GBC-SD组MUC16 mRNA表达差异无统计学意义(P>0.05)(见表 1)。
分组 MUC16 mRNA GBC-SD组 0.62±0.09 GBC-SD+NC组 0.59±0.09 GBC-SD+MUC16-siRNA组 0.40±0.07**## F 11.14 P <0.01 MS组内 0.007 q检验:与GBC-SD组比较**P<0.01;与GBC-SD+NC组比较##P<0.01 表 1 3组细胞中MUC16 mRNA相对表达水平比较(n=6;x±s)
-
GBC-SD+MUC16-siRNA组细胞增殖率低于GBC-SD组(P<0.05),而GBC-SD+MUC16-siRNA组、GBC-SD组和GBC-SD+NC组细胞增殖率差异均无统计学意义(P>0.05)(见表 2)。
分组 增值率/% GBC-SD组 76.37±15.01 GBC-SD+NC组 74.78±14.86 GBC-SD+MUC16-siRNA组 55.32±10.73* F 4.41 P <0.05 MS组内 187.084 q检验:与GBC-SD+NC组比较*P<0.05 表 2 3组GBC-SD细胞增殖率比较(n=6;x±s)
-
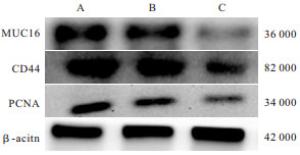
培养48 h后,GBC-SD+MUC16-siRNA组GBC-SD细胞迁移数均低于GBC-SD组和GBC-SD+NC组(P<0.05),GBC-SD+NC组与GBC-SD组差异无统计学意义(P>0.05)(见图 1、表 3)。
分组 迁移数目/(×104) GBC-SD组 9.12±1.56 GBC-SD+NC组 8.92±1.38 GBC-SD+MUC16-siRNA 3.68±0.70*# F 35.48 P <0.01 MS组内 1.609 q检验:与GBC-SD组比较*P<0.05;与GBC-SD+NC组比较#P<0.05 表 3 3组GBC-SD细胞迁移数目比较(n=6;x±s)
-
GBC-SD+MUC16-siRNA组MUC16、CD44蛋白表达均低于GBC-SD组、GBC-SD+NC组(P<0.05~P<0.01),PCNA蛋白表达亦低于GBC-SD+NC组(P<0.05),GBC-SD组和GBC-SD+NC组MUC16、PCNA、CD44蛋白表达差异均无统计学意义(P>0.05)(见表 4、图 2)。
分组 MUC16 PCNA CD44 GBC-SD组 0.87±0.22 0.81±0.25 0.78±0.22 GBC-SD+NC组 0.84±0.18 0.79±0.21 0.74±0.21 GBC-SD+MUC16-siRNA组 0.46±0.17*## 0.48±0.19# 0.41±0.16**## F 8.57 4.31 6.28 P <0.01 <0.05 <0.01 MS组内 0.037 0.048 0.039 q检验:与GBC-SD组比较*P<0.05;与GBC-SD+NC组比较#P<0.05,##P<0.01 表 4 3组MUC16、PCNA、CD44蛋白表达比较(n=6;x±s)
-
胆囊癌属于高恶性程度消化道肿瘤,发病率、死亡率高。调查[5]显示,我国胆囊癌病人5年生存率不足5%,中位生存时间仅为半年。胆囊癌的发生、发展影响因素较多,但具体机制尚不明确。本文采用RNA干扰技术对MUC16对人胆囊癌细胞GBC-SD增殖、迁移的影响以及可能作用机制进行探讨。
近年发现MUC在癌变细胞中多存在表达异常现象。研究[6]表明,MUC16在正常卵巢上皮细胞中基本不表达,但卵巢癌细胞有异常的高表达现象,基于此项特点广泛应用于卵巢癌的早期诊断。近期还有研究指出MUC16与胃癌[7]、肝外胆管癌[8]的发生发展也有密切的关系。国外研究[9]显示,MUC16在人体正常肝脏组织和肝内胆管组织不表达,但在肝外胆管癌细胞中有高表达现象,提示MUC16很可能与肝胆癌变有关。段海章等[10-11]研究发现MUC16的阳性表达可能促进胆囊癌的发生发展,具有成为胆囊癌肿瘤标志物的可能性,并且可以在一定程度上预示胆囊癌的恶性及浸润程度[12-13]。
PCNA是一种真核细胞DNA合成必需的核蛋白,通过影响DNA聚合酶参与调节DNA合成,与细胞的增殖周期密切相关[14]。研究[15]显示,PCNA可以促进肿瘤细胞的快速增殖,参与肿瘤组织的浸润与转移,其表达量与肿瘤细胞增殖及分化能力密切相关。PCNA还可在缺氧状态下间接促进肿瘤病灶血管生成。因此,PCNA阳性表达程度是评估肿瘤细胞增殖状态和评价肿瘤恶性潜能的重要指标[16]。本研究显示,沉默MUC16能够下调细胞中PCNA表达,推测胆囊癌细胞增殖与此有一定关联。
CD44是一种表面跨膜糖蛋白,也是一种表面黏附分子,广泛参与细胞间、细胞与胞外基质之间的特异性黏附过程[17]。近年有研究[18]显示,CD44在三阴性乳腺癌、前列腺癌、胰腺癌等多种恶性肿瘤中出现了异常的高表达,并参与肿瘤发生、发展、浸润转移。本课题组发现沉默MUC16可下调人胆囊癌细胞CD44表达水平,推测胆囊癌细胞迁移与此有一定关联。
综上所述,siRNA沉默MUC16可显著抑制胆囊癌细胞增殖与迁移,通过调控PCNA、CD44蛋白实验,表明MUC16参与胆囊癌的发生发展,对胆囊癌的靶向治疗有一定的参考价值,但MUC16参与胆囊癌的具体作用机制目前尚不清楚,是否还通过其他途径发挥作用也有待进一步深入探讨。
siRNA沉默MUC16对胆囊癌细胞增殖和迁移的影响
Effect of siRNA silencing MUC16 on the proliferation and migration of gallbladder carcinoma cells
-
摘要:
目的探讨siRNA沉默黏蛋白(mucin,MUC)16基因对人胆囊癌细胞(GBC-SD)增殖和迁移的影响及其分子机制。 方法采用慢病毒感染和siRNA干扰技术沉默GBC-SD中MUC16基因(GBC-SD+MUC16-siRNA组),同时设立阴性对照组(GBC-SD+NC组)和空白对照组(GBC-SD组)。RT-PCR检测各组GBC-SD细胞中MUC16表达情况,噻唑蓝实验检测GBC-SD细胞增殖能力,划痕实验检测GBC-SD细胞迁移能力,蛋白免疫印迹实验检测GBC-SD细胞中PCNA和CD44蛋白表达情况。 结果GBC-SD+MUC16-siRNA组细胞增殖率和细胞迁移数目均低于GBC-SD组(P < 0.05);GBC-SD+MUC16-siRNA组MUC16、CD44蛋白表达均低于GBC-SD组、GBC-SD+NC组(P < 0.05~P < 0.01),PCNA蛋白表达亦低于GBC-SD+NC组(P < 0.05)。 结论siRNA沉默MUC16具有一定的抑制胆囊癌细胞增殖和迁移作用,可为胆囊癌的治疗提供新的实验证据。 Abstract:ObjectiveTo explore the effects of siRNA silencing mucin 16(MUC16) on the proliferation and migration of gallbladder carcinoma GBC-SD cells, and its molecular mechanisms. MethodsThe GBC-SD+MUC16-siRNA group was constructed using the lentivirus infection and siRNA interference technique to silence MUC16 gene in GBC-SD cells, and the negative control group(GBC-SD+NC group) and blank control group(GBC-SD group) were set up simultaneously.The RT-PCR was used to detect the expression of MUC16 in GBC-SD cells, the MTT and scratch assays were used to detect the proliferation and migration ability of GBC-SD cells, and the Western blotting was used to detect the protein expressions of CD44 and PCNA in GBC-SD cells. ResultsThe cell proliferation rate and cell migration number in GBC-SD+MUC16-SiRNA group were lower than those in GBC-SD group(P < 0.05).The expression levels of MUC16 and CD44 protein in GBC-SD+MUC16-SIRNA group were lower than those in GBC-SD group and GBC-SD+NC group(P < 0.05 to P < 0.01), and the expression level of PCNA protein in GBC-SD+MUC16-SIRNA group was also lower than that in GBC-SD+NC group(P < 0.05). ConclusionsSiRNA silencing MUC16 can inhibit the proliferation and migration of gallbladder cancer cells, which may provide the new experimental evidence for the treatment of gallbladder cancer. -
Key words:
- gallbladder neoplasms /
- mucin /
- cell proliferation /
- cell migration
-
表 1 3组细胞中MUC16 mRNA相对表达水平比较(n=6;x±s)
分组 MUC16 mRNA GBC-SD组 0.62±0.09 GBC-SD+NC组 0.59±0.09 GBC-SD+MUC16-siRNA组 0.40±0.07**## F 11.14 P <0.01 MS组内 0.007 q检验:与GBC-SD组比较**P<0.01;与GBC-SD+NC组比较##P<0.01 表 2 3组GBC-SD细胞增殖率比较(n=6;x±s)
分组 增值率/% GBC-SD组 76.37±15.01 GBC-SD+NC组 74.78±14.86 GBC-SD+MUC16-siRNA组 55.32±10.73* F 4.41 P <0.05 MS组内 187.084 q检验:与GBC-SD+NC组比较*P<0.05 表 3 3组GBC-SD细胞迁移数目比较(n=6;x±s)
分组 迁移数目/(×104) GBC-SD组 9.12±1.56 GBC-SD+NC组 8.92±1.38 GBC-SD+MUC16-siRNA 3.68±0.70*# F 35.48 P <0.01 MS组内 1.609 q检验:与GBC-SD组比较*P<0.05;与GBC-SD+NC组比较#P<0.05 表 4 3组MUC16、PCNA、CD44蛋白表达比较(n=6;x±s)
分组 MUC16 PCNA CD44 GBC-SD组 0.87±0.22 0.81±0.25 0.78±0.22 GBC-SD+NC组 0.84±0.18 0.79±0.21 0.74±0.21 GBC-SD+MUC16-siRNA组 0.46±0.17*## 0.48±0.19# 0.41±0.16**## F 8.57 4.31 6.28 P <0.01 <0.05 <0.01 MS组内 0.037 0.048 0.039 q检验:与GBC-SD组比较*P<0.05;与GBC-SD+NC组比较#P<0.05,##P<0.01 -
[1] NARAYAN RR, CREASY JM, GOLDMAN DA, et al. Regional differences in gallbladder cancer pathogenesis: Insights from a multi-institutional comparison of tumor mutations[J]. Cancer, 2019, 125(4): 575. doi: 10.1002/cncr.31850 [2] SUN LJ, GUAN A, XU WY, et al. γ-glutamyl transferase-to-platelet ratio based nomogram predicting overall survival of gallbladder carcinoma[J]. World J Gastrointest Oncol, 2020, 12(9): 1014. doi: 10.4251/wjgo.v12.i9.1014 [3] CHA SY, KIM YK, MIN JH, et al. Usefulness of noncontrast MRI in differentiation between gallbladder carcinoma and benign conditions manifesting as focal mild wall thickening[J]. Clin Imaging, 2019, 54(2): 63. [4] DELAVERIS CS, WEBSTER ER, BANIK SM, et al. Membrane-tethered mucin-like polypeptides sterically inhibit binding and slow fusion kinetics of influenza A virus[J]. Proc Natl Acad Sci U S A, 2020, 117(23): 12643. doi: 10.1073/pnas.1921962117 [5] PINZON MARTIN SANDRA, SEEBERGER PETER H, VARONarón Silva Daniel, Mucins and Pathogenic Mucin-Like Molecules Are Immunomodulators During Infection and Targets for Diagnostics and Vaccines[J]. Front Chem, 2019, 7(8): 710. [6] CRAWFORD A, HABER L, VAZZANA K, et al. Abstract 1777: REGN4018, a novel MUC16xCD3 bispecific T-cell engager for the treatment of ovarian cancer[J]. Cancer Res, 2018, 78(13 Supplement): 1777. [7] ZHAO HJ, ZHANG L. MUC16 mutation predicts a favorable clinical outcome and correlates decreased Warburg effect in gastric cancer[J]. Biochem Biophys Res Commun, 2018, 506(4): 780. doi: 10.1016/j.bbrc.2018.10.156 [8] ZHANG FB, ZHANG AM, ZHANG ZB, et al. Preoperative differential diagnosis between intrahepatic biliary cystadenoma and cystadenocarcinoma: a single-center experience[J]. World J Gastroenterol, 2014, 20(35): 12595. doi: 10.3748/wjg.v20.i35.12595 [9] HIGASHI M, YAMADA N, YOKOYAMA S, et al. Pathobiological implications of MUC16/CA125 expression in intrahepatic cholangiocarcinoma-mass forming type[J]. Pathobiology, 2012, 79(2): 101. doi: 10.1159/000335164 [10] 段海章, 李凡, 孙岩. 黏蛋白在胆管癌中的研究进展[J]. 现代肿瘤医学, 2015, 23(22): 3357. [11] 段海章, 陈进忠, 石岩, 等. MUC1和MUC16在胆囊癌中的表达及临床意义[J]. 现代肿瘤医学, 2018, 26(18): 77. [12] FAN K, WANG JW, SUN WT, et al. MUC16 C-terminal binding with ALDOC disrupts the ability of ALDOC to sense glucose and promotes gallbladder carcinoma growth[J]. Exp Cell Res, 2020, 394(1): 112118. doi: 10.1016/j.yexcr.2020.112118 [13] 刘畅, 张珉, 田兴. MUC16对胆囊癌细胞生物学行为的调控作用及机制分析[J]. 肿瘤学杂志, 2019, 25(5): 436. [14] LU EM, RATNAYAKE J, RICH AM. Assessment of proliferating cell nuclear antigen (PCNA) expression at the invading front of oral squamous cell carcinoma[J]. BMC Oral Health, 2019, 19(1): 233. doi: 10.1186/s12903-019-0928-9 [15] 王阳, 胡跃世, 李征, 等. miR-124在膀胱癌中的表达及其临床意义[J]. 第三军医大学学报, 2020, 42(10): 78. [16] HARA K, UCHIDA M, TAGATA R, et al. Structure of proliferating cell nuclear antigen (PCNA) bound to an APIM peptide reveals the universality of PCNA interaction[J]. Acta Crystallogr F Struct Biol Commun, 2018, 74(Pt 4): 214. [17] SPEISER P, WANNER C, TEMPFER C, et al. CD44 is an independent prognostic factor in early-stage cervical cancer. [J]. Int J Cancer, 2015, 74(2): 185. [18] ZHOU F, ZHANG YH, SUN JH, et al. Characteristics of a novel cell line ZJU-0430 established from human gallbladder carcinoma[J]. Cancer Cell Int, 2019, 19(5): 190. -





 下载:
下载: