-
乳腺癌是最常见的恶性肿瘤之一,其发病率位于女性恶性肿瘤首位[1],其中最常见的是浸润性导管癌。近年来,虽然乳腺癌的综合治疗有了较大的进展,但其侵袭性生长和转移仍然是导致病人死亡的重要原因之一。HMGB1于1973年由Ernest Johns在牛胸腺细胞中发现,根据该蛋白在聚丙烯酰胺凝胶中的高迁移率的特性从而命名为“high-mobility group”(HMG)proteins[2-3]。HMGB1分布广泛, 在肝、心、脾、肺、肾及淋巴组织都有发现, 除肝、脑组织主要存在于细胞外, 在大多数组织HMGB1存在于细胞核内[4]。HMGB1是一种真核生物细胞内的非组蛋白染色体结合蛋白,在多种生物学过程中均发挥重要作用,如在细胞核内,HMGB1参与转录调控、DNA重组和修复、维持和稳定核小体结构,而在细胞核外其参与免疫反应、细胞分化、增殖、迁移等[5-6]。有研究[7]表明,肿瘤进展和迁移的重要过程之一是细胞外基质被基质金属蛋白酶降解的过程,而HMGB1能够结合纤溶酶原系统,提高基质金属蛋白酶活性,从而加速肿瘤细胞的进展和迁移。同时,HMGB1与多种恶性肿瘤的发生发展密切相关,可影响肿瘤细胞增殖、侵袭和转移[8-9]。然而,HMGB1的表达水平在不同类型肿瘤组织中存在差异,且发挥的作用也不同。
乳腺癌的发生与发展是由多个因子参与的复杂过程,病人因其死亡的主要原因是复发和转移造成临近器官组织和全身各系统的变化。因此,采取合适的方式阻止乳腺癌的复发和转移将会给病人带来极大的价值。HMGB1在乳腺癌中的研究报道少见,我们对139例女性乳腺浸润性导管癌病人术后组织的HMGB1表达进行了检测,并观察其亚细胞定位情况,分析了其与预后的关系,现作报道。
-
收集2012年1月至2014年6月我院收治的139例女性乳腺非特殊型浸润性癌病人的临床病理资料,年龄30~62岁,中位年龄53岁。按2012年WHO乳腺肿瘤病理学和遗传学分类标准对各病例进行分型和分级。所有病人术前均未做化疗、免疫及放射治疗。
-
所有组织均以3.7%甲醛溶液固定,经脱水、透明、浸蜡、包埋,3~4 μm连续切片。免疫组织化学染色简要步骤如下:枸橼酸盐缓冲液高压热修复,兔抗人HMGB1单克隆一抗(克隆号:EPR3507,Abcam公司)以1∶ 100稀释比例滴加,室温孵育60 min(37 ℃),0.3% H2O2室温孵育10 min,之后用二抗(EnVision二步法试剂盒,Dako公司)室温孵育30 min(37 ℃),最后用二氨基联苯胺(DAB)显色剂显色3~5 min,苏木精对比染色、脱水、封片。
HMGB1蛋白阳性染色主要定位于细胞核,出现淡黄色至棕褐色颗粒,部分病例细胞质及细胞外也可见着色。本研究中,根据FROMOWITZ等[10]方法,高倍视野(200倍)观察10个表达明显的区域,细胞核表达强度由染色深度及阳性细胞百分比共同评分,染色深度计分0(无染色)、1(淡黄色)、2(棕黄色)、3(棕褐色),阳性细胞所占百分比按≤5%、>5%~25%、>25%~50%、>50%~75%、>75%分别计0、1、2、3、4分,二者相加≥4分为高表达,2~3分为中表达,1分为低表达,0分为阴性(不表达);细胞质表达情况由≥10%细胞质棕黄色染色定义为阳性,低于此标准则为阴性。
-
病人在手术结束后进入随访,每半年电话随访1次,建议其到医院做相关检查,通过临床或病理诊断, 了解病人生存状况以及是否有复发情况,若病人死亡随访终止。
-
采用χ2检验、logistic回归分析、Kaplan-Meier生存分析、Log-rank检验法和Cox比例风险模型。
-
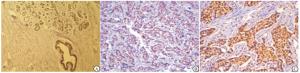
HMGB1在乳腺癌组织中细胞核高表达率80.58%(112/139)高于癌旁正常乳腺组织中细胞核高表达率46.04%(64/139))(χ2=35.68,P<0.01),细胞质阳性表达率16.55%(23/139)也高于癌旁正常组织的表达率0(0/139)(χ2=23.32,P<0.01)(见图 1)。HMGB1细胞质阳性表达均可见细胞核着色,其中19例同时细胞核高表达,表达率为82.61%(19/23)与细胞质阴性者的细胞核高表达率80.17%(93/116)差异无统计学意义(χ2=0.07,P>0.05)。
-
HMGB1在组织学高级别、雌激素受体阴性、孕激素受体阴性乳腺浸润性导管癌组织中细胞质阳性率更高(P<0.05),细胞核高表达率在组织学高级别乳腺浸润性导管癌中更高(P<0.05)(见表 1)。logistic回归分析显示,肿瘤组织学分级是HMGB1在乳腺浸润性导管癌组织中细胞核高表达的独立相关因素(OR=2.197,95%CI= 1.066~4.450,P<0.05)。HMGB1细胞质阳性表达的独立相关因素包括肿瘤组织学分级(OR=3.028,95%CI=1.583~5.736,P<0.01)、雌激素受体表达情况(OR=0.133,95%CI=0.040~0.501,P<0.01)及TNM分期(OR=3.817,95%CI=1.038~14.010,P<0.05)。
临床病理特征 n 细胞核 细胞质 HMGB1高表达 χ2 P HMGB1阳性 χ2 P 年龄/岁 <36 8 7(87.50) 0.32 >0.05 2(25.00) 0.42 >0.05 36~ 83 66(79.52) 13(15.66) >56 48 39(81.25) 8(16.67) 肿瘤大小/cm <2.1 62 48(77.42) 1.60 >0.05 11(17.74) 1.06 >0.05 2.1~ 70 57(81.43) 10(14.29) >5.1 7 7(100.00) 2(28.57) 组织学分级 Ⅰ级 7 2(28.57) 21.12 <0.05 2(28.57) 7.42 <0.05 Ⅱ级 89 68(76.40) 9(10.11) Ⅲ级 43 42(97.67) 12(27.91) 腋窝淋巴结转移 阴性 70 56(80.00) 0.03 >0.05 12(17.14) 0.04 >0.05 阳性 69 56(81.16) 11(15.94) TNM分期 Ⅰ期 37 29(78.38) 0.28 >0.05 5(13.51) 0.34 >0.05 Ⅱ期 68 56(82.35) 12(17.65) Ⅲ期 34 27(79.41) 6(17.65) 雌激素受体 阴性 60 52(86.67) 2.50 >0.05 16(26.67) 7.83 <0.05 阳性 79 60(75.95) 7(8.86) 孕激素受体 阴性 74 64(86.49) 3.53 >0.05 17(22.97) 4.73 <0.05 阳性 65 48(73.85) 6(9.23) HER2 0, 1+ 67 53(79.10) 0.22 >0.05 12(17.91) 0.35 >0.05 2+ 37 30(81.08) 5(13.51) 3+ 35 29(82.86) 6(17.14) 表 1 乳腺癌病人不同临床病理特征下HMGB1表达情况[n;百分率(%)]
-
139例乳腺癌病人均获得完整随访,随访时间为66.5(18~75)个月。139例乳腺浸润性导管癌病人中,5年总生存率为88.49%(123/139),5年无复发生存率为77.70%(108/139)。
HMGB1细胞质阳性乳腺癌病人的5年平均生存时间为54个月,总生存率为78.26%(18/23),HMGB1细胞质阴性乳腺癌病人的5年平均生存时间为58个月,总生存率为90.52%(105/116),差异无统计学意义(χ2=2.83, P>0.05)(见图 2A)。HMGB1细胞质阳性乳腺癌病人的5年平均无复发生存期为47.5个月,无复发生存率为65.22%(15/23),HMGB1细胞质阴性乳腺癌病人的5年平均无复发生存期为54.5个月,无复发生存率为80.17%(93/116),差异无统计学意义(χ2=2.47, P>0.05)(见图 2B)。
HMGB1细胞核阳性乳腺癌病人的5年平均生存时间为56.7个月,总生存率为86.61%(97/112),HMGB1细胞核阴性乳腺癌病人的5年平均生存期为59.9个月,总生存率为96.30%(26/27),差异无统计学意义(χ2=2.00,P>0.05)(见图 2C)。HMGB1细胞核阳性乳腺癌病人的5年平均无复发生存时间为52.3个月,无复发生存率为73.21%(82/112),HMGB1细胞核阴性乳腺癌病人的5年平均无复发生存期为59.2个月,无复发生存率为96.30%(26/27),差异有统计学意义(χ2=6.69,P<0.05)(见图 2D)。
-
HMGB1是一种存在于真核生物细胞内的非组蛋白染色体结合蛋白,因其在聚丙烯酰胺凝胶电泳中快速迁移而得名。研究[11]发现,HMGB1在细胞核内及核外发挥不同的生物学功能:其在细胞核内参与转录调控、DNA重组和修复、维持和稳定核小体结构,在细胞核外参与免疫反应、细胞分化、增殖、迁移等。研究发现细胞核HMGB1可通过主动分泌和被动释放等形式到胞外,其主动分泌需细胞核HMGB1经乙酰化、磷酸化等转录后修饰,然后转位到细胞质中,进入分泌性溶酶体中以出胞方式分泌至胞外[12]。HMGB1的亚细胞定位和表达水平在不同类型细胞和组织中存在较大差异[13]。目前,关于乳腺浸润性导管癌组织中HMGB1亚细胞定位和表达情况,及其临床意义的研究少见,因此,为进一步探讨这些问题,我们检测139例乳腺浸润性导管癌组织中HMGB1的表达并观察其亚细胞定位情况,分析其与预后的关系,并进一步分析不同亚细胞部位的HMGB1蛋白在乳腺浸润性导管癌中的临床意义。
本研究结果显示,乳腺浸润性导管癌细胞核和细胞质均可见HMGB1表达,其中细胞质阳性率为16.5%,而在癌旁正常组织中未见细胞质表达。HMGB1细胞核高表达率和细胞质阳性率均显著高于癌旁正常组织,提示HMGB1可能在乳腺浸润性导管癌发生过程中发挥了作用。在HMGB1细胞质阳性的乳腺浸润性导管癌病人中,均可见细胞核着色,其中19例细胞核高表达。另外,在细胞质阴性乳腺癌病人中HMGB1细胞核高表达率为80.2%,与细胞质阳性者无显著差异。这些结果提示HMGB1主要定位于乳腺浸润性导管癌细胞核,且细胞质阳性的乳腺癌细胞核HMGB1着色并无明显减弱。可能原因为乳腺癌中HMGB1虽然存在细胞核向细胞质转位现象,但其程度较弱,并不影响细胞核HMGB1表达的评分。另外有研究[14-15]在结直肠癌中观察到HMGB1细胞质阳性者,其在细胞核中表达显著下降,在免疫组织化学染色的切片中可观察到明显的核质转位现象。提示HMGB1在不同肿瘤病种中核质转位程度不同,具有不同的表达和定位模式。
本研究结果显示,细胞质的HMGB1表达均与乳腺浸润性导管癌病人多项预后不良指标相关,包括更高的组织学分级、雌激素受体阴性、孕激素受体阴性。表明细胞质的HMGB1与乳腺癌进展密切相关,其可能与雌激素受体或孕激素受体信号通路之间存在关联。另外,年龄较小(<36岁)的乳腺癌病人细胞质HMGB1蛋白表达较其他病人增强,提示年轻乳腺浸润性导管癌病人具有较为活跃的HMGB1核质转位。多因素分析显示:与HMGB1蛋白细胞核高表达相关的独立因素为肿瘤组织学分级,而与细胞质阳性表达相关的独立因素包括肿瘤组织学分级、雌激素受体和TNM分期,因此,我们认为在乳腺浸润性导管癌中,评估细胞质HMGB1表达比评估其细胞核表达更具有临床指导意义。生存分析显示HMGB1蛋白细胞质阳性病人5年总生存率和5年无复发生存率均低于细胞质阴性者,但差异无统计学意义,这可能是由于在本组随访资料中HMGB1细胞质阳性组样本数较少的原因,故今后有待扩大样本量进行进一步分析。
高迁移率族蛋白B1在乳腺浸润性导管癌组织中的表达及其与预后的关系
Expression of high mobility group protein B1 in breast invasive ductal carcinoma tissues and its relationship with prognosis
-
摘要:
目的分析高迁移率族蛋白B1(high mobility group protein B1,HMGB1)在乳腺浸润性导管癌组织中的表达及其与预后的关系。 方法收集139例女性乳腺浸润性导管癌病人的临床病理资料。采用免疫组织化学法检测乳腺浸润性导管癌组织与癌旁正常组织中HMGB1的表达水平,分析HMGB1表达与乳腺浸润性导管癌病人临床病理特征的关系,评价其与乳腺浸润性导管癌病人预后的关系。 结果HMGB1在乳腺浸润性导管癌组织中细胞核高表达率及胞质阳性率分别为80.58%与16.55%,均明显高于在癌旁正常组织中的表达46.04%与0.00%(P < 0.01)。HMGB1在组织学高级别、雌激素受体阴性、孕激素受体阴性乳腺浸润性导管癌组织中细胞质阳性率更高(P < 0.05),细胞核高表达率在组织学高级别中更高(P < 0.05)。肿瘤组织学分级是HMGB1在乳腺浸润性导管癌组织中细胞核高表达的独立相关因素(OR=2.197,P < 0.05)。肿瘤组织学分级(OR=3.028,P < 0.01)、雌激素受体表达情况(OR=0.133,P < 0.01)及TNM分期(OR=3.817,P < 0.05)是HMGB1乳腺浸润性导管癌组织中细胞质阳性表达的独立相关因素。139例乳腺癌病人均获得完整随访,随访时间为66.5(18~75)个月,5年总生存率为88.49%(123/139),5年无复发生存率为77.70%(108/139)。采用Kaplan-Meier法及Log-rank检验法分析不同细胞核、细胞质表达组间的五年生存率、五年无复发生存率以及生存曲线,显示HMGB1细胞核高表达影响乳腺浸润性导管癌的五年无复发生存率(P < 0.05)。 结论HMGB1细胞核高表达及细胞质阳性表达与乳腺浸润性导管癌病人多项预后不良因素密切相关,细胞核高表达对乳腺浸润性导管癌术后复发的预测有指导意义,细胞质阳性表达与肿瘤组织学分级、雌激素受体和TNM分期有关。 Abstract:ObjectiveTo analyze the expression level of high mobility group protein B1(HMGB1) in breast invasive ductal carcinoma tissues, and its relationship with prognosis. MethodsThe clinicopathological data of 139 female patients with breast invasive ductal carcinoma were collected.Immunohistochemistry was used to detect the expression levels of HMGB1 in breast invasive ductal carcinoma tissue and adjacent normal tissue.The relationship between HMGB1 expression level and clinicopathological characteristics in breast invasive ductal carcinoma was analyzed, and the relationship between HMGB1 expression level and prognosis in patients with breast invasive ductal carcinoma was evaluated. ResultsThe nuclear high expression rate and cytoplasmic positive rate of HMGB1 in breast invasive ductal carcinoma tissues were 80.58% and 16.55%, respectively, which were significantly higher than those in adjacent normal tissues(46.04% and 0.00%) (P < 0.01).The cytoplasmic positive expression rates of HMGB1 in high histological grade, negative estrogen receptor and negative progesterone receptor of breast invasive ductal carcinoma tissues were higher(P < 0.05), and the nuclear expression rate in high histological grade tissue was significantly higher(P < 0.05).The tumor histological grade was an independent factor associated with high nuclear expression of HMGB1 in breast invasive ductal carcinoma(OR=2.197, P < 0.05).The tumor histological grade(OR=3.028, P < 0.01), estrogen receptor expression(OR=0.133, P < 0.01), and TNM stage(OR=3.817, P < 0.05) were the independent correlated factors for cytoplasmic positive expression of HMGB1 in breast invasive ductal carcinoma tissues.One hundred and thirty-nine breast cancer patients were followed up for 66.5(18-75) months, the overall 5-year survival rate and 5-year relapse-free survival rate were 88.49%(123/139) and 77.70%(108/139), respectively.The 5-year survival rate, 5-year relapse-free survival rate and survival curve among different nuclear and cytoplasmic expression groups were analyzed using Kaplan-Meier method and Log-rank it indicated that high expression of HMGB1 nucleus affected the 5-year relapse-free survival rate(P < 0.05). ConclusionsThe high expression of HMGB1 in cell nucleus and cytoplasm is closely related to a number of poor prognostic factors in patients with breast invasive ductal carcinoma, and the high expression in nucleus is of guiding significance in predicting postoperative recurrence of breast invasive ductal carcinoma.The positive expression in cytoplasm is related to tumor histological grade, estrogen receptor and TNM stage. -
表 1 乳腺癌病人不同临床病理特征下HMGB1表达情况[n;百分率(%)]
临床病理特征 n 细胞核 细胞质 HMGB1高表达 χ2 P HMGB1阳性 χ2 P 年龄/岁 <36 8 7(87.50) 0.32 >0.05 2(25.00) 0.42 >0.05 36~ 83 66(79.52) 13(15.66) >56 48 39(81.25) 8(16.67) 肿瘤大小/cm <2.1 62 48(77.42) 1.60 >0.05 11(17.74) 1.06 >0.05 2.1~ 70 57(81.43) 10(14.29) >5.1 7 7(100.00) 2(28.57) 组织学分级 Ⅰ级 7 2(28.57) 21.12 <0.05 2(28.57) 7.42 <0.05 Ⅱ级 89 68(76.40) 9(10.11) Ⅲ级 43 42(97.67) 12(27.91) 腋窝淋巴结转移 阴性 70 56(80.00) 0.03 >0.05 12(17.14) 0.04 >0.05 阳性 69 56(81.16) 11(15.94) TNM分期 Ⅰ期 37 29(78.38) 0.28 >0.05 5(13.51) 0.34 >0.05 Ⅱ期 68 56(82.35) 12(17.65) Ⅲ期 34 27(79.41) 6(17.65) 雌激素受体 阴性 60 52(86.67) 2.50 >0.05 16(26.67) 7.83 <0.05 阳性 79 60(75.95) 7(8.86) 孕激素受体 阴性 74 64(86.49) 3.53 >0.05 17(22.97) 4.73 <0.05 阳性 65 48(73.85) 6(9.23) HER2 0, 1+ 67 53(79.10) 0.22 >0.05 12(17.91) 0.35 >0.05 2+ 37 30(81.08) 5(13.51) 3+ 35 29(82.86) 6(17.14) -
[1] 张慧文. 乳腺癌前哨淋巴结检出方法研究进展[J]. 肿瘤研究与临床, 2017, 29(1): 66. doi: 10.3760/cma.j.issn.1006-9801.2017.01.019 [2] GOODWIN GH, JOHNS EW. Isolation and characterisation of two calf-thymus chromatin non-histone proteins with high contents of acidic and basic amino acids[J]. Eur J Biochem, 1973, 40(1): 215. doi: 10.1111/j.1432-1033.1973.tb03188.x [3] GOODWIN GH, SANDERS C, JOHNS EW. A new group of chromatin-associated proteins with a high content of acidic and basic amino acids[J]. Eur J Biochem, 1973, 38(1): 14. doi: 10.1111/j.1432-1033.1973.tb03026.x [4] 张巧玲. HMGB1细胞因子作用研究进展[J]. 疾病监测与控制杂志, 2013, 7(5): 281. [5] MANDKE P, VASQUEZ KM. Interactions of high mobility group box protein 1(HMGB1) with nucleic acids: Implications in DNA repair and immune responses[J]. DNA Repair, 2019, 83: 102701. doi: 10.1016/j.dnarep.2019.102701 [6] RRAPAJ E, TRISOLINI E, BERTERO L, et al. Expression analysis of HMGB1 in histological samples of malignant pleural mesothelioma[J]. Histopathology, 2018, 72(6): 1039. doi: 10.1111/his.13470 [7] 金平. 血清glactin-3、HMGB-1和TSGF联合检测在甲状腺癌诊断中的价值[J]. 蚌埠医学院学报, 2017, 42(10): 1353 [8] 贾敏, 张卉, 童亚林, 等. 高迁移率族蛋白B1与p53的相互作用及其临床意义[J]. 中华实验外科杂志, 2017, 34(1): 170. doi: 10.3760/cma.j.issn.1001-9030.2017.01.059 [9] 陈伦虎, 宋方敏, 李和平, 等. 高迁移率族蛋白B1在溃疡性结肠炎组织中的表达及其与氧化应激、屏障功能损伤的相关性研究[J]. 现代消化及介入诊疗, 2019, 24(10): 1104. doi: 10.3969/j.issn.1672-2159.2019.10.007 [10] FROMOWITZ FB, VIOLA MV, CHAO S, et al. Ras p21 expression in the progression of breast cancer[J]. Hum Pathol, 1987, 18(12): 1268. doi: 10.1016/S0046-8177(87)80412-4 [11] 王思萱, 龙露叶, 方雪娇, 等. 高迁移率族蛋白B1促进结肠癌细胞增殖、迁移与侵袭的机制探讨[J]. 中国病理生理杂志, 2019, 35(11): 1966. doi: 10.3969/j.issn.1000-4718.2019.11.007 [12] 刘嘉. HMGB1与恶性肿瘤之间的相关性研究进展[J]. 重庆医学, 2018, 47(28): 3702. doi: 10.3969/j.issn.1671-8348.2018.28.027 [13] 胡建宏, 王茂林. 高迁移率族蛋白B1在胶质瘤发生发展中的作用及其机制研究[J]. 国际神经病学神经外科学杂志, 2019, 46(2): 222. [14] 潘薇, 陈瑞, 张忠涛. TREM-1和HMG B1在老年直肠癌病人肿瘤组织中的表达及其与预后的关系[J]. 中国现代普通外科进展, 2019, 22(5): 378. [15] 文光旭, 胡登华, 张宏宇. 高迁移率族蛋白B1和血管内皮生长因子在老年直肠癌中的表达及其与预后的相关性[J]. 中国老年学杂志, 2016, 36(7): 1636. doi: 10.3969/j.issn.1005-9202.2016.07.045 -




 下载:
下载:



