-
蛛网膜下腔出血(SAH)是严重威胁人类生命的疾病, 病死率及致残率很高, 约40%的病人出血后48 h内死亡[1], 已广泛引起人们的关注与重视。近年来研究[2]显示, 改善大血管痉挛并不能明显改善SAH病人的预后, 早期脑损伤(EBI)可能是导致SAH病人死亡风险较高和决定预后的首要原因, 而且其发生机制复杂, 涉及脑细胞及脑血管一系列的病理生理改变。全脑CT灌注成像可以动态观察全脑不同时间段的微循环状况, 通过血流量(CBF)、血容量(CBV)、平均通过时间(MTT)和达峰时间(TTP)多参数定量分析, 间接反映EBI的进展程度。一氧化氮(NO)是重要的血管活性物质, 能够介导脑血管的舒缩反应, 影响EBI的进展。本研究拟通过兔SAH模型的建立, 研究EBI状态下脑微循环的变化规律及与血清NO的相关性。
-
新西兰大白兔购自蚌埠医学院实验动物中心, 动物合格证号SCXK(苏)2017-0001, 雌雄不限, 体质量2.5~3.5 kg, 适应性喂养一周后进行实验。分为手术组和假手术组, 2组再分为术后1 h、6 h、24 h、72 h 4个亚组, 各10只, 共80只。
-
采用枕大池注血法制备兔SAH模型。(1)30 g/L戊巴比妥经兔耳缘静脉注射麻醉, 麻醉剂量为1 mL/kg。(2)动物麻醉后取俯卧位, 兔颈部剃毛并固定四肢躯干, 触摸到枕大孔边缘后作手术切口约2.5 cm, 逐层钝性分离颈部肌肉至可触摸到枕大孔骨缘和第二颈椎棘突。用18G穿刺针经环枕筋膜穿刺枕大池, 为模拟真实SAH, 尽量不放出脑脊液。(3)在耳正中动脉用注射器抽取约5 mL血液。(4)迅速将血以0.5 mL/s的速度注入枕大池内, 以1.5 mL/kg的量注入, 注血后迅速拔针, 用纱布按压局部1 min, 并观察周围肌肉间隙内无渗血后将青霉素粉末撒在伤口局部, 分层缝合肌肉和皮肤。(5)术毕按头低30°位放置约30 min, 以利于血液分布在基底动脉周围。假手术组动物模型的操作与SAH模型组相同, 仅以等量的37 ℃ 0.9%氯化钠溶液替代自体血。
造模成功判断指征: 注血实验兔会出现如心率加快、急促呼吸甚至呼吸骤停、四肢强直样改变或大小便失禁等; 以及表现出不同程度的神经功能障碍, 如嗜睡、拒食、活动减少等轻度神经功能障碍, 跛行、单瘫等中度障碍, 划圈运动、行走困难、四肢瘫痪等重度障碍。本研究实验兔术后大体标本均发现不同程度的血凝块可以证实SAH造模成功。
-
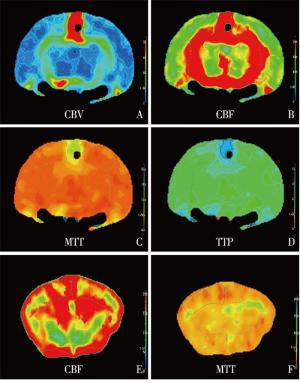
使用GE revolution CT, 兔麻醉后俯卧位头先进固定于特制的扫描架内。选择矩阵1 024×1 024, 扫描范围8 cm, 脑灌注成像操作程序, 间隔1 s曝光1次, 共40次。扫描前经耳缘静脉以1.5 mL/s流速注入非离子造影剂5 mL, 注入3 s后开始扫描。图像后处理: 将扫描数据导入工作站, 沿着额、颞、顶、枕叶边缘画感兴趣区(ROI)(见图 1), 随机软件自动得出CBF、CBV、MTT和TTP参数数值及相应的伪彩图。各灌注参数为额、颞、顶、枕各脑叶CT灌注结果的均值。
-
于动物模型建立后1、6、24、72 h, CT扫描前自兔耳缘静脉采血2 mL; 不抗凝室温下3 000 r/min离心10 min, 取上清液于-20 ℃保存待测。用酶联法按试剂盒说明书测定兔血清NO含量, 兔血清一氧化氮(NO)试剂盒购于厦门慧嘉生物有限公司。
-
实验动物于建模后1、6、24、72 h, 用30 g/L戊巴比妥麻醉, CT扫描后取仰卧位, 剪开胸腔, 暴露心脏。剪开左心室, 将点滴管通过左心室插入主动脉, 打开点滴管, 将0.9%氯化钠溶液快速滴注, 待右心耳膨胀后剪开, 右心耳流出液变淡时, 改用4%甲醛灌注, 先快后慢, 动物四肢抽搐、震颤, 表示灌注成功。然后开颅, 分别取两侧额叶、颞叶、枕叶、顶叶脑皮质部分各一块, 于甲醛溶液中保存。对组织进行常规苏木素-伊红染色, 观察脑组织细胞形态及炎性细胞浸润情况。
-
采用t检验、方差分析、q检验和直线相关分析。
-
手术组术后20只兔表现为异常兴奋、上蹿下跳, 13只表现为淡漠、萎靡、活动减少, 4只出现活动障碍或瘫痪; 假手术组3只出现上述症状; 其余兔未见明显异常。
-
手术组CBV与CBF在术后1、6、24、72 h均明显低于假手术组(P<0.01), MTT高于假手术组(P<0.05~P<0.01);手术组TTP在术后24 h和72 h高于假手术组间(P<0.01和P<0.05), 2组术后1 h和6 h差异无统计学意义(P>0.05)(见表 1)。
分组 n 术后1 h 术后6 h 术后24 h 术后72 h F P MS组内 CBV/(mL/100 g) 手术组 10 4.79±0.98 5.17±0.68 4.58±0.77 4.76±0.90 0.87 >0.05 0.706 假手术组 10 8.02±1.20 9.93±2.48* 10.95±1.05** 10.94±1.17** 7.56 < 0.01 2.516 t — 6.59 5.85 15.47 13.24 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — CBF/(mL·100 g-1·min-1) 手术组 10 353.71±42.94 257.32±37.25** 182.15±16.36**△△ 69.06±41.86**## 37.60 < 0.01 1 312.829 假手术组 10 632.45±95.69 657.52±61.15 559.14±104.30 550.79±115.29 3.04 < 0.05 9 266.543 t — 8.40* 17.67 11.29 12.42 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — MTT/s 手术组 10 1.76±0.21 2.19±0.43 2.70±0.67** 1.64±0.84## 6.67 < 0.01 0.346 假手术组 10 0.74±0.29 0.87±0.33 1.00±0.41 1.00±0.25 1.46 >0.05 0.106 t — 9.01 7.70 6.84 2.31 — — — P — < 0.01 < 0.01 < 0.01 < 0.05 — — — TTP/s 手术组 10 9.02±0.78 9.25±1.13 9.00±0.99 9.07±0.46 0.17 >0.05 0.769 假手术组 10 8.75±1.09 8.62±0.32*△ 7.73±0.58 8.31±0.71 3.87 < 0.05 0.533 t — 0.64 1.70 3.50 2.84 — — — P — >0.05 >0.05 < 0.01 < 0.05 — — — q检验: 与术后1 h比较*P<0.05, ** P<0.01;与术后6 h比较△△P<0.01;与术后24 h比较## P<0.01 表 1 2组CT灌注参数比较(x±s)
-
假手术组在术后1、6、24、72 h NO含量无明显变化(P>0.05), 手术组兔在术后24 h和72 h NO含量有所回升(P<0.01);术后1、6、24、72 h手术组NO含量均明显低于相应假手术组(P<0.01)(见表 2)。
分组 n 术后1 h 术后6 h 术后24 h 术后72 h F P MS组内 手术组 10 0.66±0.15 0.84±0.21 1.93±0.55**△△ 1.85±0.50**△△ 28.41 < 0.01 0.155 假手术组 10 2.71±1.01 2.71±0.76 3.02±0.85 3.21±0.54 0.93 >0.05 0.653 t — 6.35 7.50 3.40 5.84 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — q检验: 与术后1 h比较** P<0.01;与术后6 h比较△△P<0.01 表 2 2组血清NO含量比较(x±s; μmol/L)
-
直线相关分析显示, 手术组NO与MTT呈负相关关系(r=-0.854, P<0.05), 与CBF呈正相关关系(r=0.786, P<0.05), 与CBV(r=0.208, P>0.05)、TTP(r=0.311, P>0.05)间无明显相关性。
-
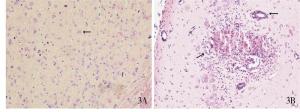
大体观察: 术后1 h注血组, 枕大池区域、延髓腹侧面可见血液集聚, 大脑半球表面无明显血凝块。术后6 h注血组, 少量血液集聚于枕大池区域, 延髓腹侧面可见较多血凝块。术后24 h注血组, 枕大池区及大脑半球表面较多陈旧的血凝块。术后72 h注血组, 枕大池内未见明显的血凝块, 而大脑半球腹侧面可见少量血凝块。假手术组大脑半球表面无明显血凝块(见图 2)。
镜下观察: 1 h手术组, 颞叶及枕叶部分小血管略狭窄, 血管周围出现少量炎性细胞的浸润; 6 h手术组, 额、颞、枕叶出现较明显炎症反应, 血管管腔狭窄, 管壁增厚, 周围淋巴细胞增多聚集; 24 h手术组, 额、顶叶局部出现无结构的均质红染的坏死区, 周围有大量炎性细胞浸润, 颞、枕叶小血管明显狭窄, 细胞肿胀; 72 h手术组, 额、枕、颞叶脑组织细胞增大, 水肿, 胞质增多。假手术组病理切片示脑组织结构清晰, 细胞大小形态分布正常, 未见明显炎症反应和坏死灶(见图 3)。
-
EBI是SAH后72 h内脑作为一个整体发生的直接损伤, 涉及到迟发性脑血管痉挛出现之前脑组织内所发生的病理生理事件, 包括脑组织细胞死亡、血脑屏障破坏、脑水肿、颅内压增高、急性脑血管痉挛、微血管功能障碍脑血流下降等多种病理生理事件[3-4], 这些都会造成脑缺血, 引起脑细胞的凋亡及坏死, 最终造成EBI。因此, 了解EBI的进展过程、机制及全脑微循环的变化规律是治疗及预防的关键。
对于SAH后EBI的影像学检查, 常规的TCD、CTA、DSA只能反映大血管的痉挛, 无法显示微血管以及脑组织的功能情况[5]。现代影像医学已经从单纯形态学检查向以形态学和分子水平、微循环及代谢产物为特点的功能学检查方向发展[6]。CT灌注成像正是这样一种功能成像, 它是在静脉团注对比剂的同时, 对选定层面进行快速动态CT扫描, 追踪分析对比剂首次通过受检组织过程中每个像素的密度变化, 获得CBF、CBV、MTT和TTP定量数据及伪彩图, 可以活体评价脑内血流的灌注状态, 能够反映脑组织的微循环改变, 是无创显示脑组织缺血的最准确、最敏感的方法[7]。近年来, CT灌注成像在临床中也得到了广泛的应用[8]。
本研究通过分析CT灌注参数研究SAH出血早期不同时间段脑组织的微循环变化规律, 从而了解EBI的进展程度。手术组CBV低于对照组, 提示由于血液刺激造成的机械性损伤、炎症因子的释放等造成了微血管的痉挛性狭窄, 局部脑组织继而出现缺血表现, 引起了血容量的减少[9]; 手术组间比较无明显差异, 可能由于EBI时脑内微循环较宏观血管对于刺激的反应更加灵敏[10], 侧枝循环及血流代偿机制还未完全启动。CBF在SAH后24 h达到了最低值, 72 h上升, 由此可见, SAH早期全脑即出现明显的低灌注状态, 在伪彩图上也发现了较多的低灌注区域, 对应的病理切片上我们也可见肿胀的脑细胞、小血管的管腔狭窄等表现。国内外研究[11]发现, SAH后早期颅内压的急剧升高、脑灌注压明显降低, 导致脑血流量下降从而导致早期全脑缺血; 亦有实验[12]表明, SAH发生后数分钟内神经元细胞就出现凋亡, 微血管通透性增加、血脑屏障作用破坏、炎性细胞侵入, 造成了明显的脑水肿表现。相关研究[13]亦发现大鼠脑缺血后60 min, 大脑皮层即开始有P53表达增加, 24~48 h达高峰, 与本研究CBF变化规律基本一致, 因此CT灌注发现的异常能间接反映SAH后脑缺血及脑坏死的程度。MTT在SAH发生后1 h迅速升高, 6 h、24 h达到顶峰, 在72 h减低, 病理分析也可以发现血管壁增厚, 管腔狭窄, 周围有大量的炎性细胞浸润, 脑组织中还出现了无结构的坏死区, 可以推在第6~24 h阶段脑损伤程度达到了高峰。TTP没有MTT敏感, 手术组TTP只在6 h、24 h组高于假手术组, 一定程度上反映了脑组织的损伤及缺血状态。由此可见, SAH后72 h内脑组织内发生的各种病理生理变化迅速、复杂, 全脑的低灌注、缺血状态、脑水肿、微小血管的痉挛及狭窄等会造成病人严重的神经功能障碍, 甚至死亡。
研究[14]发现NO参与了SAH后迟发型脑血管痉挛的病理生理进程, 影响了脑微循环的改变, 与EBI有着密切的关系。NO是在一氧化氮合成酶作用下产生的内皮细胞松弛因子, 是机体重要的气体活性分子, 有舒张血管的作用, 通常情况下, 由血管内皮细胞产生生理剂量的NO, 作用于平滑肌细胞, 调节脑血流及维持神经元功能的完整性[15-16]。本研究发现SAH后1 h、6 h手术组NO含量持续减低, 72 h较24 h有所升高, 但较假手术组NO含量依然是减低的, 在相关分析中发现NO与MTT呈负相关关系, 与CBF呈正相关关系。CBF为单位时间内流经特定区域脑组织的血液容量, MTT理论上是血液自动脉端流至静脉端的循环时间, 因通过的血管路径不同, 时间也不同, 所以用平均通过时间表示[17], MTT增加及CBF减少意味着循环减慢, 反映了微循环的障碍及脑组织的缺血状态, 因此我们推测NO可能早期就介导了SAH后微血管痉挛参与了脑损伤的进程。SAH后血液进入蛛网膜下腔, 崩解释放氧合血红蛋白, 破坏NO释放神经元, 引起NO水平在1 h、6 h急剧下降[18], 继而NO舒张平滑肌的能力减低及抑制内皮素-1能力减弱, 进一步促进了血管收缩, 导致MTT的升高及CBF的下降。在24~72 h时段检测到NO浓度有所上升, 可能与诱导型一氧化氮合酶(iNOS)的激活有关[19], iNOS活化促使胶质细胞和巨噬细胞释放NO, 或者是脑内侧枝循环及代偿反应的形成有关。但是手术组各期相NO含量均低于假手术组, 说明SAH早期各阶段, NO都参与其中, 导致了脑微循环及相应的病理改变, 一直影响着EBI的进展。
综上, CT灌注能够反映脑组织的血流灌注状态, 提供组织器官血流动力学信息, 能较敏感地反映SAH后脑组织微循环障碍, 其中CBF、MTT能很好地提示EBI的进展程度, NO在SAH后EBI中发挥的重要作用, 这些对于研究EBI的形成机制、指导临床治疗方案的制定和判断临床预后有着重要的意义。由于SAH后EBI的发生是多因素参与的, 本研究仅探讨了NO对SAH后EBI的影响及与CT灌注参数间相关关系, 未进行多因素的综合分析, 将进一步分析多个因素(如收缩血管因子、某些炎症因子等)在SAH后EBI中的作用。
一氧化氮与蛛网膜下腔出血后早期脑损伤所致脑微循环变化的相关性研究
Correlation between nitric oxide and cerebral microcirculation changes caused by early brain injury after subarachnoid hemorrhage
-
摘要:
目的观察蛛网膜下腔出血(SAH)后早期脑微循环的变化及SAH后一氧化氮(NO)的表达对早期脑损伤(EBI)及脑微循环的影响。 方法80只新西兰大白兔分为手术组和假手术组,2组再分为术后1、6、24、72 h 4个亚组,各10只。手术组采用枕大池注血法制备兔SAH模型,假手术组采用相同方法注射0.9%氯化钠溶液制备模型。然后行全脑CT灌注成像,比较各组血流量(CBF)、血容量(CBV)、平均通过时间(MTT)、达峰时间(TTP)、NO含量,并分析NO与CBV、CBF、MTT、TTP相关性。 结果手术组CBV与CBF在术后1、6、24、72 h均明显低于假手术组(P<0.01),MTT高于假手术组(P<0.05~P<0.01);手术组TTP在术后24 h和72 h均高于假手术组间(P<0.01和P<0.05)。假手术组在术后1、6、24、72 h NO含量无明显变化(P>0.05),手术组兔在术后24 h和72 h NO含量有所回升(P<0.01);术后1、6、24、72 h手术组NO含量均明显低于相应假手术组(P<0.01)。直线相关分析显示,手术组NO与MTT呈负相关关系(r=-0.854,P<0.05),与CBF呈正相关关系(r=0.786,P<0.05)。 结论CT灌注能早期发现SAH后局部脑缺血,反映SAH后EBI的病理进展程度。NO一定程度上影响SAH后微循环的改变及EBI的进展程度。 Abstract:ObjectiveTo observe the changes of early cerebral microcirculation after subarachnoid hemorrhage (SAH) and the effect of nitric oxide (NO) expression on early brain injury (EBI) and cerebral microcirculation after SAH. MethodsEighty New Zealand white rabbits were divided into the operation group and sham operation group, then the two groups were further divided into 4 subgroups including 1 h, 6 h, 24 h and 72 h after operation, with 10 rabbits in each subgroup.SAH model was established by injecting autologous blood into cisterna magna in operation group, and injecting 0.9% sodium chloride solution with the same method in sham operation group.The CT perfusion imaging of whole brain was performed to compare the cerebral blood flow(CBF), cerebral blood volume(CBV), mean transit time(MTT), time to peak (TTP) and NO content in each group, and the correlation between NO and CBV, CBF, MTT, TTP was analyzed. ResultsCBV and CBF in operation group were significantly lower than those in sham operation group at 1 h, 6 h, 24 h and 72 h after operation (P<0.01), and MTT was higher than that in sham operation group(P<0.05 to P<0.01);TTP in operation group was higher than that in sham operation group at 24 h and 72 h after operation(P<0.01 and P<0.05).There was no significant change in the NO content at 1 h, 6 h, 24 h and 72 h after operation in sham operation group(P>0.05), but the NO content increased at 24 h and 72 h after operation in operation group(P<0.01);at 1 h, 6 h, 24 h and 72 h after operation, the NO content in operation group was significantly lower than that in the corresponding sham operation group(P<0.01).Linear correlation analysis showed that NO was negatively correlated with MTT(r=-0.854, P<0.05) and positively correlated with CBF(r=0.786, P<0.05). ConclusionsCT perfusion can detect the focal cerebral ischemia after SAH in early stage, which reflects the pathological progress of EBI after SAH.NO affects the microcirculation changes and the progress of EBI after SAH to some extent. -
Key words:
- subarachnoid hemorrhage /
- early brain injury /
- nitric oxide /
- CT perfusion /
- microcirculation
-
表 1 2组CT灌注参数比较(x±s)
分组 n 术后1 h 术后6 h 术后24 h 术后72 h F P MS组内 CBV/(mL/100 g) 手术组 10 4.79±0.98 5.17±0.68 4.58±0.77 4.76±0.90 0.87 >0.05 0.706 假手术组 10 8.02±1.20 9.93±2.48* 10.95±1.05** 10.94±1.17** 7.56 < 0.01 2.516 t — 6.59 5.85 15.47 13.24 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — CBF/(mL·100 g-1·min-1) 手术组 10 353.71±42.94 257.32±37.25** 182.15±16.36**△△ 69.06±41.86**## 37.60 < 0.01 1 312.829 假手术组 10 632.45±95.69 657.52±61.15 559.14±104.30 550.79±115.29 3.04 < 0.05 9 266.543 t — 8.40* 17.67 11.29 12.42 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — MTT/s 手术组 10 1.76±0.21 2.19±0.43 2.70±0.67** 1.64±0.84## 6.67 < 0.01 0.346 假手术组 10 0.74±0.29 0.87±0.33 1.00±0.41 1.00±0.25 1.46 >0.05 0.106 t — 9.01 7.70 6.84 2.31 — — — P — < 0.01 < 0.01 < 0.01 < 0.05 — — — TTP/s 手术组 10 9.02±0.78 9.25±1.13 9.00±0.99 9.07±0.46 0.17 >0.05 0.769 假手术组 10 8.75±1.09 8.62±0.32*△ 7.73±0.58 8.31±0.71 3.87 < 0.05 0.533 t — 0.64 1.70 3.50 2.84 — — — P — >0.05 >0.05 < 0.01 < 0.05 — — — q检验: 与术后1 h比较*P<0.05, ** P<0.01;与术后6 h比较△△P<0.01;与术后24 h比较## P<0.01 表 2 2组血清NO含量比较(x±s; μmol/L)
分组 n 术后1 h 术后6 h 术后24 h 术后72 h F P MS组内 手术组 10 0.66±0.15 0.84±0.21 1.93±0.55**△△ 1.85±0.50**△△ 28.41 < 0.01 0.155 假手术组 10 2.71±1.01 2.71±0.76 3.02±0.85 3.21±0.54 0.93 >0.05 0.653 t — 6.35 7.50 3.40 5.84 — — — P — < 0.01 < 0.01 < 0.01 < 0.01 — — — q检验: 与术后1 h比较** P<0.01;与术后6 h比较△△P<0.01 -
[1] 张云辉, 王廷华. 脑源性神经营养因子与脑缺血肺水肿[J]. 四川大学学报(医学版), 2012, 43(6): 893. [2] LIU E, SUN L, ZHANG Y, et al. Aquaporin4 knockout aggravates early brain injury following subarachnoid hemorrhage through impairment of the glymphatic system in rat brain[J]. Acta neurochirurgica Supplement, 2020, 127: 59. [3] GU H, FEI ZH, WANG YQ, et al. Angiopoietin-1 and angiopoiein-2 expression imbalance influence in early period after subarachnoid hemorrhage[J]. Int Neurourol J, 2016, 20(4): 288. doi: 10.5213/inj.1632692.346 [4] GÜRER B, KERTMEN H, KURU BEKTAŞOǦLU P, et al. The effects of cinnamaldehyde on early brain injury and cerebral vasospasm following experimental subarachnoid hemorrhage in rabbits[J]. Metab Brain Dis, 2019, 34(6): 1737. doi: 10.1007/s11011-019-00480-7 [5] ZHANG H, ZHANG B, LI S, et al. Whole brain CT perfusion combined with CT angiography in patients with subarachnoid hemorrhage and cerebral vasospasm[J]. Clin Neurol Neurosurg, 2013, 115(12): 2496. doi: 10.1016/j.clineuro.2013.10.004 [6] VAIDYA T, AGRAWAL A, MAHAJAN S, et al. The continuing evolution of molecular functional imaging in clinical oncology: The road to precision medicine and radiogenomics(Part Ⅰ)[J]. Mol Diagn Ther, 2019, 23(1): 1. doi: 10.1007/s40291-018-0366-4 [7] OEBEL S, HAMADA S, HIGASHIGAITO K, et al. Comprehensive morphologic and functional imaging of heart transplant patients: first experience with dynamic perfusion CT[J]. Eur Radiol, 2018, 28(10): 4111. doi: 10.1007/s00330-018-5436-9 [8] QIN L, LI S, ZHENG RB, et al. Endothelin-1 expression and alterations of cerebral microcirculation after experimental subarachnoid hemorrhage[J]. Neuroradiology, 2015, 57(1): 63. doi: 10.1007/s00234-014-1435-y [9] MALINOVA V, ILIEV B, TSOGKAS I, et al. Assessment of tissue permeability by early CT perfusion as a surrogate parameter for early brain injury after subarachnoid hemorrhage[J]. J Neurosurg, 2019, 23: 1. [10] CHAI WN, SUN XC, LV FJ, et al. Clinical study of changes of cerebral microcirculation in cerebral vasospasm after SAH[J]. Acta Neurochir Suppl, 2011, 110(1): 225. [11] WANG Z, SHI XY, YIN J, et al. Role of autophary in early brain injury after experimental subarachnoid hemorrhage[J]. J Mol Neurosci, 2011, 28(6): 252. [12] OKADA T, ENKHJARGAL B, TRAVIS ZD, et al. FGF-2 attenuates neuronal apoptosis via FGFR3/PI3k/Akt signaling pathway after subarachnoid hemorrhage[J]. Mol Neurobiol, 2019, 56(12): 8203. doi: 10.1007/s12035-019-01668-9 [13] ZHOU N, XU T, BAI Y, et al. Protective effects of urinary trypsin inhibitor on vascular permeability following subarachnoid hemorrhage in a rat model[J]. CNS Neurosci Ther, 2013, 19(9): 659. doi: 10.1111/cns.12122 [14] ZHENG RB, QIN L, LI SB, et al. CT perfusion-derived mean transit time of cortical brain has a negative correlation with the plasma level of Nitric Oxide after subarachnoid hemorrhage[J]. Acta Neurochir, 2014, 156(3): 527. doi: 10.1007/s00701-013-1968-6 [15] KIM H, BRITTON GL, PENG T, et al. Nitric oxide-loaded echogenic liposomes for treatment of vasospasm following subarachnoid hemorrhage[J]. Int J Nanomedicine, 2014, 9: 155. [16] ZHAO D, LIU Q, JI Y, et al. Correlation between nitric oxide and early brain injury after subarachnoid hemorrhage[J]. Int J Neurosci, 2015, 37(6): 476. [17] WU Q, ZHENG R, WANG J, et al. CT perfusion imaging of cerebral microcirculatory changes following subarachnoid hemorrhage in rabbits: Specific role of endothelin-1 receptor antagonist[J]. Brain Res, 2018, 12: 1701. [18] LI HT, WANG J, LI SF, et al. Upregulation of microRNA-24 causes vasospasm following subarachnoid hemorrhage by suppressing the expression of endothelial nitric oxide synthase[J]. Mol Med Rep, 2018, 18(1): 1181. [19] SUN J, ZHANG Y, LU J, et al. Salvinorin A ameliorates cerebral vasospasm through activation of endothelial nitric oxide synthase in a rat model of subarachnoid hemorrhage[J]. Microcirculation, 2018, 25(3): e12442. doi: 10.1111/micc.12442 -




 下载:
下载: