-
皮肤是最易受损伤的组织,创伤愈合是多种修复细胞、生长因子和细胞外基质之间相互作用的动态修复过程,可简单概括为3个阶段:止血和炎症反应阶段;细胞增殖分化阶段;组织重塑、瘢痕形成阶段[1]。皮肤创伤后, 立即发生血管收缩、血小板聚集及纤维蛋白凝块形成等反应, 参与创面止血。局部炎症反应由纤维蛋白凝块及聚集的血小板脱颗粒引起,炎症阶段募集的炎细胞、上皮细胞、真皮细胞等分泌的生长因子诱导并维持细胞增生,启动细胞迁移。同时,创面内成纤维细胞增生并合成细胞外基质, 形成新生肉芽组织,随后被重塑为早期瘢痕组织。最后, 成纤维细胞凋亡, 形成相对无细胞的瘢痕组织, 其结构和功能与正常皮肤组织相似[2-3]。在皮肤创伤愈合过程中,成纤维细胞是主要修复细胞,是细胞外基质、肉芽组织及瘢痕组织形成中的主要功能细胞[4]。黄芪入药历史悠久,是一味临床上常用的中药材。黄芪的主要活性成分是黄芪甲苷(astragaloside-Ⅳ,AS-Ⅳ),AS-Ⅳ具有提高免疫力、调节血糖、抗肿瘤等功效[5]。有文献报道[6],在皮肤创伤后,给予AS-Ⅳ有助于皮肤创面愈合。但文献研究的是较低浓度的AS-Ⅳ,并未探索较高浓度AS-Ⅳ产生的不利影响,忽略了药物本身的毒性作用。本研究通过观察AS-Ⅳ对小鼠成纤维细胞L929的细胞毒性及影响机制,为AS-Ⅳ在皮肤创伤治疗中的合理应用提供实验依据。
-
L929细胞购自中国科学院上海分院细胞库;AS-Ⅳ(纯度>99%)购自美国MedChem Express公司;胎牛血清和RPMI 1640培养基购自美国Gibco公司;胰蛋白酶-EDTA消化液购自碧云天生物技术有限公司;CCK8购自美国APExBIO公司;Annexin V-FITC/PI凋亡试剂盒购自美国BD Biosciences公司;γ-H2AX、cleaved Caspase-3、山羊抗兔IgG、山羊抗鼠lgG、β-actin抗体均购自英国Abcam公司。
-
ZHJH-C1112B型超净工作台(上海智城有限公司);CKX41型倒置显微镜(日本Olympus公司);DW-86L626型-80 ℃超低温冰箱(青岛海尔集团);Uvrsamax酶标仪(美国MD公司);CALIBUR型流式细胞仪(美国BD公司);Tannon-5200型化学显色仪(上海天能有限公司)。
-
取适量AS-Ⅳ完全溶于二甲基亚砜(DMSO)溶液中(参照MCE公司AS-Ⅳ配置说明);临用时将配置好的细胞培养基稀释成试验所需的药物浓度,并使DMSO的最终浓度均小于0.3%,有研究[7-8]表明,此浓度范围DMSO对细胞无明显毒性作用。
-
将L929细胞接种于含10%胎牛血清、1%青霉素-链霉素溶液的RPMI 1640培养液中,置于5% CO2、37 ℃培养箱培养,2~3 d更换培养液1次,定期观察细胞生长情况,当细胞汇合率达70%~80%,用含EDTA的胰酶处理传代,选择对数生长期细胞进行实验。
-
选取对数生长期L929细胞,按4×105个/瓶,接种于25 mL培养瓶中,培养过夜待其贴壁后,设置Control组(空白对照组,未给予AS-Ⅳ)[9]、AS-Ⅳ(30、60、120 μmol/L)组和0.3% DMSO组(细胞培养基中DMSO浓度为0.3%)。继续孵育培养12 h及24 h后,在倒置显微镜下观察细胞形态,并拍照记录。
-
取对数生长期L929细胞,按5×104/mL细胞密度接种于96孔培养板中,每孔100 μL。培养24 h待细胞贴壁后吸弃培养液,空白孔(无细胞孔)及对照孔(接种细胞但不加入AS-Ⅳ)加入完全培养液100 μL,实验组分别加入含终浓度为30、60、90、120 μmol/L AS-Ⅳ及0.3% DMSO的培养液100 μL,每组设8个复孔。分别在药物作用6、12、24 h后,吸弃培养液,将10 μL CCK8溶液和90 μL无血清培养基添加到每个孔中,并在37 ℃下孵育2 h。在450 nm下测量各孔吸光度(OD)值[10]。
-
取对数生长期L929细胞消化、重悬、调整细胞密度后接种于6孔板,置于37 ℃恒温、5% CO2培养箱中培养过夜。然后加入不同浓度AS-Ⅳ(30、60、120 μmol/L)干预细胞24 h后,收集各组细胞,于4 ℃、2 000 r/min离心5 min,冷PBS洗涤2次,重悬于结合缓冲液中,将细胞密度调整为1×105/mL,取细胞悬液100 μL,置于流式管中,分别加入Annexin V-FITC和PI,于避光条件下,振动摇匀15 min,使用流式细胞仪分析细胞,计算细胞凋亡率(包含早期凋亡及晚期凋亡)[11]。
-
取对数期L929细胞消化、重悬、调整细胞密度后接种于6孔板,置于37 ℃恒温、5% CO2培养箱中培养过夜。然后加入AS-Ⅳ处理,收集各组细胞,冰上充分裂解30 min,在4 ℃、13 000 r/min低温离心机中离心15 min,然后吸取上清。使用BCA试剂盒测定蛋白浓度。每个样本取约40 μg总蛋白用12%聚丙烯酰胺凝胶电泳分离,然后转移至PVDF膜。将膜用5%脱脂奶封闭2 h,将条带对应放入γ-H2AX、cleaved Caspase-3及β-actin抗体溶液中4 ℃孵育过夜。TBST洗膜3次,每次10min,然后在室温下与二抗孵育2 h。TBST洗膜3次,每次10 min,ECL显色后,成像系统进行曝光显影,Image J软件分析蛋白条带灰度值。
-
L929细胞以5×105个/孔接种于6孔板中,37 ℃、5% CO2培养过夜。待细胞生长至80%融合时,用无菌移液枪头垂直在6孔板底部划痕,PBS洗涤3次,换为无血清培养基,加入不同浓度AS-Ⅳ(30、60、120 μmol/L)及0.3% DMSO,每组设置4个复孔,在12 h及24 h使用倒置显微镜观察细胞迁移情况,并在同一视野中拍照。细胞相对迁移率=[(0 h划痕面积-12 h/24 h划痕面积)/0 h划痕面积]×100%。
-
采用方差分析和q检验。
-
Control组及0.3% DMSO组L929细胞形态无明显改变,多为贴壁生长的梭形及多角形细胞。与Control组相比,30、60、120 μmol/L的AS-Ⅳ处理L929细胞12、24 h,随给药浓度及给药时间增加,圆形细胞逐渐增多,悬浮细胞增多,死亡细胞逐渐增多(见图 1)。
-
30、60、90、120 μmol/L AS-Ⅳ处理L929细胞12 h和24 h,其OD值均低于Control组(P < 0.05~P < 0.01)。在同一处理时间(12 h、24 h),随着给药浓度增加,其OD值逐渐降低(P < 0.05~P < 0.01)。同一浓度AS-Ⅳ处理L929细胞12 h和24 h,其OD值均低于处理6 h(P < 0.05~P < 0.01)。0.3% DMSO组与Control组细胞OD值随时间增加而升高,2组OD值差异无统计学意义(P>0.05)(见表 1)。
分组 6 h OD值 12 h OD值 24 h OD值 F P MS组内 Control组 1.81±0.01 1.90±0.01 2.18±0.04 540.51 < 0.01 0.000 0.3% DMSO组 1.81±0.34 1.93±0.22 2.17±0.04 5.20 < 0.05 0.055 AS-Ⅳ 30 μmol/L组 1.75±0.25 1.73±0.32* 1.43±0.01** 4.53 < 0.05 0.055 AS-Ⅳ 60 μmol/L组 1.67±0.20* 1.55±0.01**▲ 1.42±0.03**▲ 9.15 < 0.05 0.014 AS-Ⅳ 90 μmol/L组 1.58±0.22*▲ 1.42±0.10**▲▲■ 1.35±0.04**▲■ 5.50 < 0.05 0.020 AS-Ⅳ 120 μmol/L组 1.39±0.16*▲■△ 1.16±0.01**▲▲■■△ 0.91±0.15**▲▲■■△△ 28.18 < 0.01 0.017 F 4.20 26.53 412.41 — — — P < 0.05 < 0.01 < 0.01 — — — MS组内 0.049 0.026 0.005 — — — q检验:与Control组比较*P < 0.05,**P < 0.01;与0.3% DMSO组比较#P < 0.05;与AS-Ⅳ 30 μmol/L组比较▲P < 0.05,▲▲P < 0.01;与AS-Ⅳ 60 μmol/ L组比较■P < 0.05,■■P < 0.01;与AS-Ⅳ 90 μmol/L组比较△P < 0.05, △△P < 0.01 表 1 AS-Ⅳ干预后L929细胞各组OD值比较(ni=8;x±s)
-
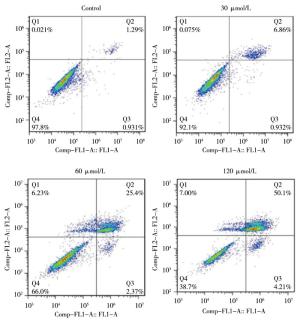
AS-Ⅳ 30、60、120 μmol/L分别干预L929细胞24 h,细胞凋亡率均高于Control组(P < 0.05~P < 0.01)(见图 2、表 2)。
分组 细胞凋亡率/% Control组 2.19±0.36 AS-Ⅳ 30 μmol/L组 7.51±1.49* AS-Ⅳ 60 μmol/L组 26.79±2.18**## AS-Ⅳ 120 μmol/L组 54.34±2.20**##▲▲ F 746.71 P < 0.01 MS组内 2.980 q检验:与Control组比较*P < 0.05, **P < 0.01;与AS-Ⅳ 30 μmol/L组比较##P < 0.01, 与AS-Ⅳ 60 μmol/L组比较▲▲P < 0.01 表 2 各组L929细胞凋亡率比较(ni=4;x±s)
-
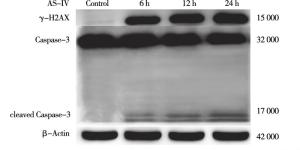
与Control组相比,AS-Ⅳ 60 μmol/L干预L929细胞6 h、12 h、24 h能升高细胞内cleaved Caspase-3及γ-H2AX蛋白表达(P < 0.05~P < 0.01)(见图 3、表 3)。与Control组相比,AS-Ⅳ 30、60、120 μmol/L分别处理L929细胞12 h能升高细胞内γ-H2AX和cleaved Caspase-3蛋白表达(P < 0.05~P < 0.01)(见图 4、表 4)。
分组 给药时间/h γ-H2AX/ β-actin cleaved Caspase-3/ β-actin Control 0 0.03±0.26 0.03±0.04 AS-Ⅳ 60 μmol/L组 6 0.52±0.04** 0.19±0.02* 12 0.61±0.02** 0.34±0.04* 24 0.76±0.02**#▲ 0.46±0.02**#▲ F — 23.09 135.07 P — < 0.01 < 0.01 MS组内 — 0.018 0.001 q检验:与Control组比较*P < 0.05,**P < 0.01;与6 h组比较#P < 0.05;与12 h组比较▲ P < 0.05 表 3 60 μmol/L AS-Ⅳ对L929细胞cleaved Caspase-3及γ-H2AX表达水平的影响(ni=4;x±s)
分组 γ-H2AX/ β-actin cleaved Caspase-3/ β-actin Control组 0.03±0.05 0.07±0.31 AS-Ⅳ 30 μmol/L组 0.40±0.02** 0.20±0.16* AS-Ⅳ 60 μmol/L组 0.73±0.13**## 0.38±0.27*# AS-Ⅳ 120 μmol/L组 0.89±0.20**##▲ 0.58±0.01**#▲ F 38.74 7.76 P < 0.01 < 0.05 MS组内 0.015 0.024 q检验:与Control组比较*P < 0.05,**P < 0.01;与AS-Ⅳ 30 μmol/L组比较#P < 0.05,##P < 0.01;与AS-Ⅳ 60 μmol/ L组比较▲P < 0.05 表 4 不同浓度AS-Ⅳ干预L929细胞12 h对cleaved Caspase-3及γ-H2AX表达水平的影响(ni=4;x±s)
-
Control组与0.3%DMSO组的划痕逐渐愈合,24 h后基本完全愈合,2组相对迁移率差异无统计学意义(P>0.05)。与Control组相比,AS-Ⅳ 30、60、120 μmol/L分别干预L929细胞12 h及24 h,相对迁移率均下降(P < 0.05~P < 0.01)(见图 5、表 5)。
分组 相对迁移率/% 12 h 24 h Control 41.62±1.87 98.18±4.04 0.3% DMSO组 43.79±2.39 96.95±2.10 AS-Ⅳ 30 μmol/L组 8.18±1.34* 11.99±3.22* AS-Ⅳ 60 μmol/L组 1.57±1.48**▲ 1.30±1.09**▲▲ AS-Ⅳ 120 μmol/L组 0.00±0.00**▲▲■■ 0.00±0.00**▲▲■■ F 723.99 1629.12 P < 0.01 < 0.01 MS组内 2.636 6.443 q检验:与Control组比较*P < 0.05,**P < 0.01;与AS-Ⅳ 30 μmol/L组比较▲P < 0.05,▲▲P < 0.01;与AS-Ⅳ 60 μmol/L组比较■■P < 0.01 表 5 AS-Ⅳ对L929细胞迁移能力的影响(ni=4;x±s)
-
皮肤组织创面愈合是一个复杂有序的过程,涉及多种组织修复细胞增殖分化、细胞外基质沉积和细胞因子相互调控[2, 11-12]。成纤维细胞通过快速的增殖分化和大量合成细胞外基质来填补皮肤受损区域,在伤口修复中扮演重要角色[3]。AS-Ⅳ作为传统中药黄芪的主要成分,具有抗炎、抗氧化、降糖和改善心血管疾病等广泛的生物活性[5]。有研究[9, 13-14]发现,给予5 μg/mL AS-Ⅳ作用于小鼠成纤维细胞,可促进其增殖,改善皮肤创面愈合。然而剂量大于30 μmol/L时,将会产生细胞毒性[11],目前关于AS-Ⅳ对成纤维细胞毒性的研究较少,本研究旨在探索AS-Ⅳ对成纤维细胞毒性及相关分子机制。
本研究通过给予不同的浓度AS-Ⅳ(30、60、90、120 μmol/L)干预L929细胞不同时间(6 h、12 h、24 h),在同一处理时间(12 h、24 h),随着给药浓度增加,其OD值逐渐降低。同一浓度AS-Ⅳ处理L929细胞12 h和24 h,其OD值低于处理6 h,这表明AS-Ⅳ浓度大于30 μmol/L时,L929细胞增殖受到不同程度抑制。30、60、120 μmol/L AS-Ⅳ干预L929细胞24 h后,细胞凋亡率均高于Control组。细胞划痕实验结果表明,30、60、120 μmol/L AS-Ⅳ干预L929细胞12 h及24 h后,细胞相对迁移率下降。同时,本研究AS-Ⅳ最高浓度组的DMSO浓度为0.3%,故以此浓度作为DMSO对照组,倒置显微镜下观察0.3% DMSO组与Control组细胞形态无明显差异,CCK8实验显示0.3% DMSO对细胞增殖无明显影响,细胞划痕实验显示0.3% DMSO对细胞迁移能力无明显影响,可证明DMSO浓度0.3%情况下,对L929细胞无毒性,对本实验结果无影响。
DNA受外界环境、食物、抗生素、肿瘤治疗化学性药物以及内源性代谢物等影响而受到损伤。不同程度的损伤会引起不同的反应,低水平的DNA损伤会触发修复和存活机制,而高水平的损伤会触发细胞死亡。DNA双链断裂快速触发组蛋白H2AX的磷酸化即γ-H2AX, 这是DNA断裂启动修复程序的第一步,当不能进行修复时将导致细胞凋亡乃至死亡[15-17]。因而γ-H2AX作为DNA损伤标志物[18-19]。本研究结果表明,30、60、120 μmol/L AS-Ⅳ干预L929细胞12 h,γ-H2AX随着药物浓度增加表达增加,给予60 μmol/L AS-Ⅳ处理6 h、12 h、24 h,随着时间增加γ-H2AX表达增加,提示L929细胞DNA损伤加重。cleaved Caspase-3作为Caspase-3活化形式,是执行细胞凋亡的关键调控点[20]。与Control组相比,30、60、120 μmol/L AS-Ⅳ干预L929细胞12 h,cleaved Caspase-3表达增加,60 μmol/L AS-Ⅳ干预6 h、12 h、24 h,随着给药时间增加cleaved Caspase-3表达增加。且与Control组相比,30、60、120 μ mol/L AS-Ⅳ处理L929细胞24 h,细胞凋亡率升高,提示AS-Ⅳ浓度大于30 μmol/L时诱导L929细胞的凋亡。
综上所述,AS-Ⅳ浓度大于30 μmol/L时,抑制小鼠成纤维细胞L929的增殖、迁移并诱导其凋亡,说明其对L929细胞存在细胞毒性。提示AS-Ⅳ的临床应用需要在一定浓度范围内,为AS-Ⅳ在皮肤组织愈合中的应用提供了实验基础。
黄芪甲苷对成纤维细胞的毒性研究
Study on the toxicity of astragaloside-Ⅳ to fibroblasts
-
摘要:
目的探索黄芪甲苷(astragaloside-Ⅳ, AS-Ⅳ)对小鼠成纤维细胞L929的毒性及影响机制, 为AS-Ⅳ在皮肤创伤治疗中的应用提供实验依据。 方法体外培养L929细胞, 在倒置显微镜下观察各组细胞形态, 采用CCK8检测细胞增殖, Annexin V-FITC/PI双染法检测细胞凋亡, Western blotting检测细胞内cleaved Caspase-3和γ-H2AX蛋白表达, 细胞划痕实验检测细胞迁移能力。 结果与Control组相比, 30、60、120 μmol/L的AS-Ⅳ处理L929细胞12 h、24 h, 随给药浓度及给药时间增加, 圆形细胞逐渐增多, 悬浮细胞增多, 死亡细胞逐渐增多。30、60、90、120 μmol/L AS-Ⅳ处理L929细胞12 h和24 h, 其OD值均低于Control组(P < 0.05~P < 0.01); 在同一处理时间, 随着给药浓度增加, 其OD值逐渐降低(P < 0.05~P < 0.01); 同一浓度AS-IV处理L929细胞12 h和24 h, 其OD值均低于处理6 h(P < 0.05~P < 0.01)。30、60、120 μmol/L AS-Ⅳ干预L929细胞24 h, 细胞凋亡率均高于Control组(P < 0.05~P < 0.01)。与Control组相比, 60 μmol/L AS-Ⅳ干预L929细胞6 h、12 h、24 h均能升高细胞内cleaved Caspase-3及γ-H2AX蛋白表达(P < 0.05~P < 0.01); 与Control组相比, 30、60、120 μmol/L AS-Ⅳ处理L929细胞12 h均能升高细胞内γ-H2AX和cleaved Caspase-3蛋白表达(P < 0.05~P < 0.01)。与Control组相比, 30、60、120 μmol/L AS-Ⅳ干预L929细胞12 h及24 h, 相对迁移率均下降(P < 0.05~P < 0.01)。 结论AS-Ⅳ浓度大于30 μmol/L时能抑制L929细胞增殖、迁移, 诱导其凋亡。 Abstract:ObjectiveTo investigate the cytotoxicity and mechanism of astragaloside-Ⅳ(AS-Ⅳ) on L929 cells, and provide the experimental basis for the application of AS-Ⅳ in treating skin wounds. MethodsThe L929 cells were cultured in vitro, and the cell morphology of each group was observed under inverted microscope.The cell proliferation was detected using CCK8, and the apoptosis was detected using Annexin V-FITC/PI double staining.The expression levels of cleaved Caspase-3 and γ-H2AX protein were detected using Western blotting, and the cell migration ability was detected using cell scratch test. ResultsCompared with the control group, the L929 cells were treated with 30, 60 and 120 μmol/L AS-Ⅳ for 12 h and 24 h, with the increasing of drug concentration and time, the number of round cells, suspended cells and dead cells increased gradually.The OD value of L929 cells treated with 30, 60, 90 and 120 μmol/L AS-Ⅳ for 12 h and 24 h were lower than that of control group(P < 0.05 to P < 0.01).At the same treatment time, with the increasing of drug concentration, the OD value decreased gradually(P < 0.05 to P < 0.01).The OD value of L929 cells treated with the same concentration of AS-Ⅳ for 12 h and 24 h were lower than that of L929 cells treated for 6 h(P < 0.05 to P < 0.01).The apoptosis rate of L929 cells treated with 30, 60 and 120 μmol/L AS-Ⅳ for 24 h were higher than that of control group(P < 0.05 to P < 0.01).Compared with the control group, the expression levels of cleaved Caspase-3 and γ-H2AX protein in L929 cells treated with 60 μmol/L AS-Ⅳ for 6 h, 12 h and 24 h increased(P < 0.05 to P < 0.01).Compared with the control group, the expression levels of cleaved caspase-3 and γ-H2AX protein in L929 cells treated with 30, 60 and 120 μmol/L AS-Ⅳ for 12 h increased(P < 0.05 to P < 0.01).Compared with the control group, the relative mobility of L929 cells treated with 30, 60 and 120 μmol/L AS-Ⅳ for 12 h and 24 h decreased(P < 0.05 to P < 0.01). ConclusionsWhen the concentration of AS-Ⅳ is higher than 30 μmol/L, it can inhibit the proliferation and migration, and induce the apoptosis of L929 cells. -
Key words:
- astragaloside-Ⅳ /
- fibroblast /
- proliferation /
- apoptosis
-
表 1 AS-Ⅳ干预后L929细胞各组OD值比较(ni=8;x±s)
分组 6 h OD值 12 h OD值 24 h OD值 F P MS组内 Control组 1.81±0.01 1.90±0.01 2.18±0.04 540.51 < 0.01 0.000 0.3% DMSO组 1.81±0.34 1.93±0.22 2.17±0.04 5.20 < 0.05 0.055 AS-Ⅳ 30 μmol/L组 1.75±0.25 1.73±0.32* 1.43±0.01** 4.53 < 0.05 0.055 AS-Ⅳ 60 μmol/L组 1.67±0.20* 1.55±0.01**▲ 1.42±0.03**▲ 9.15 < 0.05 0.014 AS-Ⅳ 90 μmol/L组 1.58±0.22*▲ 1.42±0.10**▲▲■ 1.35±0.04**▲■ 5.50 < 0.05 0.020 AS-Ⅳ 120 μmol/L组 1.39±0.16*▲■△ 1.16±0.01**▲▲■■△ 0.91±0.15**▲▲■■△△ 28.18 < 0.01 0.017 F 4.20 26.53 412.41 — — — P < 0.05 < 0.01 < 0.01 — — — MS组内 0.049 0.026 0.005 — — — q检验:与Control组比较*P < 0.05,**P < 0.01;与0.3% DMSO组比较#P < 0.05;与AS-Ⅳ 30 μmol/L组比较▲P < 0.05,▲▲P < 0.01;与AS-Ⅳ 60 μmol/ L组比较■P < 0.05,■■P < 0.01;与AS-Ⅳ 90 μmol/L组比较△P < 0.05, △△P < 0.01 表 2 各组L929细胞凋亡率比较(ni=4;x±s)
分组 细胞凋亡率/% Control组 2.19±0.36 AS-Ⅳ 30 μmol/L组 7.51±1.49* AS-Ⅳ 60 μmol/L组 26.79±2.18**## AS-Ⅳ 120 μmol/L组 54.34±2.20**##▲▲ F 746.71 P < 0.01 MS组内 2.980 q检验:与Control组比较*P < 0.05, **P < 0.01;与AS-Ⅳ 30 μmol/L组比较##P < 0.01, 与AS-Ⅳ 60 μmol/L组比较▲▲P < 0.01 表 3 60 μmol/L AS-Ⅳ对L929细胞cleaved Caspase-3及γ-H2AX表达水平的影响(ni=4;x±s)
分组 给药时间/h γ-H2AX/ β-actin cleaved Caspase-3/ β-actin Control 0 0.03±0.26 0.03±0.04 AS-Ⅳ 60 μmol/L组 6 0.52±0.04** 0.19±0.02* 12 0.61±0.02** 0.34±0.04* 24 0.76±0.02**#▲ 0.46±0.02**#▲ F — 23.09 135.07 P — < 0.01 < 0.01 MS组内 — 0.018 0.001 q检验:与Control组比较*P < 0.05,**P < 0.01;与6 h组比较#P < 0.05;与12 h组比较▲ P < 0.05 表 4 不同浓度AS-Ⅳ干预L929细胞12 h对cleaved Caspase-3及γ-H2AX表达水平的影响(ni=4;x±s)
分组 γ-H2AX/ β-actin cleaved Caspase-3/ β-actin Control组 0.03±0.05 0.07±0.31 AS-Ⅳ 30 μmol/L组 0.40±0.02** 0.20±0.16* AS-Ⅳ 60 μmol/L组 0.73±0.13**## 0.38±0.27*# AS-Ⅳ 120 μmol/L组 0.89±0.20**##▲ 0.58±0.01**#▲ F 38.74 7.76 P < 0.01 < 0.05 MS组内 0.015 0.024 q检验:与Control组比较*P < 0.05,**P < 0.01;与AS-Ⅳ 30 μmol/L组比较#P < 0.05,##P < 0.01;与AS-Ⅳ 60 μmol/ L组比较▲P < 0.05 表 5 AS-Ⅳ对L929细胞迁移能力的影响(ni=4;x±s)
分组 相对迁移率/% 12 h 24 h Control 41.62±1.87 98.18±4.04 0.3% DMSO组 43.79±2.39 96.95±2.10 AS-Ⅳ 30 μmol/L组 8.18±1.34* 11.99±3.22* AS-Ⅳ 60 μmol/L组 1.57±1.48**▲ 1.30±1.09**▲▲ AS-Ⅳ 120 μmol/L组 0.00±0.00**▲▲■■ 0.00±0.00**▲▲■■ F 723.99 1629.12 P < 0.01 < 0.01 MS组内 2.636 6.443 q检验:与Control组比较*P < 0.05,**P < 0.01;与AS-Ⅳ 30 μmol/L组比较▲P < 0.05,▲▲P < 0.01;与AS-Ⅳ 60 μmol/L组比较■■P < 0.01 -
[1] YANG HL, TSAI YC, KORIVI M, et al. Lucidone promotes the cutaneous wound healing process via activation of the PI3K/AKT, Wnt/β-catenin and NF-κB signaling pathways[J]. Biochim Biophys Acta Mol Cell Res, 2017, 1864(1): 151. doi: 10.1016/j.bbamcr.2016.10.021 [2] SHAW TJ, MARTIN P. Wound repair: a showcase for cell plasticity and migration[J]. Curr Opin Cell Biol, 2016, 42(1): 29. [3] RODRIGUES M, KOSARIC N, BONHAM CA, et al. Wound healing: a cellular perspective[J]. Physiol Rev, 2019, 99(1): 665. doi: 10.1152/physrev.00067.2017 [4] THULABANDU V, CHEN D, ATIT RP. Dermal fibroblast in cutaneous development and healing[J]. Wiley Interdiscip Rev Dev Biol, 2018, 7(2): 10. [5] LI L, HOU X, XU R, et al. Research review on the pharmacological effects of astragaloside IV[J]. Fundam Clin Pharmacol, 2017, 31(1): 17. doi: 10.1111/fcp.12232 [6] LUO X, HUANG P, YUAN B, et al. Astragaloside IV enhances diabetic wound healing involving upregulation of alternatively activated macrophages[J]. Int Immunopharmacol, 2016, 35(1): 22. [7] 李文, 旷雨, 孟立峰, 等. 黄芪甲苷对宫颈癌Hela细胞增殖、迁移侵袭作用机制研究[J]. 中药药理与临床, 2018, 34(3): 39. [8] ROGERS COREY, FERNANDES-ALNEMRI TERESA, MAYES LINDSEY, et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death[J]. Nat Commun, 2017, 8: 14128. doi: 10.1038/ncomms14128 [9] 邓鑫梦, 戴良成, 罗晓春, 等. 黄芪甲苷调节成纤维细胞功能活性的作用研究[J]. 广东药科大学学报, 2019, 35(3): 390. [10] 刘红艳, 齐创. 萝卜硫素调控TGF-β1/Smad信号通路抑制结肠癌HT-29细胞增殖的机制研究[J]. 蚌埠医学院学报, 2020, 45(3): 311. [11] 邹照银, 郑府, 徐先顺, 等. 黄芪甲苷通过SDF-1/CXCR4信号通路诱导人肾腺癌细胞的凋亡[J]. 中国临床药理学与治疗学, 2019, 24(6): 665. [12] TAKEO M, LEE W, ITO M. Wound healing and skin regeneration[J]. Cold Spring Harb Perspect Med, 2015, 5(1): a023267. doi: 10.1101/cshperspect.a023267 [13] PARFEJEVS V, DEBBACHE J, SHAKHOVA O, et al. Injury-activated glial cells promote wound healing of the adult skin in mice[J]. Nat Commun, 2018, 9(1): 236. doi: 10.1038/s41467-017-01488-2 [14] LEE SY, CHANG WL, LI ZX, et al. Astragaloside IV and cycloastragenol-6-O-β-D-glucoside promote wound healing in vitro and in vivo[J]. Phytomedicine, 2018, 38(1): 183. [15] ULLA, PLAPPERT-HELBIG, SILVANA, LIBERTINI, et al. Gamma-h2ax immunofluorescence for the detection of tissue-specific genotoxicity in vivo[J]. Environ Mol Mutagen, 2019, 60(1): 4. [16] KAWASHIMA S, KAWAGUCHI N, TANIGUCHI K, et al. γ-H2AX as a potential indicator of radiosensitivity in colorectal cancer cells[J]. Oncol Lett, 2020, 20(3): 2331. doi: 10.3892/ol.2020.11788 [17] NOREN HOOTEN N, EVANS MK. Techniques to induce and quantify cellular senescence[J]. J Vis Exp, 2017, 123(1): 55533. [18] RIFFLE S, PANDEY RN, ALBERT M, et al. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids[J]. BMC Cancer, 2017, 17(1): 338. doi: 10.1186/s12885-017-3319-0 [19] VARVARA PV, KARAOLANIS G, VALAVANIS C, et al. Gamma-H2AX: a potential biomarker in breast cancer[J]. Tumour Biol, 2019, 41(9): 101. [20] COREY R, TERESA FA, LINDSEY M, et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death[J]. Nat Commun, 2017, 8(1): 14128. doi: 10.1038/ncomms14128 -





 下载:
下载: